急性心肌梗死合并心力衰竭患者血浆miR-31、miR-132、miR-133a水平及意义
徐莎
(成都医学院第二附属医院·核工业四一六医院心内科,四川 成都 610051)
急性心肌梗死(acute myocardial infarction,AMI)是在冠心病的基础上,因血栓形成、斑块破裂导致的局部心肌缺血、缺氧性坏死,随之出现胸闷胸痛、心跳加快、呼吸困难、恶心呕吐等症状的临床综合征,是威胁我国民众的常见心血管疾病[1]。AMI患者由于心脏泵血功能下降,交感神经系统和肾素-血管紧张素-醛固酮系统(RAAS)过度激活,普遍处于神经体液调节紊乱失衡状态,易发生急性血流动力学障碍,导致组织灌注不足,心功能下降,出现心力衰竭(heart failure,HF)[2]。一项调查研究[3]显示,心肌梗死患者住院期间HF发生率为13.6%~14.8%,其1年后合并HF者可达25%。目前一致认为,在缺血发生的早期积极使用药物抑制HF进程,逆转心肌重构是抑制AMI合并HF患者病程恶化、治疗成功的关键。因此,探索预测AMI合并HF的生物标记物,是临床的研究热点。近几年随着研究的深入,微小RNA(miRNA)在众多心血管疾病的机制中表现出很强的相关性。miR-31参与细胞DNA的复制、增殖。miR-132可抑制心血管内皮细胞增殖和集落形成。田焕平等[4]研究指出,miR-31、miR-132在AMI合并HF患者的血清中呈高表达。徐振宇等[5]研究发现,miR-133a与慢性心力衰竭(CHF)患者心室重构、心功能改变有关。本研究通过观察AMI合并HF患者血浆miR-31、miR-132、miR-133a水平,以了解其临床意义。
1 资料与方法
1.1 一般资料
选择2019年1月至2022年1月成都市核工业四一六医院收治的90例AMI合并HF患者(观察组)和50例AMI未合并HF的患者(对照组)。本研究获得医院伦理委员会批准同意,纳入对象均签订知情同意书。纳入标准:(1)对照组符合《急性心肌梗死诊断和治疗指南》中[6]AMI诊断要求,并经影像学检查证实,(2)观察组在明确诊断AMI的基础上符合HF诊断[7]:患者有高血压、冠心病等病史,休息或运动时伴呼吸困难、乏力、下肢水肿临床症状,伴心动过速、呼吸急促、肺部啰音、胸腔积液、颈静脉压力增高、外周水肿、肝脏肿大体征,伴心腔扩大、第三心音、心脏杂音、超声心动图异常、利钠肽(BNP/NT-proBNP)水平升高等心脏结构或功能异常,伴收缩性心力衰竭或舒张性心力衰竭特征;(3)Killip分级[8]为Ⅱ~Ⅳ级;(4)临床资料齐全。排除标准:(1)自身免疫性疾病;(2)肝肾严重障碍;(3)恶性肿瘤;(4)严重感染性疾病;(5)意识障碍或严重精神疾病;(6)近1周内使用过可能影响血脂功能及炎症反映者。
1.2 方法
抽取两组患者入院时肘静脉血,行常规生化检验。肌钙蛋白Ⅰ(cTnⅠ)、肌酸激脢(CK-MB)、N末端脑钠肽前体(NT-proBNP)采用MQ60全自动化学发光免疫分析仪测定(北京热景生物技术股份有限公司,试剂盒与厂家配套)。左室射血分数(LVEF)采用Philips IE33超声检测仪(上海涵飞医疗器械有限公司)检测。用EDTA抗凝管采集患者外周血2 mL,上下颠倒混匀,3 000 rpm离心10min,抽取上清液至无酶离心管-80 ℃保存待测。待冻存的血浆样本融化后,按1∶1比例抽取全血血浆加入红细胞裂解剂混匀,12 000 rpm离心1 min,弃上清液,采用TRIzol法提取血浆总RNA,测定总RNA浓度、纯度及完整性,将含RNA的脱洗液收集后进行分装,-80 ℃保存备用。通过查找miRNA数据库,针对每种miRNA设计相同茎环结构的基因特异性反向引物,使用TapMan miRNA逆转录试剂盒(购自美国Thermo Fisher公司)将DNA逆转录为cDNA,样本置-20 ℃保存。采用基于TaqMan探针(购自美国ABI公司)的qRT-PCR方法(试剂盒反应系统购自TaKaRa公司)检测血浆miR-31、miR-132、miR-133a表达,仪器使用ABI 7500 PCR仪,PCR循环参数:95 ℃ 5min、95 ℃ 15s、60 ℃ 1min共40个循环,以U6作为内参照,3个miRNA及内参β-actin引物序列见表1。采用2-△△Ct法计算miRNA的相对表达量。

表1 miRNA引物序列
1.3 观察指标
(1)两组基线资料,包括:性别、年龄、体质指数(BMI)、个人史(吸烟、饮酒)、合并症(高血压、高脂血症、糖尿病)。(2)两组cTnⅠ、CK-MB、NT-proBNP、LVEF比较。(3)各组miR-31、miR-132、miR-133a比较。(4)血浆miR-31、miR-132、miR-133a与各病理参数的关系。(5)血浆miR-31、miR-132、miR-133a对AMI合并HF的早期预测价值。
1.4 统计学分析
2 结果
2.1 两组患者一般资料比较
两组患者性别、年龄、BMI、饮酒情况、高血压、高脂血症及糖尿病合并症比较,差异无统计学意义(P>0.05);观察组吸烟比例高于对照组(P<0.05)。见表2。
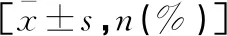
表2 两组患者一般资料比较
2.2 两组cTnⅠ、CK-MB、NT-proBNP、LVEF比较
与对照组相比,观察组cTnⅠ、CK-MB、NT-proBNP水平更高,LVEF水平更低,差异有统计学意义(P<0.05)。见表3。
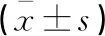
表3 两组cTnⅠ、CK-MB、NT-proBNP、LVEF比较
2.3 两组血浆miR-31、miR-132、miR-133a表达比较
与对照组相比,观察组血浆miR-31、miR-133a表达更高,miR-132表达更低,差异有统计学意义(P<0.05)。见表4。
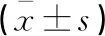
表4 两组血浆miR-31、miR-132、miR-133a表达比较
2.4 观察组血浆miR-31、miR-132、miR-133a表达与其病理参数的关系
观察组患者血浆miR-31、miR-133a与cTnⅠ、CK-MB、NT-proBNP分别呈正相关,与LVEF呈负相关;血浆miR-132与cTnⅠ、CK-MB、NT-proBNP呈负相关(P<0.05)。见表5。
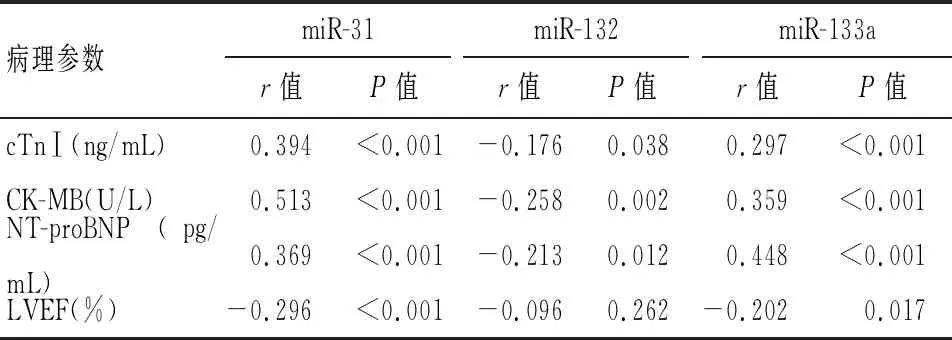
表5 观察组血浆miR-31、miR-132、miR-133a表达与其病理参数的关系
2.5 血浆miR-31、miR-132、miR-133a对AMI合并HF的早期预测价值
ROC曲线分析发现,血浆miR-31、miR-132、miR-133a联合预测AMI合并HF的曲线下面积(AUC)为0.803,均高于miR-31、miR-132、miR-133a单独预测(AUC=0.681、0.686、0.620)。见图1、表6。

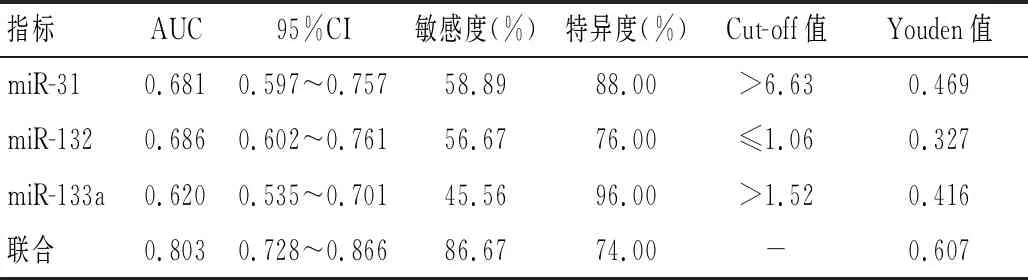
表6 血浆miR-31、miR-132、miR-133a对AMI合并HF的预测效能
3 讨论
AMI是心内科常见急症,此时患者由于心脏泵血功能下降,交感神经系统和肾素-血管紧张素-醛固酮系统(RAAS)过度激活,普遍处于神经体液调节紊乱失衡状态,易发生急性血流动力学障碍,导致组织灌注不足,心功能下降,出现HF,使得病情更加危重[9-10]。因此,早期预测AMI合并HF,便能及早治疗,对改善患者心功能,抑制心肌重塑有重要意义。近几年,miRNA在疾病诊断和预后评估中颇受关注。国外大量研究[11-12]证实,miRNA可调控细胞分化、增值、凋亡、坏死等几乎所有的细胞功能,参与肿瘤、过敏性疾病以及炎症等多种疾病。国内相关研究[13]也表明,当心肌细胞发生损伤时,心肌细胞会释放出 miRNA,并进入血液循环中,故推测miRNA有可能作为心血管病诊治和监测的重要潜在工具。
本研究选取了miR-31、miR-132、miR-133a三种特异性miRNA进行对比研究,结果发现,观察组血浆miR-31、miR-133a表达高于对照组,LVEF及血浆miR-132表达低于对照组,说明AMI患者一旦发生HF,其血浆miR-31、miR-133a在外周血中迅速增加,在组织损伤后很早就释放到循环中,而miR-132的作用机制与miR-31、miR-133a相反,发生HF后其水平迅速降低。其原因可能是:AMI早期病变时,内皮细胞受损,促使线粒体分泌大量活性氧,脂蛋白聚集于血管内膜上,激活炎症反应,造成氧化应激和心肌损伤,导致血浆中miR-31、miR-133a表达升高,miR-132降低,诱导心肌损伤,加重病变严重程度[14]。miR-31可调节包括Prlr/Stat5、TGFβ、Wnt /β-连环蛋白等多种信号通路。Wu等[15]发现,miR-31与心肌梗死的病理有关。miR-132由长度为66 pb的前体序列加工而成,参与调控癌症、免疫炎症以及心血管疾病。Su等[16]研究证实,长链非编码RNA 牛磺酸上调基因 1 (TUG1)/miR-132可介导缺血性心肌损伤。miR-133a是心肌梗死的诊断标志物,已有不少的人和动物研究[17-18]证明,miR-133a在心肌梗死中增高,并有重要的调控作用。上述研究均证实了,miR-31、miR-132、miR-133a在AMI合并HF的发生、发展中发挥着重要作用。
目前,对于AMI患者HF相关miRNA的表达及功能研究多集中于动物实验中,有关临床患者的研究极少。cTnⅠ是调节肌肉收缩的肌钙蛋白复合物当中的一种组成成分,具有高度的心肌特异性和灵敏度。CK-MB在骨骼肌、心肌、平滑肌中表达较多,用于评估心肌坏死的特异性较高,二者均是临床常用于评估急性心肌梗死病情进展的常用指标[19-20]。NT-proBNP由完整的心肌细胞合成和分泌,其被发现可能参与心脏自我调节和代偿新功能不全[21]。LVEF可综合反映左心室泵血功能、心肌收缩力,当LVEF<50%时提示左心室收缩功能障碍[22]。本研究显示,观察组血清cTnⅠ、CK-MB、NT-proBNP水平高于对照组,而LVEF低于对照组,且Pearson分析显示,观察组血浆miR-31、miR-133a与cTnⅠ、CK-MB、NT-proBNP分别呈正相关,与LVEF呈负相关;miR-132与cTnⅠ、CK-MB、NT-proBNP呈负相关。这提示着,AMI合并HF患者较单纯AMI患者普遍存在心肌受损、心功能下降现象,患者心肌损伤、左心功能障碍越严重,其血浆中miR-31、miR-133a表达越高,miR-132表达越低。进一步绘制ROC曲线发现血浆miR-31、miR-132、miR-133a联合预测AMI合并HF的AUC为0.803,均高于miR-31、miR-132、miR-133a单独预测,证实了血浆miR-31、miR-132、miR-133a联合检测在AMI合并HF的早期预测中具有较高价值,可以作为AMI合并HF的候选诊断生物学标记物,便于区分AMI合并HF和未合并HF患者。
综上,血浆miR-31、miR-133a随AMI合并HF病情加重而升高,血浆miR-132反之。检测患者入院时血浆miR-31、miR-132、miR-133a水平有助于早期预测AMI是否合并HF,具有较高的临床应用价值。但本研究为单中心对照研究,证据强度不足,并且未动态检测伴随时间推移或患者心功能改变状态下的血浆miR-31、miR-132、miR-133a表达水平,以上不足有待后期开展多中心随机对照试验进一步验证。

