外周血CRP、Myo及CK-MB水平与AMI患者梗死部位、心室重构的相关性分析
杨金凤,王家伟,林强,王德芳
(泸州市人民医院心血管内科,四川 泸州 646000)
急性心肌梗死(acute myocardial infarction,AMI)是动脉粥样病变为基础的严重危及生命的常见心脏病[1]。近年来该病发病率不断升高,虽然随着PCI手术的推广,AMI的死亡率明显下降,但是该类患者会出现心室重构(ventricular remodeling,VR),VR是造成AMI患者死亡及治疗失败的重要因素之一[2]。确定AMI入院时梗死部位,并寻找有效标志物早期诊断AMI,对改善患者预后、降低病死率具有重要意义[3]。研究[4]表明AMI的进展与炎症反应相关,C反应蛋白(CRP)肝脏合成的微量蛋白,有学者认为CRP与AMI的疾病进展相关。当患者出现严重的心肌缺血或者心肌坏死时,肌酸激酶同工酶(CK-MB)会在AMI发病4~8 h开始升高,能够反映梗死病灶大小[5]。而肌红蛋白(Myo)是一种非酶类小分子蛋白质,分子量为16.7KD,在正常人血清中含量较低;有研究[6]表明在AMI患者胸痛发生的1~2 h,Myo就被快速释放入血液中,同时其窗口期较短,易于被肾脏清除。本研究拟检测AMI患者外周血CRP、Myo及CK-MB水平,分析与AMI患者梗死部位、心室重构的相关性。
1 资料与方法
1.1 一般资料
选择2018年1月至2020年12月于泸州市人民医院就诊的108例AMI患者,作为AMI组,患者入院后进行急诊PCI或者择期PCI,并采用其他药物进行辅助治疗。纳入标准:(1)符合AMI诊断标准[7],存在缺血性胸痛病史,心电图动态演变,心肌坏死的血清心肌标记物浓度的动态改变;(2)经冠状动脉造影确诊;(3)患者临床资料齐全。排除标准:(1)伴有恶性肿瘤患者;(2)高血压危象患者;(3)既往存在心力衰竭、急性心肌梗死病史患者;(4)伴有严重肝、肾疾病患者;(5)存在急慢性感染或呼吸系统疾病患者;(6)存在严重电解质紊乱患者;(7)伴发脑血管疾病患者。选择同期来本院体检,无心脏、肝、肾等疾病的100名健康志愿者作为对照组。两组患者的一般资料比较,差异均无统计学意义(P>0.05)。见表1。
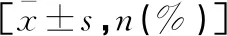
表1 两组研究对象一般资料比较
1.2 观察指标
(1)记录受试者的一般资料:包括性别、年龄、受教育程度、身高、体重,并计算身体质量指数。(2)血清学指标检测:受试者入院后采集其静脉血3 mL,离心后取上层清液,采用锦瑞PA300全自动蛋白分析仪器检测血清CRP,采用雅培2000i化学发光分析仪器检测Myo、CK-MB水平。(3)AMI患者的心功能检测:AMI患者溶栓1周及PCI术后6个月时,采用飞利浦EPIQ7c超声仪行心脏彩色超声检测,S3经胸探头,测量左心室射血分数(LVEF),计算左室舒张末期容积指数(LVEDVI),△LVEDVI=(LVEDVI 2-LVEDVI 1)/LVEDVI 1,其中LVEDVI 1为溶栓后1周的LVEDVI,LVEDVI 2为PCI术后6个月的LVEDVI,如果△LVEDVI≥20%,则诊断为VR[8],分成VR组(n=42)及非VR组(n=66)例。(4)随访:于患者PCI术后1、3、6个月,采用门诊及电话随访,记录心脏不良事件(MACE)发生情况。
1.3 统计学分析
2 结果
2.1 AMI组与对照组的外周血CRP、Myo及CK-MB水平比较
AMI组外周血CRP、Myo及CK-MB水平均高于对照组(P<0.05)。见表2。
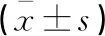
表2 AMI组与对照组的外周血CRP、Myo及CK-MB水平比较
2.2 外周血CRP、Myo及CK-MB水平与AMI患者梗死部位的关系
前壁组的外周血CRP、Myo及CK-MB水平均高于非前壁组(P<0.05)。见表3。
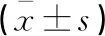
表3 外周血CRP、Myo及CK-MB水平与AMI患者梗死部位的关系
2.3 外周血CRP、Myo及CK-MB水平与AMI患者梗死部位ROC曲线分析
采用ROC曲线分析发现,CRP、Myo、CK-MB诊断AMI为前壁组的AUC分别为0.757、0.681、0.876。见表4。
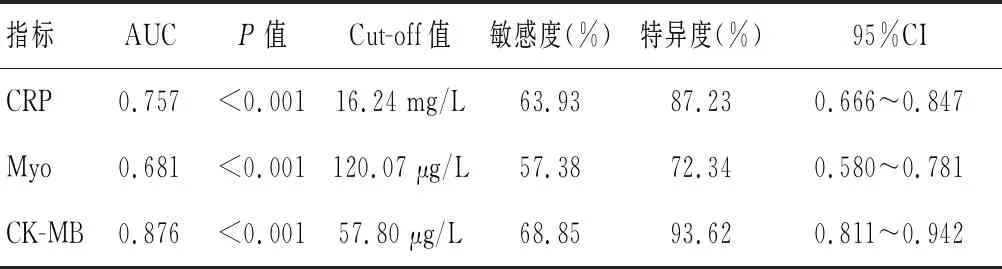
表4 外周血CRP、Myo及CK-MB水平与AMI患者梗死部位ROC曲线分析
2.4 外周血CRP、Myo及CK-MB水平与AMI患者心室重构的关系
VR组的外周血CRP、Myo及CK-MB水平均高于NVR组(P<0.05)。见表5。
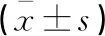
表5 外周血CRP、Myo及CK-MB水平与AMI患者心室重构的关系
2.5 外周血CRP、Myo及CK-MB水平预测AMI患者心室重构ROC曲线分析
采用ROC曲线分析发现,CRP、Myo、CK-MB预测AMI出现VR的AUC分别为0.757、0.681、0.876。见表6。
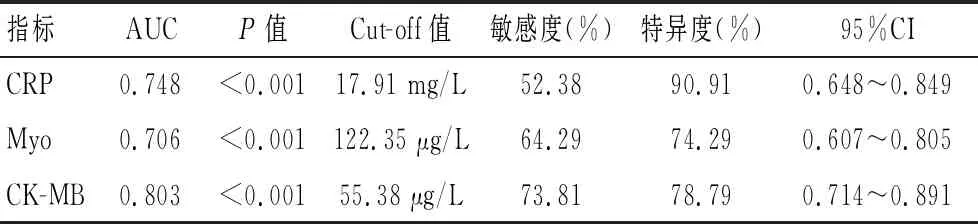
表6 外周血CRP、Myo及CK-MB水平预测AMI患者心室重构的ROC曲线分析
2.6 AMI患者心功能比较
VR组的LVEDVI 2水平高于NVR组(P<0.05),而两组的LVEDVI 1、LVEF 1、LVEF 2水平比较,差异无统计学意义(P>0.05)。见表7。
表7 AMI患者心功能比较
2.7 VR组与NVR组MACE发生情况
VR组患者的MACE发生率(28.57%)高于NVR组(9.08%)(P<0.05)。见表8。
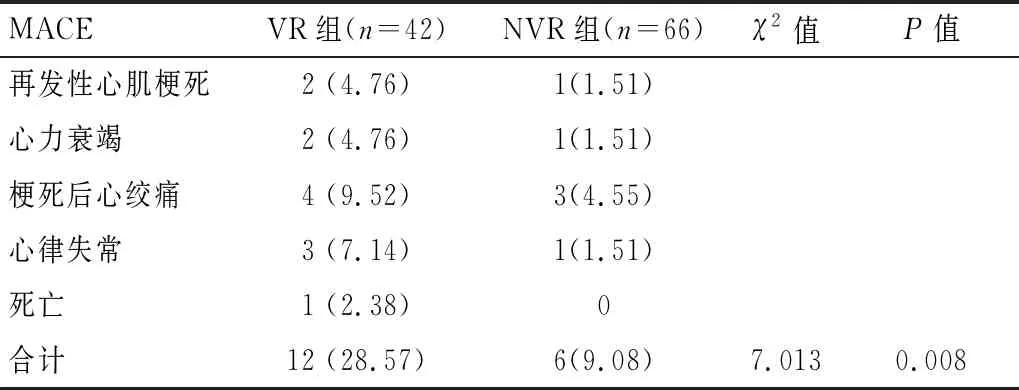
表8 VR组与NVR组MACE发生情况[n(%)]
3 讨论
许多研究[9]认为AMI的进展与炎症反应相关,CRP是由肝脏细胞合成的与心血管相关的急性期反应蛋白,在AMI发生的早期水平升高,并于8~12 h出现最高峰。本研究中AMI组的外周血CRP水平高于对照组,前壁组的CRP水平高于非前壁组,同时VR组的CRP水平高于NVR组,采用ROC曲线分析发现,CRP诊断AMI为前壁组的AUC为0.757,其预测AMI出现VR的AUC为0.748,提示AMI患者的CRP水平较健康人高,与梗死部位、心室重构均存在一定关系。由于前壁心肌梗死后出现容量超负荷代偿现象,另与前壁心肌梗死时交感神经兴奋性相关,下壁、后壁、右室总体面积相对较小,前壁病变范围较大,心尖部心肌较薄,因而发生心肌缺血坏死时易导致左室张力增大,压力负荷恶化[10]。CRP可结合脂蛋白,并激活患者体内补体系统,导致血管内皮受损,并激活冠状动脉粥样斑块的不稳定、破裂引起AMI的发生[11]。而机体炎症反应越激烈,CRP水平越高,心脏结构改变越显著,患者心功能下降,说明CRP与心室重构的发生相关[12]。李霖等[13]研究表明,Hs-CRP水平与AMI后VR密切相关,是预测AMI后心室重构程度的可靠指标,这与本研究具有一致性。
CK-MB是重要的心肌酶谱之一,研究[14]表明其在诊断AMI时具有较高特异性,可反应心肌梗死面积大小。Myo是肌肉内储氧蛋白,在AMI出现胸痛症状2~3 h后即可出现在外周血中,由肾脏代谢出体外。杨坤等[15]研究表明AMI后心力衰竭患者的心功能衰竭,使得Myo被释放入血液,其水平与LVEDD、LVMI、LAD均呈正相关,说明其与VR密切相关,可辅助预测AMI后心力衰竭患者预后。本研究中,AMI组的Myo、CK-MB水平均高于对照组,前壁组的外周血Myo、CK-MB水平均高于非前壁组,VR组的这两项指标水平均高于NVR组。采用ROC曲线分析发现,Myo、CK-MB诊断AMI为前壁组的AUC分别为0.681和0.876,Myo、CK-MB预测AMI出现VR的AUC分别为0.706和0.803,提示AMI患者的Myo、CK-MB水平均高于健康人,且与梗死部位、心室重构存在一定关系。AMI患者发生VR时,心脏形变能力降低,心室体积增加,造成心肌细胞损伤加重,导致大量CK-MB、Myo被释放进入血液[16]。Fan等[14]研究表明联合检测CK-MB与Myo水平,有利于AMI的早期诊治,从而降低急性期AMI的死亡率。雷蕾等[17]研究表明AMI患者血清Myo及CK-MB均高于健康人群,且CK-MB与Myo的浓度成正相关,两者可作为PCI手术的早期评估指标。
LVEDVI及LVEF水平能反映患者心室重构情况,本研究VR组的LVEDVI 2水平高于NVR组,而两组LVEDVI 1、LVEF 1、LVEF 2水平比较,差异无统计学意义,提示进行PCI术后仍会存在心室重构的可能性。而AMI患者因病情变化较快,常存在心脏不良事件,本研究中VR组患者的MACE发生率高于NVR组,主要由于VR是心脏不良事件的病理生理基础,患者因微循环障碍、炎症反应刺激等,心肌不断损伤,导致MACE发生[18]。当然本研究中也存在一定的不足,本研究样本量纳入较少,同时对于外周血CRP、Myo、CK-MB水平未进行动态追踪,因而在后续将联合多中心进行研究。
综上,AMI患者的外周血CRP、Myo、CK-MB水平均高于健康人,且与梗死部位、心室重构存在一定关系,在临床中可进行动态观察这三项指标,以便及时对患者进行干预,延缓心室重构的发展。

