细粒棘球绦虫体外不同发育时期EgM9基因差异表达研究
陈云英,王冰洁,潘星羽,余婉容,吾力江·卡马力,赵 莉,班万里,刘 帅,郭 璐,段兰利,徐 晶,穆尼拉·特列吾汗,喻昌盛,乌云花,张壮志
细粒棘球蚴病俗称囊型包虫病(Cystic echinococcosis,CE),是由细粒棘球绦虫(Echinococcosisgranulosus,Eg)中绦期幼虫引起的一种人兽共患寄生虫病[1-2]。Eg在犬的小肠内发育为成虫,45 d后发育为带有孕节的成虫释放虫卵,虫卵随粪便排出体外,污染外界环境[3]。在中亚地区,至少有2.7亿人处于囊型棘球蚴病的高危环境中[4]。2012—2016年的一项全国调查显示,中国西部地区约有5 000万人有感染该病的风险,其中约有17万人是棘球蚴病患者[5]。我国是包虫病发病率最高的国家之一,病例多发于新疆、宁夏、西藏等以畜牧业为主要经济来源的地区[6],该病主要寄生于肝肺,危害主要以机械性损害为主,严重程度取决于感染棘球蚴的体积、数量、寄生时间等[7]。
包虫病在我国高发流行,但目前缺乏有效的技术手段控制该病。犬作为传播的核心传染源,缺乏有效的疫苗接种,关键原因在于缺乏明确功能的疫苗靶基因。通过差异显示和基因组学研究不同发育阶段的虫体,发现EgM9基因是细粒棘球绦虫成虫阶段的特异基因,尤其在其体表和睾丸中高表达[9]。用原核表达抗原接种犬可明显减少虫体数量和抑制虫体发育,提示EgM9可能是虫体发育尤其是睾丸发育的关键基因,影响精子的产生。目前在GenBank中还没有发现与编码EgM9蛋白的相似序列,对于EgM9蛋白的功能以及成熟虫体虫卵的基因表达的研究也不是十分清楚[10]。EG-09888基因在细粒棘球绦虫成虫减数分裂受精卵的形成过程中高表达[11-12],所以本试验通过建立细粒棘球绦虫原头蚴(protoscoleces,PSCs)向成虫方向发育体外培养模型,用荧光定量PCR方法确定不同发育时期EgM9及EG-09888的表达情况,为探索EgM9基因在细粒棘球绦虫成虫发育中的功能奠定基础。
1 材料与方法
1.1 伦理申明 本研究获得了新疆畜牧科学院兽医研究所伦理委员会的批准(批准号:2021-03),所有动物均按照中华人民共和国动物伦理程序和指南进行处理。
1.2 虫株 细粒棘球绦虫原头蚴(PSCs)采自于新疆乌鲁木齐市华凌市场新鲜屠宰的自然感染细粒棘球蚴的绵羊肝脏,细粒棘球绦虫(Eg)由本实验室分离保存。
1.3 主要试剂 RPMI-1640培养基、双抗(Hyclone公司);胎牛血清(BI);酵母、葡萄糖、牛磺胆酸盐、胰蛋白酶、胃蛋白酶、1%亚甲基蓝(Sigma公司);苏木素染液(北京中杉金桥生物技术有限公司);RNA提取试剂盒(北京天根生化科技有限公司);cDNA反转录试剂盒、2×SG Fast qPCR Mix(上海生工生物技术有限公司)。
1.4 方 法
1.4.1 原头蚴的采集 将自然感染带有包囊的绵羊肝脏带回实验室,用蒸馏水冲洗肝脏表面,用75%酒精进行表面消毒,在超净台中切开包囊,吸出囊液,从中分离出细粒棘球绦虫原头蚴,用含双抗的PBS清洗5遍。
1.4.2 原头蚴的活力检测 按照1∶10的比例加入1%的胃蛋白酶溶液(pH2.0),37 ℃水浴消化30 min后,用含双抗的PBS清洗3遍,1 μL原头蚴加入1%亚甲基蓝9 μL染色3 min检测活力。活性好的原头蚴呈无色,活性差的呈蓝色,重复3次取平均值,活力达到99%以上的原头蚴可用于体外培养试验。若活力在95%以下,建议增加漂洗次数除去活力不佳的原头蚴后重新检测[13-14]。
1.4.3 体外培养模型的建立 将5 000枚原头蚴加入细胞培养瓶中,加入含20%胎牛血清的完全培养基(61 mLRPMI-1640,20 mL胎牛血清,10 mL 2%胰蛋白酶,4.5 mL 5%酵母,1.5 mL 3%葡萄糖,1 mL青链霉素,1 mL 0.2%牛磺胆酸钠,1 mL HEPS),37 ℃、5% CO2培养箱中培养,第2 d换液观察有无污染情况,弃掉原培养基,加入新鲜的完全培养基继续培养。每隔3 d换1次液,每天镜下观察虫体状态。
1.4.4 不同发育时期虫体收集 培养第0 d、第1 d、第5 d、第20 d、第30 d、第40 d、第50 d的虫体在显微镜下观察拍照并收集样本,分别保存于4 ℃、4%多聚甲醛中和-80 ℃、RNA later中,用于后续的H&E染色、RNA提取及荧光定量PCR检测。
1.4.5 不同发育时期虫体H&E染色 将保存于4%多聚甲醛中的虫体经蒸馏水冲洗数次后,用稀释10倍的苏木素染液染色过夜,用30%~70%酒精逐级脱水,1%盐酸-酒精褪色10 s,透明15~30 min,中性树胶封片。
1.4.6 引物设计和合成 参照GenBank上已公布的β-Actin(XM_024499161)、EgM9(AF482720)、EG-09888(XM_024499137)mRNA基因序列使用Primer Premier 5.0分别设计引物,送北京鼎国昌盛生物科技有限公司合成。β-Actin的引物序列为F:5′-GGTTACATCCCTCCGACCTTG-3′,R:5′-AA-GCAGCCTCCTCTTGAGTG-3′,Tm=60 ℃,片段大小为243 bp;EgM9的引物序列为F:5′-GTGAATTTTGCCTGCCCGTT-3′,R:5′-GCACA-ACCTCAGTCATGGGT-3′,Tm=65 ℃,片段大小为142 bp;EG-09888的引物序列为F:5′-AATCAGGGTCCCAACGTCAT-3′,R:5′-ATCGCA-ACGTGAAGAACTCG-3,Tm=65 ℃,片段大小为183 bp。
1.4.7 RNA提取、cDNA合成 取虫体10 μL(约2 000条)按RNA提取试剂盒操作步骤提取虫体RNA,并用Mighty Script第一链cDNA合成Master Mix(去基因组DNA)试剂盒逆转录合成cDNA。
1.4.8 荧光定量PCR反应 荧光定量PCR反应体系20 μL:2×SG Fast qPCR Mix 10 μL,上下游引物各0.8 μL(10 μmol/L),cDNA 1 μL,用ddH2O补至20 μL。反应程序:95 ℃ 预变性3 min;95 ℃ 变性3 s,65 ℃ 退火/延伸30 s,共40个循环。每个样本3个重复,程序结束后自动得出熔解曲线。

2 结 果
2.1 细粒棘球绦虫原头蚴向成虫方向体外发育模型的建立 细粒棘球绦虫原头蚴向成虫方向体外发育模型见图1。获得的Eg原头蚴活力近99%,Eg原头蚴呈现两种形态:一种为顶突凹入,一种为顶突外翻(图1A)。培养第1 d时原头蚴活力较好,少部分原头蚴出现外翻(图1B);培养第5 d时原头蚴出现明显伸缩蠕动,有部分原头蚴头节外翻,顶突和4个吸盘完全翻出(图1C);第15~21 d时大量原头蚴开始外翻且体节有增长趋势,颈部以下狭窄和清晰的区域标志着第1节片已形成生殖器官雏形(图1D);在第21 d时,出现了明显的分节现象,产生幼节(图1E);第30~40 d分节现象逐渐明显,幼节长度逐渐增长(图1F-G);第50 d产生成节,此时虫体形态为3个节片(图1H)。
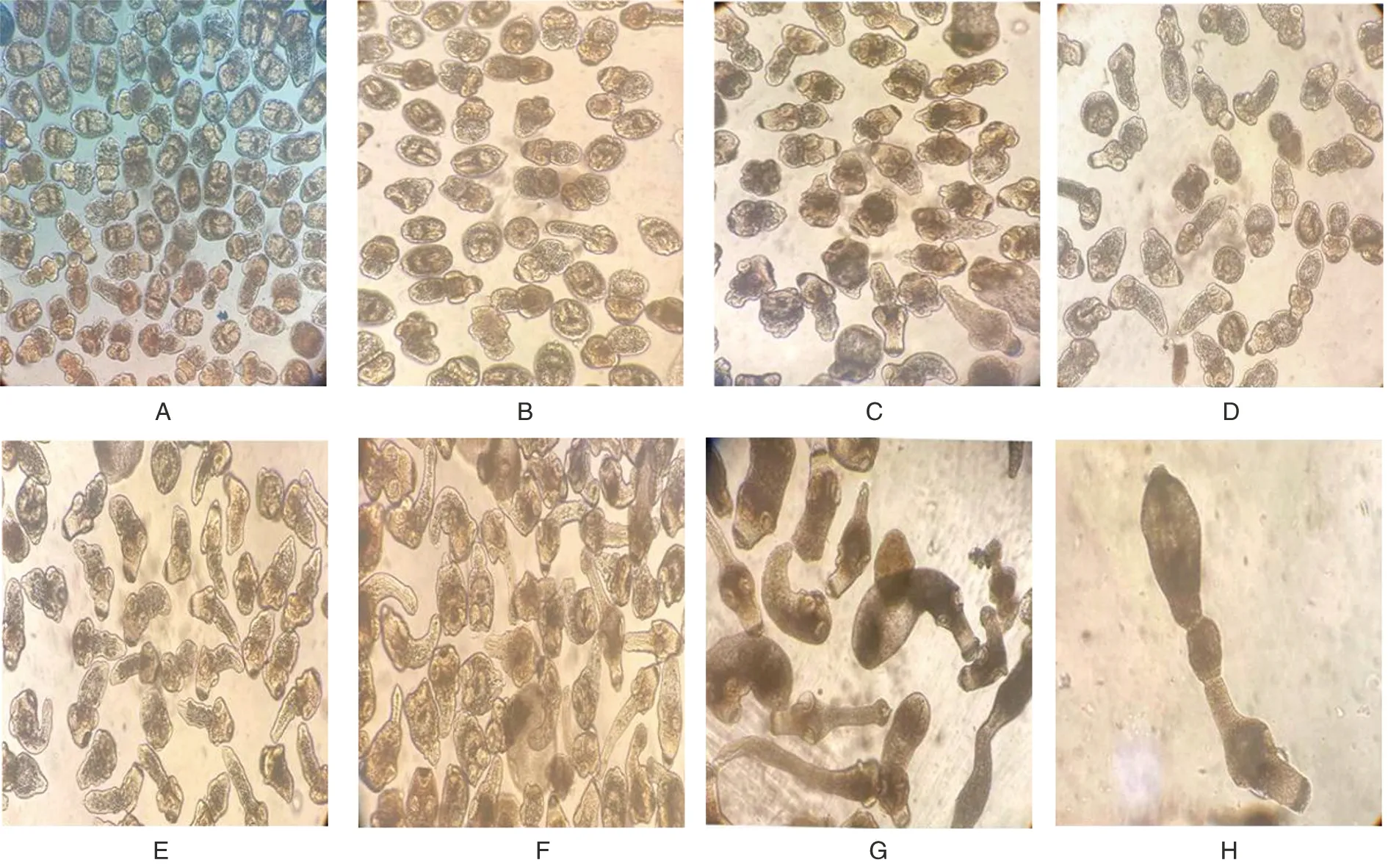
A:PSCs活力鉴定(1%亚甲基蓝染色成活率为99%);B:体外培养第1 d的PSCs;C:体外培养第5 d的PSCs;D:体外培养第10 d的PSCs;E:体外培养第20 d的PSCs;F:体外培养第30 d的PSCs;G:体外培养第40 d的PSCs;H:体外培养第50 d的PSCs。图1 显微镜下体外发育不同时期虫体形态变化(10×)Fig.1 Morphological changes of PSCs in different developmental stages in vitro(10×)
2.2 虫体H&E染色结果 体外培养不同时期的虫体经H&E染色(图2),第0 d原头蚴呈圆形,内部可见内陷的顶突小钩(图2A);体外培养至10 d时,顶突开始外翻,朝链体节方向发育,有少量钙质小体(图2B);第20 d时出现分节现象产生幼节(图2C);第21~40 d时随着时间的推移幼节长度也在增长,链体节的节片由此向后连续长出(图2D-E);在50 d时产生成节(图2F)。
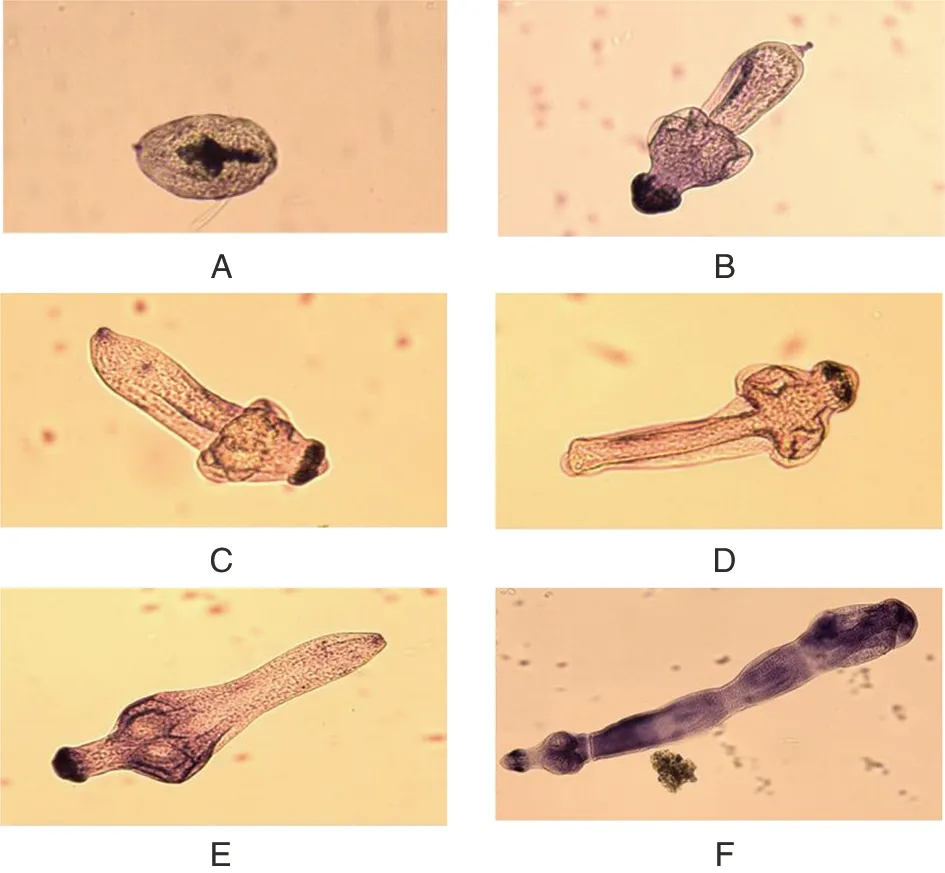
A:体外培养第0 d的PSCs;B:体外培养第10 d的PSCs;C:体外培养第20 d 的PSCs;D:体外培养第30 d的PSCs;E:体外培养第40 d的PSCs;F:体外培养第50 d的PSCs。图2 体外发育不同时期虫体H&E染色(10×)Fig.2 H&E staining of PSCs at different stages of development in vitro(10×)
2.3 引物特异性 内参基因和目的基因的熔解曲线见图3。从熔解曲线可看出,β-Actin、EgM9、EG-09888基因的熔解温度均为65 ℃,基线平稳,呈单峰,无非特异性扩增产物和二聚体,表明引物具有极好的特异性。
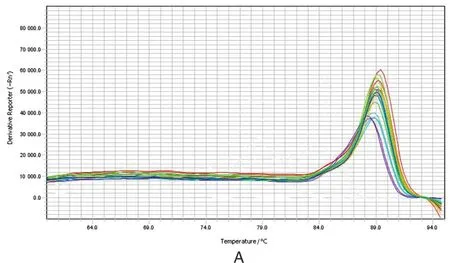

A:β-Actin基因熔解曲线;B:EgM9基因熔解曲线;C:EG-09888基因熔解曲线。图3 内参基因和目的基因的熔解曲线Fig.3 Melting curves of reference and target genes
2.4EgM9基因在细粒棘球绦虫体外发育不同时期的表达分析 从图4中可以看出,EgM9基因随着体外培养天数的增加其表达量也在升高,第20 d表达量与第0 d比较,差异有统计学意义(F=8.31,P<0.05);第20、30、40 d表达量变化不明显,差异无统计学意义(F=0.072,P>0.05);第50 d表达量最高,与之前不同培养天数虫体的表达量差异有统计学意义(F=11.32,P<0.05)。EgM9和EG-09888基因在各时期的表达量差异无统计学意义(P>0.05),见图4。

①:P<0.05;②:P>0.05图4 虫体不同发育阶段EgM9和EG-09888基因的表达情况Fig.4 PSCs expression of the EgM9 gene and EG-09888 gene in different developmental stages
3 讨 论
体外培养寄生虫是在无菌、适当的温度、湿度和必需营养物质条件下体外完成整个生长发育过程并维持其结构和功能,具有可以简化其生长环境、方便添加试验因素、容易观测试验结果的优点。由于体内培养试验存在一定不便,如棘球蚴的生长发育不能清晰直观地观察和研究。因此,对细粒棘球绦虫原头蚴的体外培养,很多学者进行了不同的尝试[15-18]。本试验采用“无干扰、非宿主的”厌氧培养体系,该体系不存在外来生物组织、细胞及细胞因子等,通过加入适量胆酸盐和胰蛋白酶为原头蚴提供最佳培养条件,原头蚴可以在完全没有宿主细胞的情况下保持活性并发育。
在我们的研究中原头蚴体外培养第3~5 d外翻率为70%~80%。培养第17~21 d外翻率为60%~70%,并观察到第1节片的产生;培养第25~30 d和第37~40 d,表现为幼节的增长;培养第50 d,成节出现。但在培养50 d后,虫体不能进一步发育并出现了崩解现象,不再发现其他生殖器官的明显发育。由于寄生虫生活史较复杂,加之对营养要求高,因此体外培养比较困难,终末宿主犬肠道系统的多样化环境,不仅包括肠道内容物,还包括潜在的宿主分泌因子都对其体内成虫发育具有相关作用,但体外培养未能提供其生殖发育相关因子,可能是导致其生殖器官不明显的主要因素。体外培养原头蚴的生长发育与培养体系的稳定性、pH值、温度以及原头蚴的密度等有很大关系[15,19-20]。根据Mohammadzadeh等[21]研究显示体外培养的原头蚴向成虫方向发育总是落后于犬体内的发育,表示体外培养虫体具有一定滞后性,且均未发现生殖器官的全面发育。
张文宝等[9-10]筛选出了成熟虫体的特异性表达基因,即EgM9基因家族,进行免疫实验,结果显示EgM9蛋白免疫效果最好,可以使虫体发育受阻,减卵率达到97.7%,虫体数量明显减少。赵莉等[22]监测重组蛋白EgM9免疫犬的特异性抗体变化,证实EgM9与Iscom佐剂结合能引起犬特异性免疫应答。郭宝平等[23]也对EgM9抗原的免疫保护作用进行了实验,结果证实了EgM9蛋白对犬有很好的免疫保护效果。EgM9基因可能是虫体发育尤其是睾丸发育的关键基因,影响精子的产生。因此,本试验以β-Actin基因为内参,对虫体不同发育阶段EgM9和EG-09888基因的表达情况进行研究,采用荧光定量PCR的相对定量,通过2-ΔΔCt法可以将定量结果校正为以细胞或基因组为单位,从而使不同样品之间具有可比性,可用于比较mRNA的表达情况[24-25]。虽然通过形态学鉴定未观察到培养的虫体体内有明显的雄性器官如睾丸的产生及雌性器官子宫的产生,但通过荧光定量PCR检测EgM9和EG-09888基因在各时期表达量差异无统计学意义。由于EG-09888基因调控细粒棘球绦虫减数分裂中精子的发生,在细粒棘球绦虫成虫阶段高表达,预示虫体有雄性器官发育形成的趋势,也证实EgM9与EG-09888基因在细粒棘球绦虫成虫中共同管控精子的产生和发育。但由于体外培养虫体发育的滞后性,因此未能观察到生殖器官的明显特征。体外培养的虫体第3节片产生时,其EgM9基因表达量就开始增高,可能是由于虫体进行减数分裂,向成虫阶段发育。
综上所述,通过体外培养,可以获得不同发育时期的细粒棘球绦虫,为研究基因表达以及基因干预提供材料,同时明确EgM9基因在成虫发育及虫卵产生中的功能,可为其作为犬用疫苗靶抗原奠定理论基础。
利益冲突:无
引用本文格式:陈云英,王冰洁,潘星羽,等.细粒棘球绦虫体外不同发育时期EgM9基因差异表达研究[J].中国人兽共患病学报,2022,38(9):784-789.DOI:10.3969/j.issn.1002-2694.2022.00.119

