白蛋白-胆红素评分对乙肝肝硬化失代偿期患者短期预后的评估价值
张新丽,卢东方,朱昕赟
(1.周口市中心医院 检验科,河南 周口 466000;2.郑州大学第三附属医院 新生儿疾病筛查中心,河南 郑州 450000)
乙肝肝硬化是消化内科最常见的疾病之一,每年约3%的乙肝患者可进展为乙肝肝硬化失代偿期(hepatitis B virus related decompensated cirrhosis,HBV-DeCi),HBV-DeCi患者常伴随多种并发症(腹水、肝肾综合征、上消化道出血等),预后较差,5 a生存率只有14%~35%[1]。因此准确预测患者短期预后,可指导临床医生采取合理的治疗方法(人工肝、肝移植等),从而降低患者病死率。目前,最常用的判断患者预后的评分系统为肝功能评分(Child-Pugh)和终末期肝病模型(mold for end-stage liver disease,MELD)。但是这两种评分判断和计算较为繁琐,近年来许多研究者试图寻找一种简单、有效的评分系统。白蛋白-胆红素(albumin-bilirubin,ALBI)评分作为一种新的评分方法应运而生,研究发现ALBI与肝癌、肝硬化、原发性胆汁性肝硬化患者的预后相关[2-6]。本研究旨在探讨ABLI对HBV-DeCi患者90 d内病死的预测价值。
1 资料与方法
1.1 研究对象回顾性分析2020年7月至2021年10月周口市中心医院收治的174例HBV-DeCi患者资料。入选标准:年龄>18岁;诊断为HBV相关性肝硬化[7];出现肝硬化失代偿期的临床表现,如腹水、肝性脑病、上消化道出血;入院前未接受肝移植、抗病毒治疗。排除标准:其他病毒性肝炎;非病毒性慢性肝病,如酒精性肝病、自身免疫性肝病、药物性肝病等;肿瘤及血液疾病;哺乳期及妊娠妇女。根据患者住院期间及出院后90 d的临床转归划分为生存组和病死组。
1.2 临床资料收集入选患者临床资料(包括年龄、性别、体格检查和并发症等)和入院首次的实验室检查结果,综合信息进行Child-Pugh、MELD、ALBI评分的计算[4-5]。Child-Pugh评分涉及肝性脑病、腹水、总胆红素(total bilirubin,T-Bil)、凝血酶原时间(prothrombin time,PT)和白蛋白(albumin,ALB),每项根据严重程度计1~3分,分级标准:Child-Pugh A级,5~6分;Child-Pugh B级,7~9分;Child-Pugh C级10~15分。MELD、ALBI评分的计算公式如下:
SMELD=3.78lnρ1+11.2lnR+9.57lnρ2+6.4,
SALBI=0.66log10ρ1-0.085ρ3。
SMELD为MELD评分,ρ1为T-Bil(mg·dL-1),R为国际标准化比值(international normalized ratio,INR),ρ2为血清肌酐(serum creatinine,SCr)(mg·dL-1),SALBI为ALBI评分,ρ3为ALB(g·L-1),MELD评分结果取整数。分级标准:Ⅰ级为ABLI≤-2.60;Ⅱ级为-2.6
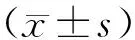
2 结果
2.1 临床资料共纳入174例HBV-DeCi患者,其中男129例,女45例,年龄(54.34±10.18)岁。Child-Pugh A级47例,B级84例,C级43例;ABLI Ⅰ级12例,Ⅱ级91例,Ⅲ级71例。患者最常见并发症为腹水和消化道出血,所占比率分别为73.56%和32.18%。以3个月为观察终点,患者病死52例,存活122例。
2.2 危险因素分析单因素分析发现,生存组和病死组患者在消化道出血、自发性腹膜炎、T-Bil、凝血酶原时间(prothrombin time,PT)、INR、白细胞计数(white blood cell count,WBC)、血小板(platelets,PLT)计数、Child-Pugh评分、ALBI评分、MELD评分上的差异均有统计学意义(P<0.05)(表1)。因T-Bil、PT、INR参与3种评分的计算,在进行logistic多因素回归时给予剔除。分类变量参与回归时,患者发生消化道出血和自发性腹膜炎时赋值1,未发生赋值0。结果显示,Child-Pugh评分(OR=1.840,P<0.001)、ALBI评分(OR=3.867,P=0.023)、MELD评分(OR=1.108,P=0.007)、消化道出血(OR=10.586,P<0.001)均为患者死亡的独立危险因素(表2)。

表1 两组患者的单因素分析

表1(续)

表2 90 d内患者病死的多因素分析
2.3 ALBI 、Child-Pugh和MELD评分评估患者短期预后的诊断价值绘制ROC曲线,计算ALBI、Child-Pugh、MELD评分的AUC为0.778、0.827和0.848,提示预测性较好。使用MedCalc软件进行3种评分的两两比较,结果显示ALBI与Child-Pugh或MELD的AUC差异均无统计学意义(P>0.05),见表3和图1。

表3 3种评分的AUC差异比较

图1 3种评分模型对HBV-DeCi患者短期预后诊断价值的ROC曲线
3 讨论
HBV-DeCi患者并发症较多,临床以腹水、上消化道出血、肝性脑病多见,往往危及患者生命,需及时接受有效的治疗措施。通过分析174例患者的临床资料发现,HBV-DeCi病死组患者消化道出血和自发性腹膜炎的发生率高于生存组,这与并发症发病的凶险性相关。消化道出血可导致失血性休克,自发性腹膜炎使患者产生应激反应,直接威胁患者生命,所以在临床上需及时应对这两种并发症。病死组患者的T-Bil、PT、INR高于生存组,WBC和PLT低于生存组,这说明病死组患者肝功能较差,胆红素代谢能力及凝血因子产生能力下降较为严重,从而患者表现为黄疸和凝血功能障碍;肝硬化失代偿期患者常伴有脾大这一临床症状,白细胞和血小板在血液循环中流经脾时被扣押,所以患者外周血细胞减少,在病死组患者中更为明显。
国内外常用于评估肝病患者预后的模型为Child-Pugh评分和MELD评分,前者涉及肝性脑病、腹水、T-Bil、PT和白蛋白,后者涉及T-Bil、SCr、INR,这两种评分常与患者预后不良密切相关。但是这两种评分系统不易把握,Child-Pugh评分包含肝性脑病和腹水这2项主观性指标,MELD评分中SCr易受肝外因素干扰。此外,这两种评分系统在肝硬化相关疾病(肝肾综合征、腹水、自发性腹膜炎、出血等)中的诊断准确性有限,所以急需一个稳定且简单的指标。ALBI 是一种新的、简单的评分,计算较为简单,只涉及T-Bil和ALB,实验室检测方法较为成熟,并且T-Bil和ALB能更好地反映肝代谢和合成功能,无需使用诸如腹水和脑病等主观决定因素。有研究发现,ALBI评分比Child-Pugh评分更能反映肝储备功能[8-9],可预测肝癌术后肝衰竭、乙肝肝硬化、HBV相关性慢加急性肝衰竭和经射频消融、经动脉化疗栓塞患者的预后情况[3,10-13]。本研究发现,HBV-DeC病死组患者的ALBI评分、Child-Pugh评分和MELD评分均高于生存组,并通过多因素logistic回归分析得出3种评分均是影响HBV-DeCi患者90 d病死率的独立危险因素。
ALBI 评分最初是基于肝癌患者而提出,可用来指导肝癌患者选择治疗方式并预测其预后。例如,ALBI级别越低,发生放射并发症的概率越低,同时,它可以预测放射治疗后肝癌患者的总体生存期[14]。近年来,一些研究发现,ALBI是肝硬化尤其是HBV相关性肝硬化患者生存预后的独立危险因素[4,10,13],在预测肝硬化患者疾病严重程度上的价值高于Child-Pugh评分和MELD评分,但也有研究认为3种评分在预测乙肝肝硬化患者短期预后上并无明显差异[15-16]。为评估ALBI对患者预后是否有诊断价值,采用ROC曲线计算其AUC,并与Child-Pugh评分和MELD评分作比较。结果显示,ALBI、Child-Pugh、MELD评分的AUC分别为0.778、0.827、0.848,并且进行两两比较时发现三者之间的差异无统计学意义,这说明ALBI对HBV-DeCi患者短期病死率的预测能力与Child-Pugh和MELD评分相当,与Qi[5]的研究一致。所以ALBI评分可用来评估患者短期预后情况,ALBI评分高与患者预后不良有关,若及时给予临床干预,可改善患者预后。
本研究存在一些不足之处。首先,回顾性研究设计可能导致患者选择偏倚。其次,这是一项单中心研究,研究对象仅限于本院,样本量相对较小。因此,研究结果需要在大型、多中心、前瞻性的研究中得到验证。最后,本研究未对ALBI分值进行动态监测,且仍未能确定其在患者长期预后上是否存在价值,有待于后续长期随访加以证实。
综上所述,ALBI评分作为一种新的肝功能评分模型,在预测HBV-DeCi患者短期预后中具有临床应用价值,可与Child-Pugh、MELD评分同时推广使用。

