肝内胆管癌的危险因素与发病机制
梁 煜, 赵远红, 李 正
1 天津中医药大学第一附属医院 肿瘤科,国家中医针灸临床医学研究中心, 天津 300381;2 天津中医药大学第一附属医院 制剂室, 天津 300381
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)是指胆道上皮分化的肝内恶性肿瘤,可起源于肝内胆道的任何部位,包括从段和区胆管及其主要分支到最小的胆管及胆小管。ICC发病率在世界范围内呈上升趋势,其中东南亚发病率最高,我国的发病率仅次于泰国居亚洲第2位[1]。由于ICC患者早期一般无症状,加之缺乏敏感的筛查及诊断标志物,大部分病例发现时已为中晚期,错过了最佳手术时机,其5年存活率仅为20%[2]。本团队在既往对隐源性肝癌的统计研究[3]中发现,ICC占比颇高,追溯其发病因素发现ICC具有更多不明确的发病因素,这很有可能造成危险因素的持续积蓄和临床诊断的延迟,因此,本文综述ICC的危险因素及发病机制的研究进展,以期为临床早期及时的防治提供线索。
1 危险因素
1.1 原发性硬化性胆管炎(PSC) PSC是一种严重的慢性胆汁淤积性肝病,以肝内外胆管的弥漫性炎症损伤并伴有纤维化为主要特征,是目前公认的ICC发生发展的危险因素。据报道[4],PSC患者罹患胆管癌的风险较一般人群增加了近400倍。研究发现,PSC发展为胆管癌的进程在不同亚型之间差异显著。例如,相较于大导管PSC,小导管亚型通常很少发展为胆管癌[5]。PSC的持续时间并不是胆管癌的危险因素,约半数患者在确诊PSC 1年内即会被确诊为胆管癌[6]。由于其高风险性,部分指南推荐对PSC患者进行长期的监测管理,以改善患者生存预后。
1.2 病毒性肝炎 最近的流行病学数据[7]显示,肝炎病毒感染与ICC之间具有很强的关联性。但HBV和HCV感染致病存在地域差异,西方国家主要受HCV的影响,亚洲则以HBV感染为主。Fragkou等[8]分析了来自不同国家和地区的20项病例对照研究,其中14项研究结果显示HBV感染与ICC风险之间具有相关性,而其余6项均是于2002年以前在不同地区完成的,提示ICC发病率的地理差异可能与环境和遗传因素有关,这也可能影响了研究中ICC与HBV感染之间病因学关系的确定。日本的一项队列研究[9]结果显示,与HBsAg和HCV抗体阴性个体相比,HBsAg阳性者患ICC的风险明显增高,证实HBV感染可能是ICC的独立危险因素。Wang等[10]检测了40例ICC组织中的HBV基因及其相关抗原,结果HBV DNA的检出率为82.5%,而仅有4例出现肝硬化,表明HBV可能是通过局部组织持续性炎性损伤而诱导ICC发生发展,而不是通过肝硬化。Lei等[11]回顾性分析900余例接受肝脏切除手术的ICC患者,发现术后HBV再激活是患者术后并发症增多、存活率下降的重要因素,而手术前后抗病毒治疗均可降低病毒再激活风险,有效延长生存期。
隐匿性HBV感染(occult hepatitis B virus infection,OBI)是HBV感染的一种特殊形式,指在HBsAg阴性个体的血清和肝组织中检测到HBV DNA,是ICC的新兴危险因素。在OBI患者中,HBV仍保留着生物学特性。多项研究表明OBI在ICC患者中有着高流行率,很可能发挥病因作用[12],HBsAg血清学检测呈阴性并不代表HBV感染的治愈,也不能完全阻止ICC进程[13]。
1.3 肝内胆管结石 肝内胆管结石在我国发病率逐年上升,且呈年轻化趋势。在肝内胆管结石高发地区,ICC发病率也随之增高。高达94%的肝内胆管结石患者会发生胆道系统感染,因此对于肝内胆管结石导致ICC的发病途径,一般认为是由于结石堵塞胆道[14],造成胆汁停滞,局部胆汁石胆酸增多,加上结石对胆管壁的长期刺激,形成胆道细菌感染及慢性炎症损伤,继而引起胆管黏膜上皮的不典型增生,导致ICC的发生[15]。对比不同级别的胆管癌和胆管结石伴黏膜上皮不典型增生的细胞DNA载量,发现随着胆管上皮分化程度降低,DNA载量升高,而结石伴不典型增生的胆管细胞DNA和高分化腺癌细胞DNA载量无显著差别,提示肝内胆管结石所导致的胆管黏膜上皮细胞不典型增生与ICC关系密切,很可能是ICC的癌前病变。牛腾腾等[16]追踪随访发现150例肝内胆管结石患者中26%进展为ICC,ICC组结石病程≥10年者占比显著高于非ICC组,而结石彻底清除者ICC占比显著降低,提示肝内胆管结石病程与ICC发生呈正相关,结石清除可预防延缓疾病进程。一项多中心研究[17]分析了我国12家医疗机构的1321例ICC患者,结果显示原发于右半肝的ICC与肝炎相关,而原发于左半肝的ICC与结石关系更为密切,提示ICC的原发部位不同,其致病因素可能也存在差异。
1.4 寄生虫感染 目前已有大量流行病学数据支持肝吸虫病在ICC发生发展中起到了重要作用,尤其是主要流行于东南亚地区的华支睾吸虫和后睾吸虫,使得患病风险增加2~5倍。在泰国,后睾吸虫感染是ICC的主要危险因素[18],可使胆管癌患病风险增加4.54倍。Shin等[19]荟萃分析发现肝吸虫感染存在着显著的地域差异,其发展为胆管癌的相对风险为4.8(95%CI:2.8~8.4),两者之间存在强烈的相关性。这些寄生虫的致癌方式尚不明确,一般怀疑与寄生虫虫体的活动和代谢产物导致的胆管慢性炎症有关。可以肯定的是,实施更严密的寄生虫感染预防和治疗计划会降低流行地区ICC的发病率。
1.5 其他 非酒精性脂肪肝、糖尿病、肥胖症等代谢性疾患与慢性肝病和肝硬化的发生密切相关[20],是ICC发生发展的重要危险因素。二氧化钍、石棉和氡等化学性致癌物质的暴露可使ICC的患病风险增加数百倍[21]。此外,吸烟、嗜酒、遗传易感性等因素也与ICC的发生密切相关。而控烟控酒、使用他汀类药物、降糖药物等可降低ICC发病风险[22],提示饮食生活习惯的改善和基础代谢疾病的控制对于预防ICC发生发展有积极作用。
2 发病机制
随着分子生物学技术的迅速更新,ICC的发生发展机制研究逐渐转向微观层面,目前已经发现表皮生长因子受体(epithelial growth factor receptor,ErbB)家族受体酪氨酸激酶、内质网氧化还原酶1α(endoplasmic reticulum oxidoreduclin 1α,ERO1A)等多种代谢分子可能影响肿瘤相关基因表达,改变肿瘤微环境;多种微型RNA在肿瘤细胞增殖、浸润与转移中发挥着关键驱动作用(图1)。
2.1 细胞分子水平研究 ErbB家族受体酪氨酸激酶的异常表达和信号传导被证实与ICC的发生发展有关。免疫组化分析结果[23]显示ICC患者癌性上皮中ErbB2过度表达,且在与ICC发生相关的非癌性胆道系统疾病(包括肝内胆管结石和PSC)中也存在ErbB2癌蛋白的表达增加。Su等[24]还测定了ICC患者胆汁中ErbB2癌蛋白的表达情况,发现其平均水平高于从胆道感染、胆道结石患者或正常对照组采集的胆汁。这表明ErbB2过表达可能代表与ICC发生相关的相对早期事件,且胆汁中ErbB2升高可能在识别ICC高风险个体方面有一定作用。
ERO1A在胃癌、结肠癌等多种癌种中高度表达,与肿瘤细胞的增殖和迁移有关。Yan等[25]纳入186例胆管癌组织(包括124例ICC、62例肝外胆管癌)和36例相邻正常组织,研究结果示ERO1A在肿瘤组织中高表达,ERO1A耗竭可抑制ICC细胞的增殖迁移能力,ERO1A表达沉默后p-Akt、p-4EBP1和p-S6的水平降低,提示ERO1A可能通过调节Akt/mTOR信号通路影响胆管癌的增殖与侵袭。
丙酮酸激酶M2、胸苷磷酸化酶和二氢嘧啶脱氢酶、异柠檬酸脱氢酶1/2等代谢相关酶类也可影响肿瘤的相关基因表达及合成代谢过程[26],且表达水平的高低可影响5-氟尿嘧啶类化疗药物的临床应答,影响ICC患者预后。
2.2 基因水平研究 近年的基因和转录组学研究揭示了PTEN、TP53、KRAS、CXCL12等基因突变驱动ICC发生发展的机制。Wang等[27]对我国122例ICC患者的基因型进行下一代测序,结果最常见的突变基因是TP53、KRAS和ARID1A,且相较于单纯化疗,存在基因突变的患者接受化疗联合靶向治疗的预后更佳;存在微卫星不稳定性特征的患者都可从免疫治疗中获益,提示基于下一代测序的个性化治疗具有潜在的临床意义。Miyata等[28]通过cDNA微阵列分析和免疫组织化学检测分析ICC肝转移相关基因,发现CXCL12是唯一在肝转移中表达显著高于原发性ICC的基因,与患者预后明显相关。LAMC2是一种重要的上皮间质转化相关基因[29],在ICC细胞中的表达水平较HCC细胞更高,主要存在于ICC细胞的培养上清液中,可影响肿瘤微环境,导致癌细胞的入侵和迁移。
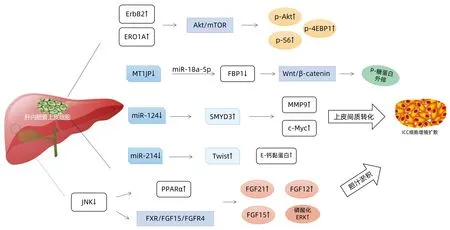
图1 ICC相关发病机制
microRNA(miRNA)是一类高度保守的小型非编码内源RNA,通过与靶基因mRNA的互补碱基配对和随后的基因沉默对基因表达产生负面影响,诱导mRNA的降解及相应蛋白合成的抑制[30]。研究[31]表明ICC细胞系和组织中存在miRNA的表达失控,这些miRNA在ICC细胞增殖与凋亡、浸润与转移中起着重要作用。
Chen等[32]首次报道了人类ICC的miRNA表达谱,其对比27个ICC组织、10个正常胆管细胞和8个正常肝脏组织样本,结果显示与正常样本相比,ICC组织中分别有18个显著上调和20个显著下调的 miRNA。Hu等[33]发现与正常相邻组织相比,miR-31在ICC组织中表达显著上升,并直接反向作用于RASA1以抑制肿瘤细胞凋亡。Wang等[34]发现ICC患者血清中的miR-21水平显著升高,抑制miR-21表达可诱导细胞周期停滞和细胞凋亡,抑制肿瘤生长,进一步研究显示PTPN14和PTEN基因是miR-21的直接作用靶点,且miR-21的高表达水平与ICC患者的不良临床特征和生存率降低密切相关。Li等[35]发现miR-214表达下调可导致上皮间质转化相关基因Twist的转录水平增高,并降低E-钙黏蛋白水平,导致肿瘤细胞扩散转移。miR-200c表达下调亦可导致ICC的迁移与侵袭,其能直接靶向作用于细胞黏附分子NCAM1诱导上皮间质转化发生[36]。miR-124在HCV相关ICC中表达受到抑制,miR-124的低水平表达可通过靶向SMYD3促进肿瘤细胞迁移和侵袭[37]。
2.3 相关信号通路研究 c-Jun氨基末端激酶(JNK)信号转导通路已被确定为肥胖诱导的胰岛素抵抗和肝脂肪变性所必需的信号转导途径。研究[38]发现肝脏中JNK缺乏可导致肝细胞中过氧化物酶体增殖物激活受体α(PPARα)的激活,通过由PPARα靶基因编码的FGF21改变胆固醇代谢和胆汁酸合成、结合和运输,导致胆汁淤积、胆管细胞增殖加剧,增加ICC患病风险。Manieri等[39]进一步研究发现,这种胆管细胞增殖过程还与FXR/FGF15/FGFR4/ERK通路相关,JNK抑制导致胆汁酸新陈代谢改变,进而通过该通路激活ERK,使得磷酸化ERK增加,并触发FGF15/FGF19的分泌,加重机体代谢紊乱,导致胆管细胞的增殖和ICC的发生发展。
Wnt/β-catenin信号通路的激活可导致胆管癌增殖,并通过激活癌细胞上P-糖蛋白外排泵的表达诱导多重耐药。Zhao等[40]实验研究发现ICC组织中长链非编码RNA MT1JP和果糖-1,6-双磷酶1(FBP1)表达下调,miR-18a-5p表达上调,且MT1JP和FBP1序列中均有与miR-18a-5p的结合位点,进一步实验证实MT1JP与miR-18a-5p结合后促进了FBP1的表达,通过抑制Wnt/β-catenin信号通路阻滞肿瘤细胞的增殖和转移,发挥保护作用。
此外,细胞周期蛋白D-CDK4/6-Rb通路、hedgehog通路、JAK-STAT通路、miR-200a/ZEB1通路等信号通路和生物学过程[41-43]均可能参与ICC的生长增殖与扩散转移。
3 小结
ICC具有病因复杂、起病隐匿、高侵袭性、预后差的特点,是一种恶性程度很高的肿瘤。研究发现,与ICC密切相关的危险因素存在着共同的病理特征:即形成胆汁淤积和胆道慢性炎症,使得局部胆管受到持续性的炎性损伤,促进胆管上皮细胞增殖,进而导致ICC发生发展。然而目前仅有少部分ICC的病因可得到解释,绝大部分ICC患者尚未发现明确的危险因素,因此本团队今后将继续深入研究ICC的发生发展危险因素,以协助临床早期诊治,降低其发病率。
随着分子生物学和遗传组学的发展,近年来对ICC的研究逐渐由常规的宏观检测转向癌变过程中相关分子机制的探讨。目前已经发现了多种基因及信号通路在ICC发生发展中发挥重要作用,为ICC的精准治疗提供了方向,将有效改进ICC的治疗手段,改善患者不良预后。因此,对ICC发病机制及治疗方案的深入研究探讨仍会是未来研究的热点之一,其成果的临床转化将对ICC的诊治产生重大现实意义。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:梁煜、赵远红负责研究资料的获取分析解释过程,并起草和修改文章内容,两者贡献等同。李正对研究的思路或设计有关键贡献。

