中药靛玉红衍生物E804对肺癌A549细胞增殖、凋亡和分化的影响及其作用机制
袁育珺,杨秀玲,胡志坚,张素梅
(1.九江学院附属医院检验科,江西 九江 332000;2.九江学院附属医院院感科,江西 九江 332000;3.安徽省/省部共建教育部重要遗传病基因资源利用重点实验室,安徽 合肥 230032)
肺癌位于全球癌症死亡排名中的首位[1]。我国作为世界上最大的发展中国家,随着人口老龄化、工业化和城市化进程加快,肺癌在我国也是威胁人群健康最主要的恶性肿瘤[2]。非小细胞肺癌(nonsmall cell lung cancer,NSCLC)在临床肺癌诊疗中约占80%~85%[3]。外科手术、化疗、放疗、靶向治疗和免疫治疗是目前主要的治疗手段,在临床上广泛应用,也取得了良好的疗效,但NSCLC患者5年生存率仍为10%~15%[4]。此外,耐药的快速进展影响NSCLC患者化疗和靶向治疗的有效性,亦影响NSCLC患者的生存率。因此,发现新的药物和靶点有助于开发新的NSCLC治疗方案。中药是药用化合物的天然宝库,同时也是发现新型活性化合物的重要途径。靛玉红是大青叶和板蓝根等中药的有效成分,具有抗菌消炎、抗增殖、抗肿瘤和抗肥胖等生物学效应[5-7]。中药靛玉红衍生物[靛玉红-3′-(2,3二羟丙基)-肟(E804),简称E804]作为中药靛玉红的有效成分,已被证实具有抗炎和抗信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路等作 用[8],然而E804对NSCLC A549细胞的抑制作用尚未完全阐明。本研究采用E804处理A549细胞,探讨其促细胞凋亡作用,并阐明其可能的分子机制,为E804抗NSCLC的临床应用提供依据。
1 材料与方法
1.1 细胞、主要试剂和仪器NSCLC A549细胞由中国科技大学生命科学院友情提供,九江学院附属医院检验科保存。DMEM、青霉素、链霉素、小牛血清和胰酶均购自北京索莱宝科技有限公司;E804购自武汉远成生物科技有限公司,分装后于-20℃冰箱保存;流式细胞术试剂盒购自合肥碧云天生物试剂公司;B细胞淋巴瘤2(B-cell lymphoma 2,Bcl-2)、Bcl-2相 关X蛋 白(Bcl-2related X protein,Bax)、裂解的含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved cysteinyl aspartate specific proteinase-3,cleaved caspase-3)、裂解的含半胱氨酸的天冬氨酸蛋白水解酶9(cleaved cysteinyl aspartate specific proteinase-9,cleaved caspase-9)和β-actin及Janus激酶1(Janus kinase 1,JAK1)/STAT3通路相关蛋白[JAK1、磷酸化JAK1(phosphorylated JAK1,p-JAK1)、STAT3和 磷 酸 化STAT3(phosphorylated STAT3,p-STAT3)]均购自美国Santa Cruz公司,分装后于-70℃冰箱保存;MTT试剂盒购自美国Sigma公司;二抗(抗鼠和抗兔)均购自美国Pierce公司。倒置显微镜购自日本Nikon公司,电泳槽、电泳仪和蛋白凝胶成像仪购自美国Bio-Rad公司。
1.2 细胞培养液氮中取出A549细胞,37℃水浴迅速解冻,接种于含10%小牛血清、100 U·mL-1青霉素和100 mg·L-1链霉素DMEM培养基中,于37℃、5%CO2饱和湿度培养箱中培养。次日换液1次,待细胞平铺约80%,胰酶消化传代。继续传代培养,待细胞形态稳定,-20℃冰箱冻存备用。
1.3 MTT法检测各组细胞增殖率取对数期生长A549细胞,胰酶消化备用。细胞分为对照组(0 μmol·L-1E804)和 经2.5、5.0、10.0、20.0及50.0 μmol·L-1E804处 理 的E804组,分 别 处 理72 h;细 胞 分 为2.5、5.0和10.0 μmol·L-1E804组,细胞分别处理24、48和72 h。MTT实验严格按照参考文献[9]方法进行,于570 nm波长处检测吸光度(A)值,计算细胞增殖率。细胞增殖率=(对照孔A值-实验孔A值)/对照孔A值×100%。实验重复3次。
1.4 细胞划痕实验检测各组细胞迁移能力取对数生长期A549细胞,超净工作台内制备细胞悬液,细胞计数板计数,稀释为6 000 mL-1密度接种于6孔细胞培养板中。次日换液继续培养。倒置显微镜下观察细胞覆盖和生长情况,当细胞覆盖率约达80%时,弃上清,PBS缓冲液洗涤2次,高压灭菌划痕笔轻轻于各孔 正 中 央 划“十”字,PBS缓冲液洗涤3次。各组细胞于处理0 h做好标记并拍照,处理72 h后拍照,观察细胞迁移距离。实验重复3次。
1.5 软琼脂克隆实验观察各组细胞克隆形成情况取对数生长期A549细胞,超净工作台内胰酶消化,制成细胞悬液,细胞计数板计数,以6 000 mL-1密度接种于6孔细胞培养板中。处理72 h后电子显微镜下观察各组A549细胞形态表现及分化情况并拍照。各组细胞经E804处理72 h后,弃上清,超净工作台内制备细胞悬液,细胞计数板计数,以7 000 mL-1密度接种于预先铺好0.6%软琼脂6孔细胞培养板中。将培养板置于湿盒(防干燥),存放于细胞室CO2培养箱中保存2周,倒置显微镜下观察各组细胞克隆形成情况。弃上清,甲醇固定,MTT染液染色,电子显微镜下观察克隆形成数和形态表现。
1.6 流式细胞术检测各组细胞凋亡率取对数生长期A549细胞,超净工作台内制备细胞悬液,细胞计数板计数,以6 000 mL-1密度接种于6孔细胞培养板中。次日换液,E804处理72 h,制备细胞悬液计数为1×106mL-1。AnnexinⅤ-FITC和PI双染按说明书操作,采用流式细胞仪检测各组细胞凋亡率。细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.7 Western blotting检测各组细胞中目的蛋白表达水平按参考文献[9]方法提取各组细胞总蛋白,BCA测定各组细胞蛋白浓度,加热变性后,取约25 μg相应蛋白样品于10%SDS-PAGE凝胶进行电泳,将相应的蛋白转移至PVDF膜上,5%脱脂奶粉室温下封闭1 h,加入Bcl-2(1∶800)、Bax(1∶1 100)、cleaved caspase-3(1∶1 500)、cleaved caspase-9(1∶1 000)、β-actin(1∶2 000)、JAK1(1∶800)、p-JAK1(1∶1 500)、STAT3(1∶1 000)和p-STAT3(1∶1 200),置于4℃过夜;次日加入相应二抗(1∶1 500)室温下孵育2 h,PBS缓冲液洗膜3次,暗室内ECL显影并拍照,实验重复3次。采用Image Pro 4.5软件分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.8 统计学分析采用GraphPad Prism 8统计软件进行统计学分析。各组细胞增殖率、迁移距离、克隆形成数、细胞凋亡率、凋亡相关蛋白和JAK1/STAT3信号通路相关蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组细胞增殖率E804作用72 h后MTT检测 结 果 显 示:与 对 照 组 比 较,2.5、5.0和10.0 μmol·L-1E804组 细 胞 增 殖 率 降 低(P<0.01);与10.0 μmol·L-1E804组 比 较,20.0和50.0 μmol·L-1E804组细胞增殖率差异无统计学意义(P>0.05)。E804作用24、48和72 h后,与E804作 用0 h比 较,2.5、5.0和10.0 μmol·L-1E804组细胞增殖率均随着时间延长逐渐降低(P<0.05或P<0.01)。见图1。

图1 MTT法检测各组细胞增殖率Fig.1 Proliferation rates of A549 cells in various groups detected by MTT assay
2.2 各组细胞迁移距离细胞划痕实验结果显示:与对照组比较,2.5、5.0和10.0 μmol·L-1E804组A549细胞迁移距离缩小(P<0.05或P<0.01)。见图2和3。

图2 细胞划痕实验检测各组细胞迁移能力Fig.2 Migration abilities of cells in various groups detected by cell scratch assay
2.3 各组细胞克隆形成情况倒置显微镜和电子显微镜下观察各组细胞克隆形成情况显示:对照组A549细胞抱团紧密、形态稳定,且生长迅速。与对 照 组 比 较,2.5、5.0和10.0 μmol·L-1E804组细胞抱团不明显,胞体形态多变,呈现分散和迟缓生长的现象,且克隆形成数减少(P<0.05)。见图4~6。

图4 倒置显微镜下观察各组细胞克隆形成情况Fig.4 Clone formation of cells in various groups observed under inverted microscope
2.4 各组细胞凋亡率流式细胞术检测结果显示:与对照组比较,2.5、5.0和10.0 μmol·L-1E804组细胞凋亡率升高(P<0.05或P<0.01)。见图7和8。

图7 流式细胞术检测各组细胞凋亡率Fig.7 Apoptotic rates of cells in various groups detected by flow cytometry
2.5 各组细胞中凋亡相关蛋白表达水平Western blotting检测结果显示:与对照组比较,2.5、5.0和10.0 μmol·L-1E804组细胞中Bcl-2蛋白 表 达 水 平 降 低(P<0.05或P<0.01),Bax、cleaved caspase-3和cleaved caspase-9蛋白表达水平升高(P<0.05或P<0.01)。见图9。
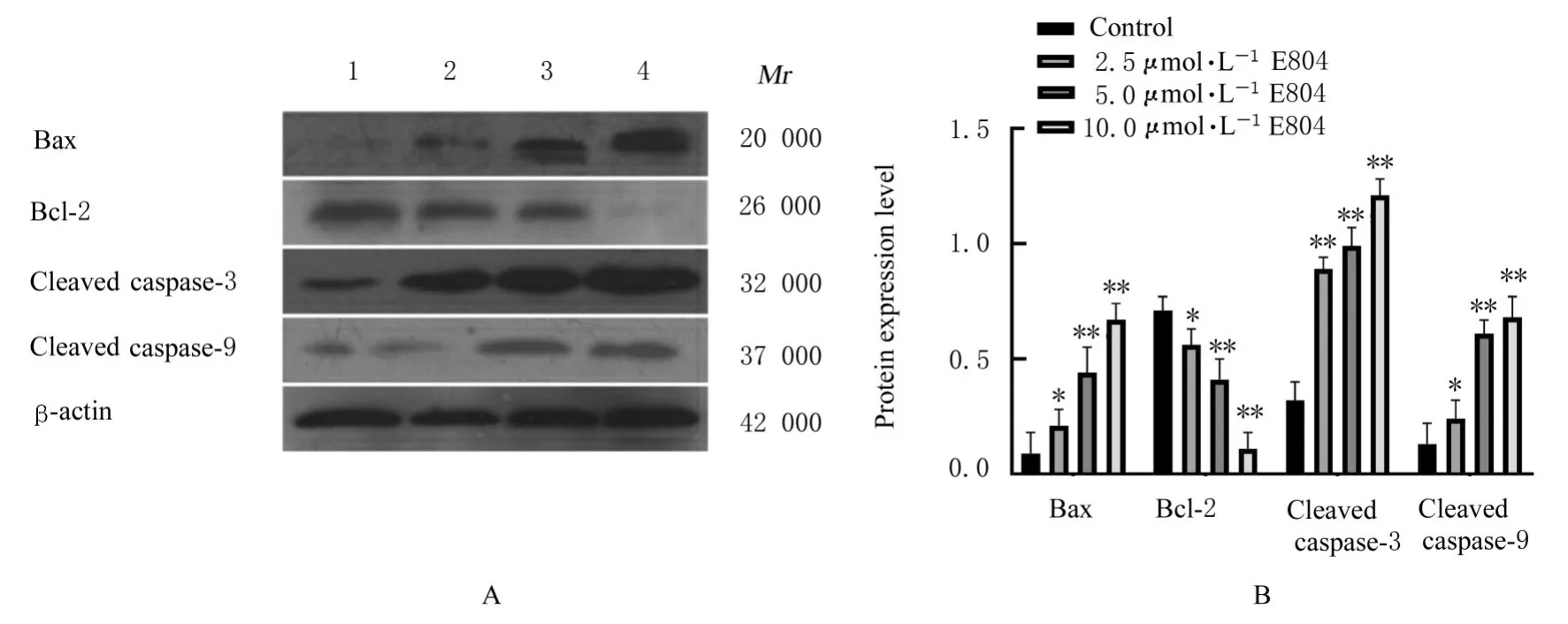
图9 各组细胞中凋亡相关蛋白表达电泳图(A)和直条图(B)Fig.9 Electrophoregram(A)and histogram(B)of expressions of apoptosis-related proteins in various groups
2.6 各组细胞中JAK1/STAT3信号通路相关蛋白表达水平Western blotting检测结果显示:与对照组 比 较,2.5、5.0和10.0 μ mol·L-1E804组p-JAK1和p-STAT3蛋白表达水平降低(P<0.05或P<0.01),而JAK1和STAT3蛋白表达水平差异无统计学意义(P>0.05)。见图10。

图3 各组细胞迁移距离Fig.3 Migration distance of cells in various groups
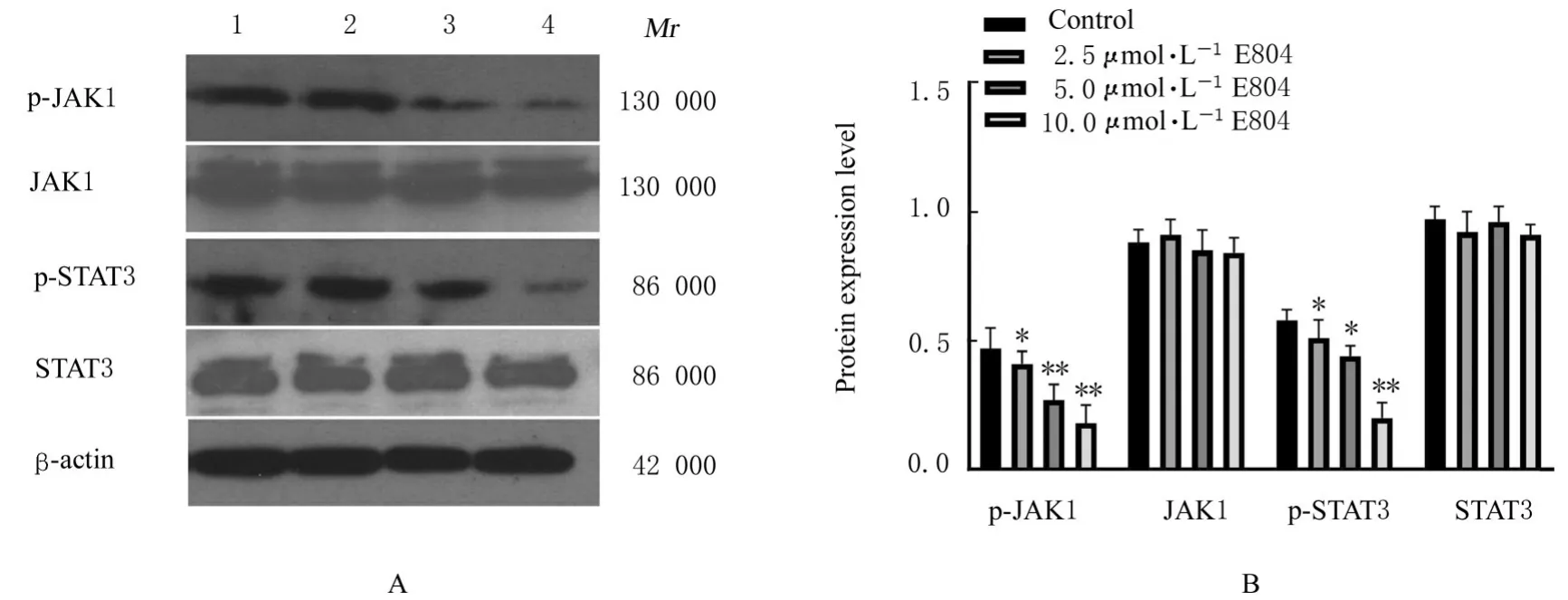
图10 各组细胞中JAK1/STAT3信号通路相关蛋白表达电泳图(A)和直条图(B)Fig.10 Electrophoregram(A)and histogram(B)of expressions of JAK1/STAT3 signaling pathway-associated proteins in various groups
3 讨 论
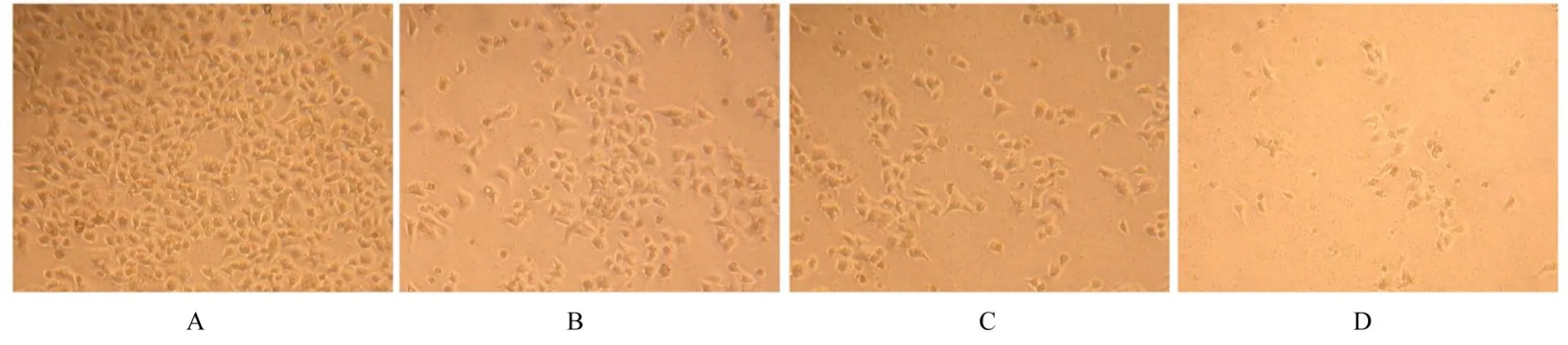
图5 电子显微镜下观察各组细胞克隆形态表现(MTT,×400)Fig.5 Morphology of clones of cells in various groups observed under electron microscope(MTT,×400)
恶性肿瘤对人类健康和生命构成巨大威胁,是世界上造成死亡的主要原因之一。肺癌是常见的恶性肿瘤,晚期肺癌的5年生存率约为15%[1]。近年来,随着分子生物学和临床治疗方案的不断融合和创新,研究和发现新的分子靶向药物已成为临床治疗的热点,靶向治疗已用于多种肿瘤的一线治疗[10-11]。JAK1/STAT3信 号 通 路 作 为 连 接 炎 症 和肿瘤的关键信号通路,直接影响细胞增殖、分化和凋亡等过程,其在包括NSCLC在内的多种恶性肿瘤中被激活和过表达,导致肿瘤细胞异常增殖和恶性转化[12-13]。研究[14]证实:E804作为中药靛玉红的有效成分,对JAK1/STAT3信号通路有抑制作用,可诱导人肿瘤细胞凋亡,但是否对肺癌细胞有相似作用尚不明确。

图6 各组细胞克隆形成数Fig.6 Number of clone formation of cells in various groups
肿瘤细胞的生长失控和去分化是肿瘤恶性行为的生物学基础[15],因此探究肿瘤细胞的增殖和分化特性在肿瘤防治中具有重要意义。研究[16-17]表明:由植物中提取的天然药物可能具有抗肿瘤细胞增殖和诱导分化作用,如中药旱莲草提取物蟛蜞菊内酯和中药藤黄提取物藤黄酸等。本研究结果显示:不同浓度E804可以明显抑制NSCLC A549细胞增殖和迁移,表明E804对NSCLC A549细胞具有一定的杀伤作用,同时也提示E804对NSCLC发展可能有一定的抑制作用。本研究结果显示:不同浓度E804处理A549细胞,呈现抱团不明显、分散生长现象;胞体形态多变,呈现迟缓生长的现象;同时可见漂浮着一些凋亡细胞,提示细胞出现增殖抑制和分化倾向。本研究中软琼脂克隆实验结果显示:E804具有抑制A549细胞克隆形成能力,进一步证实其对A549细胞增殖的抑制作用。
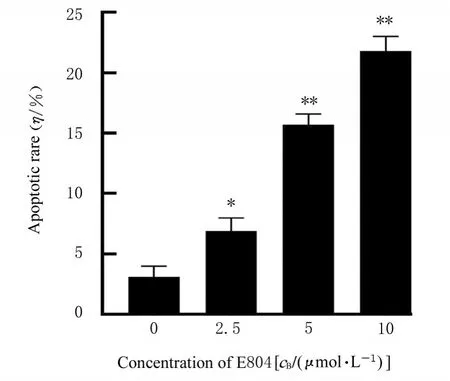
图8 各组细胞凋亡率Fig.8 Apoptotic rates of cells in various groups
细胞凋亡是机体维持自身稳定的基本生理机制,是由部分基因产物及细胞因子参与的有序细胞自我消亡形式[18]。目前已被证实的线粒体凋亡通路是由外因或者药物造成细胞损伤,Bcl-2家族促凋亡成员被激活,同时抗凋亡成员被抑制,凋亡基因作用于线粒体诱导其释放大量细胞色素C,活化caspase-9前体,进而激活caspase-3,引发caspases级联反应,从而诱发细胞凋亡[19]。本研究结果显示:E804可以促进NSCLC A549细胞凋亡,并且2.5、5.0和10.0 μmol·L-1E804组 细 胞 凋 亡 率 升高,E804可引起促凋亡基因Bax、cleaved caspase-3和cleaved caspase-9表达上调,抗凋亡基因Bcl-2表达下调,提示E804可能通过线粒体凋亡通路诱导NSCLC系A549细 胞 凋 亡。
STAT3是连接炎症和肿瘤的关键信号通路分子[20]。肿瘤微环境中,炎症细胞分泌炎症因子白细胞介素6(interleukin-6,IL-6),高表达的炎症因子IL-6通过与GP130/IL-6受体复合物相应位点结合,激活IL-6/JAK1/STAT3信号通路,调控肿瘤 细 胞 增 殖、分 化 和 凋 亡[20-21];研 究[12,22]显 示:在肺癌等多种肿瘤组织和肿瘤细胞中JAK1/STAT3信号通路异常激活,并参与肿瘤的发生、发展、侵袭和转移过程。本研究中Western blotting法检测结果显示:E804能明显抑制A549细胞JAK1和STAT3磷酸化,提示E804可能通过抑制JAK1/STAT3信号通路诱导A549细胞凋亡。
综上所述,E804可抑制A549细胞体外增殖、迁移和分化,并诱导其凋亡,其机制可能与下调JAK1/STAT3信号通路相关蛋白表达有关。本研究结果为以E804为先导的新型小分子化合物治疗NSCLC提供理论支持,为其临床应用提供实验依据。

