移植Toll样受体3处理脐带间充质干细胞对小鼠狼疮性肾炎的治疗效果及其机制
刘 颖,杨 舟,王小波,詹 锋
(1.海南省人民医院 海南医学院附属海南医院风湿免疫科,海南 海口 570311;2.海南省人民医院 海南医学院附属海南医院康复医学科,海南 海口 570311)
系统性红斑狼疮 (systemic lupus erythematosus,SLE)是一种自身免疫性疾病,患病后可能会影响机体内多个器官,包括关节、皮肤、肺和肾脏等。SLE可导致自身抗原的耐受性丧失和致病性自身抗体的产生,并对多个器官系统造成损害[1-2]。狼疮性肾炎(lupus nephritis,LN)是SLE的并发症之一,也是SLE患者发病和死亡的主要原因。约40%~70%的SLE患者在诊断后5年内发展为LN[3]。若LN不加以控制,会迅速发展并引起肾功能受损,最终导致肾衰竭。因此,对LN采用有效的临床管理措施对于维持患者正常肾功能和提高患者生存率至关重要。
间 充 质 干 细 胞(mesenchymal stem cells,MSCs)具有多能性和自我更新能力,可分化为来源于中胚层的细胞,包括软骨母细胞、脂肪细胞和成骨细胞等。目前,干细胞疗法已涉及多种器官系统性疾病。脐带间充质干细胞(umbilical cord mesenchymal stem cells,UC-MSCs)除 具 备 典 型的干细胞特征外,还具有弱免疫原性,可调节免疫功能,已广泛应用于免疫移植相关疾病的研究中[4-6]。研 究[7]表 明:人 脐 带 间 充 质 干 细 胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)移植治疗MRL/Lpr狼疮鼠可降低狼疮活动指标,对LN具有一定治疗作用。Toll样受体(Toll-like receptors,TLRs)能够识别受体功能,在机体免疫系统中发挥重要作用。病原相关分子模式和损伤相关分子模式可以激活TLRs,MSCs表现促组织修复、促血管生成和免疫调控等作用。在不同的炎症环境中,相应的TLRs活化可以调控MSCs的不同功能[8]。因此,全面了解TLRs在MSCs研究中的作用,能够更好地为临床治疗策略提供新思路。本研究通过激活hUC-MSCs中TLR3途径,探讨TLR3途径增强对LN的治疗效果,并阐明其可能的作用机制。
1 材料与方法
1.1 实验动物、细胞、主要试剂和仪器SPF级10周龄雌性MRL/Lpr小鼠45只及雌性C57BL/6C小鼠15只,体质量(20±2)g,由海南医学院动物实验中心提供,动物生产许可证号:SCXK(琼)2017-0013。本研究动物实验部分均按照《实验动物管理条例》进行,严格遵循3R原则,动物实验获得海南省人民医院动物护理和使用委员会审核批准(IACUC编号:20191120-07)。小鼠饲养于SPF级动物饲养间,温度(23±2)℃,湿度50%~60%,12 h黑暗/光照循环,自由摄食和饮水。hUC-MSCs由上海弘顺生物科技有限公司提供。聚肌胞苷酸、胎牛血清、青霉素、链霉素和DMEM培养基购自美国Sigma公司,油红O染色和茜素红S染色购自北京索莱宝生物有限公司,酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)检测试剂盒购自南京建成生物研究公司,HE染色试剂盒和免疫荧光染色试剂盒购自上海蓝基生物公司,PAS染色试剂盒购自北京雷根生物有限公司,BCA蛋白检测试剂盒和化学发光液ECL购自上海碧云天生物研究所,蛋白激酶B(protein kinase B,Akt)抗体、雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抗体、微管相关蛋白1轻链3Ⅱ(microtubule-associated protein 1 light chain 3Ⅱ,LC3Ⅱ)抗 体、酵 母ATG6的同系物(Beclin1)抗体、AlexaFluor-546标记IgG和补体C3抗体均购自英国Abcam公司,FITC-A标记CD11b、CD34、CD45、HLA-DQ和CD90抗体及PE-A标记CD19、HLA-DR、CD44、CD73和CD105抗体购自北京中杉金桥生物技术有限公司,其他试剂均采用国产市售分析纯。荧光倒置显微镜购自德国Leica公司,BD FACSCelesta™细胞分析仪购自美国BD公司,Western blotting荧光化学发光多功能成像系统购自美国赛默飞公司,紫外可见全波长多功能酶标仪购自德国BMG LABTECH公司。
1.2 hUC-MSCs培养和处理冻存的hUC-MSCs 37℃恒温水浴复苏,期间轻轻摇晃。细胞完全溶解后,1 000 r·min-1离心5 min,弃上清液,沉淀中加入含10%胎牛血清与1%青-链霉素双抗DMEM培养基,反复吹打至细胞混匀,置于37℃、5%CO2培养箱中培养,每隔1 d传代1次,细胞传代3次。
取生长状态良好hUC-MSCs,以每孔1×105个的密度接种于6孔细胞培养板,含终浓度为10 mg·L-1的TLR3激动剂聚肌胞苷酸培养基,37℃、5%CO2培养箱中培养24 h后收集细胞。
1.3 实验动物分组和处理45只MRL/Lpr小鼠随机分为模型组、hUC-MSCs组和TLR3+hUC-MSCs组。hUC-MSCs组小鼠尾静脉注射hUC-MSCs(1×106g-1),TLR3+hUC-MSCs组小鼠尾静脉注射经过聚肌胞苷酸处理的hUC-MSCs(1×106g-1),模型组小鼠尾静脉注射等剂量生理盐水。另取C57BL/6C雌性小鼠15只,设为对照组,尾静脉注射等剂量生理盐水。
1.4 hUC-MSCs鉴定取生长状态良好hUCMSCs,PBS缓冲液洗涤细胞,加入FITC-A标记的CD11b、CD34、CD45、HLA-DQ和CD90抗体及PE-A标 记 的CD19、HLA-DR、CD44、CD73和CD105抗体,室温下共同孵育30 min,流式细胞仪检测后FlowJo软件分析结果,检测细胞表面抗原表达情况。
hUC-MSCs以每孔1×105个的密度接种于6孔细胞培养板中,分别用成骨完全培养基和成脂分化培养基诱导培养细胞12 d,分化细胞油红O染色和茜素红S染色,观察细胞内脂质滴和钙沉积情况,光学显微镜下观察并拍照。具体操作按照试剂盒说明书进行。
1.5 Bradford法检测各组小鼠24 h尿蛋白水平给药后每2周检测各组小鼠24 h尿蛋白水平。收集小鼠尿液后双蒸水10倍稀释,采用Bradford法测定尿蛋白水平,以小牛血清蛋白为标准品,具体操作按照试剂盒说明书进行。采用酶标仪于562 nm波长处测定各样品吸光度(A)值,绘制标准曲线,计算各组小鼠24 h尿蛋白水平。
1.6 ELISA法检测各组小鼠血清中抗双链DNA(double stranded DNA,dsDNA)抗体水平注射hUC-MSCs 8周,小鼠禁食12 h后取血,4 000 r·min-1离心10 min,获取血清。采用ELISA法检测各组小鼠血清中抗dsDNA抗体水平,按试剂盒说明书操作,配制梯度标准品和检测试剂,采用酶标仪于450 nm波长处测定各样品A值,绘制标准曲线,计算各组小鼠血清中抗dsDNA水平。
1.7 ELISA法检测各组小鼠肾组织中炎症因子水平注射hUC-MSCs 8周后,麻醉并处死小鼠,无菌环境下解剖取肾组织,剪碎,加入预冷的PBS缓冲液,研磨后 制成匀浆,4 000 r·min-1离心10 min,收集上清液。ELISA法检测上清液中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素6(interleukin-6,IL-6) 和 白 细 胞 介 素17(interleukin-17,IL-17)水平,步骤严格按照试剂盒所示操作进行。
1.8 HE染色和PAS染色观察各组小鼠肾组织病理形态表现取各组小鼠肾组织于4%多聚甲醛固定24 h,常规石蜡包埋,冰冻切片机上制备厚度为5 μm肾组织切片。HE染色试剂盒染色,光学显微镜观察各组小鼠肾组织病理形态表现并拍照。取制备的肾组织石蜡切片,脱蜡脱水后,PAS试剂盒染色,光学显微镜观察各组小鼠肾组织染色情况并拍照。
1.9 免疫荧光染色检测各组小鼠肾组织中IgG和C3沉积情况肾组织切片脱蜡脱水后,PBS缓冲液漂洗3次,每次5 min,5%山羊血清封闭2 h。滴加AlexaFluor-546标记的IgG抗体和C3抗体,室温下避光孵育2 h。PBS缓冲液漂洗干净后,避光环境下甘油封片处理,荧光显微镜观察IgG和C3沉积情况并拍照,采用Image Pro Plus 6.0软件分析荧光强度,以荧光强度表示IgG和C3沉积水平。
1.10 Western blotting法检测各组小鼠肾组织中Akt、mTOR、LC3Ⅱ和Beclin1蛋白表达水平取各组小鼠肾组织,无菌环境下剪碎研磨,加入RIPA裂解液裂解并提取总蛋白,BCA法测定蛋白浓度后,取40 μg等量各蛋白样品10% SDS-PAGE电泳分离,电转至PVDF膜。脱脂奶粉室温下封闭2 h,TBST缓冲液洗膜3次,每次5 min。加入一抗(1∶1 000)4℃孵育过夜。次日,TBST缓冲液洗膜后,加入HRP标记的二抗(1∶5 000),室温孵育1 h。洗膜后采用ECL化学发光液显影,采用Image Pro Plus 6.0软件分析各蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.11 统计学分析采用SPSS 21.0统计软件进行统计学分析,采用Graphpad 8.3.0软件制图。各组小鼠24 h尿蛋白水平,肾组织中炎症因子水平、抗dsDNA抗 体 水 平、IgG和C3沉 积 水 平 和Akt、mTOR、LC3Ⅱ及Beclin1蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 hUC-MSCs鉴定倒置显微镜观察hUCMSCs形态表现结果显示:第5天时可见少量细胞,且细胞聚集成团;第10天可见大量细胞,形状呈纺锤形,有特殊的成纤维细胞样形态。见图1。
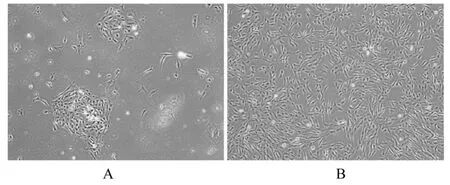
图1 hUC-MSCs形态表现(×200)Fig.1 Morphology of hUC-MSCs(×200)
流式细胞术检测结果显示:细胞表面抗原CD11b、CD19、CD34、CD45、HLA-DQ及HLA-DR呈阴性表达,而CD44、CD73、CD90和CD105呈阳性表达。见图2。
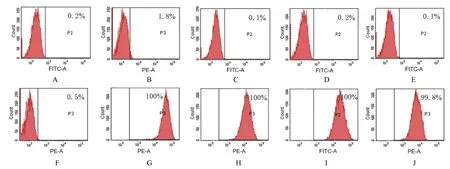
图2 流式细胞术检测hUC-MSCs表面抗原表达情况Fig.2 Expressions of surface antigens of hUC-MSCs detected by flow cytometry
采用成骨和成脂诱导培养基诱导12 d后,油红O染色结果显示:细胞内有大量红色脂滴积累,表明hUC-MSCs可以分化为脂肪细胞;茜素红S染色后可见细胞内有钙沉积出现,表明hUC-MSCs可以分化为成骨细胞。见图3。
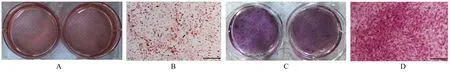
图3 油红O染色(A,B)和茜素红S染色(C,D)观察hUC-MSCs分化Fig.3 Differentiation of hUC-MSCs observed by Oil red O staining(A,B)and Alizarin red S staining(C,D)
2.2 各组小鼠24 h尿蛋白水平给药前,模型组和各治疗组小鼠24 h尿蛋白水平比较差异无统计学意义(P>0.05)。给药4周后,与模型组比较,TLR3+hUC-MSCs组小鼠24 h尿蛋白水平明显降低(P<0.05);给药6和8周后,与模型组比较,hUC-MSCs组和TLR3+hUC-MSCs组小鼠24 h尿蛋白水平均明显降低(P<0.05)。见表1。
表1 各组小鼠24 h尿蛋白水平Tab.1 Levels of 24 h urine protein of mice in various groups [n=15,±s,ρB/(g·L-1)]

表1 各组小鼠24 h尿蛋白水平Tab.1 Levels of 24 h urine protein of mice in various groups [n=15,±s,ρB/(g·L-1)]
*P<0.05 compared with model group.
Group Control Model hUC-MSCs TLR3+hUC-MSCs Urine protein(weeks)0 1.02±0.04 1.97±0.19 1.95±0.20 1.97±0.21 2 1.04±0.03 2.25±0.24 2.18±0.20 2.20±0.23 4 1.03±0.03 2.75±0.28 2.45±0.23 2.03±0.19*6 1.05±0.04 3.41±0.33 2.27±0.23*2.14±0.22*8 1.03±0.02 3.92±0.37 2.25±0.22*2.11±0.21*
2.3 各组小鼠血清中抗dsDNA抗体水平ELISA法检测结果显示:与对照组比较,模型组小鼠血清中抗dsDNA抗体水平明显升高(P<0.05);与模型组比较,hUC-MSCs组和TLR3+hUC-MSCs组小鼠血清中抗dsDNA抗体水平均明显降低(P<0.05);与hUC-MSCs组 比 较,TLR3+hUCMSCs组小鼠血清中抗dsDNA抗体水平明显降低(P<0.05)。见图4。
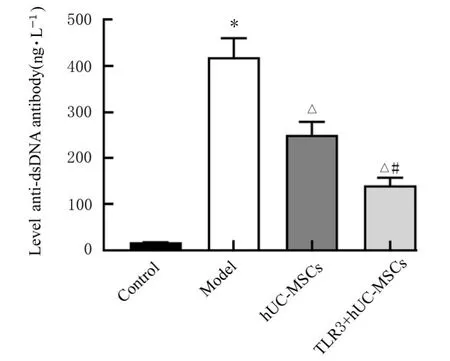
图4 各组小鼠血清中抗dsDNA抗体水平Fig.4 Levels of anti-dsDNA antibody in serum of mice in various groups
2.4 各组小鼠肾组织中炎症因子水平与对照组比较,模型组小鼠肾组织中TNF-α、IL-1β、IL-6和IL-17水平明显升高(P<0.05);与模型组比较,hUC-MSCs组和TLR3+hUC-MSCs组小鼠肾组织中TNF-α、IL-1β、IL-6和IL-17水平均明显降低(P<0.05);与hUC-MSCs组比较,TLR3+hUC-MSCs组 小 鼠肾组织中TNF-α、IL-1β、IL-6和IL-17水平明显降低(P<0.05)。见表2。
表2 各组小鼠肾组织中TNF-α、IL-1β、IL-6和IL-17水平Tab.2 Levels of TNF-α,IL-1β,IL-6 and IL-17 in kidney tissue of mice in various groups [n=15,±s,ρB/(ng·L-1)]

表2 各组小鼠肾组织中TNF-α、IL-1β、IL-6和IL-17水平Tab.2 Levels of TNF-α,IL-1β,IL-6 and IL-17 in kidney tissue of mice in various groups [n=15,±s,ρB/(ng·L-1)]
*P<0.05 compared with control group;△P<0.05 compared with model group;#P<0.05 compared with hUC-MSCs group.
Group Control Model hUC-MSCs TLR3+hUC-MSCs TNF-α 46.24±5.17 276.43±28.05*219.15±23.44△175.30±15.37△#IL-1β 4.02±0.38 13.68±1.45*8.46±0.91△5.94±0.55△#IL-6 17.89±1.57 112.15±9.92*80.21±8.04△66.97±7.31△#IL-17 3.98±0.41 11.59±1.25*7.15±0.71△5.33±0.50△#
2.5 各组小鼠肾组织病理形态表现对照组小鼠肾组织结构完整且清晰,未见异常病理变化;模型组小鼠肾组织中肾小球系膜细胞明显增生,肾小管上皮细胞部分脱落,管腔内可见蛋白样物质,出现空泡,并伴有炎症细胞浸润;与模型组比较,hUC-MSCs组和TLR3+hUC-MSCs组小鼠肾组织中肾小球系膜细胞增生有不同程度缓解,肾小管硬化和炎症细胞浸润现象明显减少;与hUC-MSCs组比较,TLR3+hUC-MSCs组小鼠肾组织上述病理形态改善更加明显。见图5。
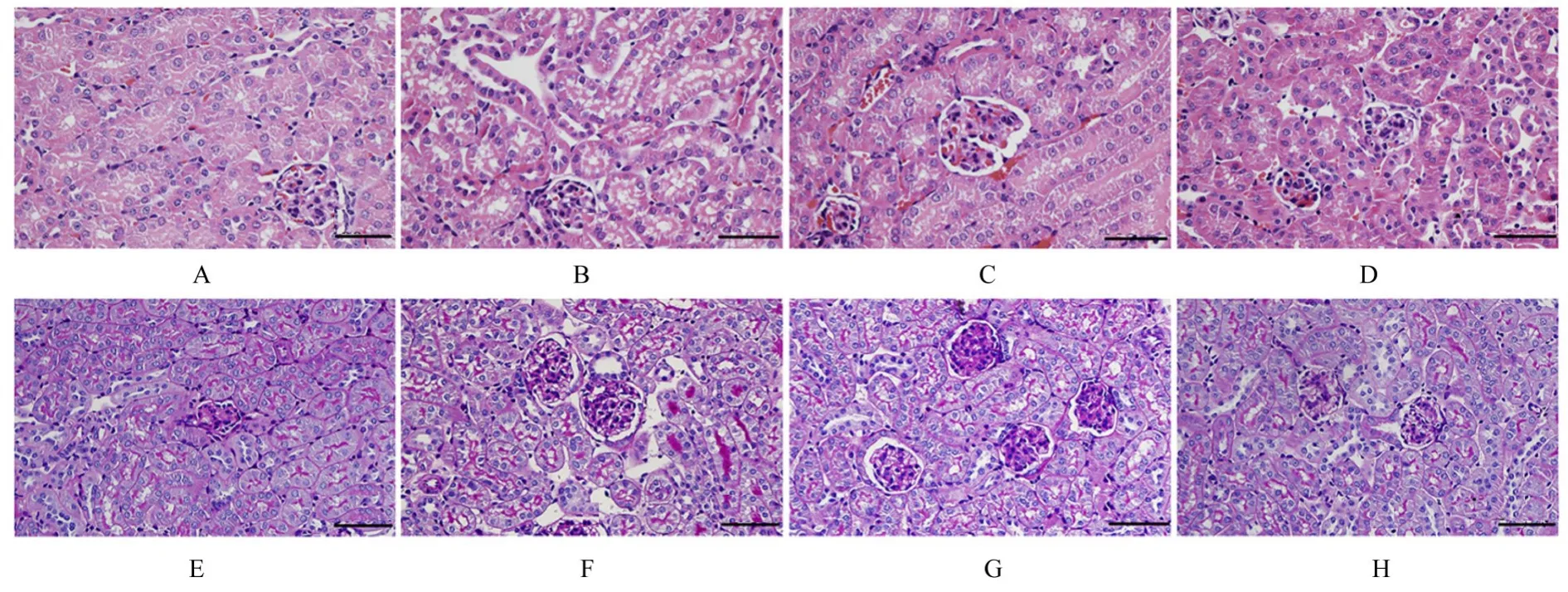
图5 HE染色(A-D)和PAS染色(E-H)观察各组小鼠肾组织病理形态表现(Bar=100 μm)Fig.5 Pathomorphology of kidney tissue of mice in various groups observed by HE staing(A-D)and PAS staing(E-H)(Bar=100 μm)
2.6 各组小鼠肾组织IgG和C3沉积情况免疫荧光染色结果显示:对照组小鼠肾组织中IgG和C3沉积较少;与对照组比较,模型组小鼠肾组织肾小球中有大量IgG和C3沉积,荧光强度明显增加(P<0.05);与 模 型 组 比 较,hUC-MSCs组 和TLR3+hUC-MSCs组小鼠肾组织中IgG和C3沉积减少,荧光强度均明显降低(P<0.05);与hUCMSCs组比较,TLR3+hUC-MSCs组小鼠肾组织中IgG和C3沉积减少,荧光强度明显降低(P<0.05)。见图6。

图6 各组小鼠肾组织中IgG和C3沉积情况Fig.6 Deposition of IgG and C3 in kidney tissue of mice in various groups
2.7 各组小鼠肾组织中Akt、mTOR、LC3Ⅱ和Beclin1蛋白表达水平Western blotting检测结果显示:与对照组比较,模型组小鼠肾组织中Akt和mTOR蛋白表达水平明显升高(P<0.05),LC3Ⅱ和Beclin1蛋白表达水平明显降低(P<0.05);与模型组比较,hUC-MSCs组和TLR3+hUC-MSCs组小鼠肾组织中Akt和mTOR蛋白表达水平明显降低(P<0.05),LC3Ⅱ和Beclin1蛋白表达水平明显 升 高(P<0.05);与hUC-MSCs组 比 较,TLR3+hUC-MSCs组小鼠肾组织中LC3Ⅱ和Beclin1蛋白表达水平明显升高(P<0.05),Akt和mTOR蛋白表达水平差异无统计学意义(P>0.05)。见图7和8。
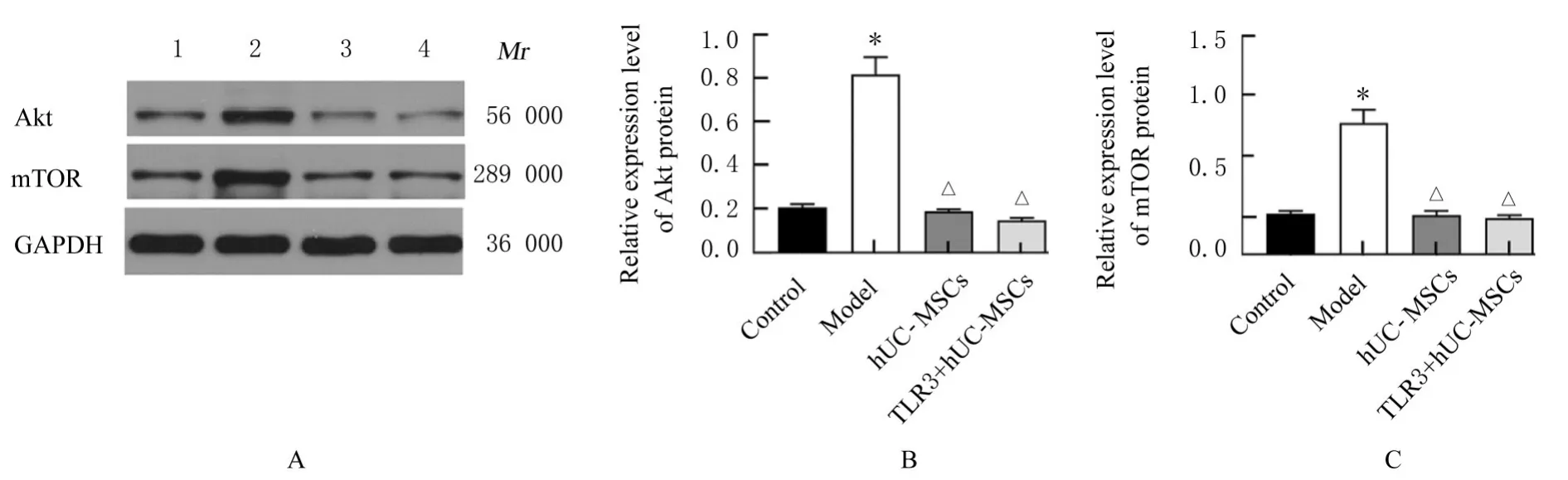
图7 各组小鼠肾组织中Akt和mTOR蛋白表达电泳图(A)和直条图(B,C)Fig.7 Electrophoregram(A)and histogram(B,C)of expressions of Akt and mTOR proteins in kidney tissue of mice in various groups
3 讨 论
LN作为SLE最常见的并发症,是导致SLE患者死亡的主要原因。目前,临床上治疗LN的方法主要是使用激素和免疫抑制剂,但部分患者预后较差,并最终发展为终末期肾病[3]。因此,寻找新型有效的LN治疗方法对于患者具有重要意义。MRL/Lpr小鼠症状与人类SLE相似,包括明显的血清自身抗体、免疫复合物肾小球肾炎和血管炎等,是SLE动物模型之一[9]。本研究检测结果显示:MRL/Lpr小鼠24 h尿蛋白水平升高,肾小球系膜细胞明显增生,肾小管萎缩并坏死,并伴有炎症细胞浸润等现象,提示小鼠肾组织发生损伤,成功构建LN模型。
MSCs不仅具有干细胞多能性,还具有强大的抗炎和免疫调节特性,已被认为是治疗自身免疫性疾病和炎性疾病的潜在方法,可治疗移植物抗宿主病、克罗恩氏病、多发性硬化、SLE和类风湿性关节炎等疾病[10-11]。LI等[12]研究发现:hUC-MSCs可减弱慢性不可预见轻度应激(chronic unpredictable mild stress,CUMS)诱导的抑郁小鼠中NLRP3激活,该作用可能与其调节神经元中补体C3a相关。LI等[13]报 道:hUC-MSCs经 抗 菌 融 合 蛋 白BPI21/LL-37修饰后不影响其干性和免疫调节能力,修饰后hUC-MSCs全身内毒素水平明显降低,抗炎能力增强,对败血症起到良好治疗作用。TLR3通路可以诱导局部免疫细胞极化,调节免疫微环境方式,发挥羊膜MSCs移植治疗大鼠创伤性脑损伤的作用[14]。聚肌胞苷酸作为TLR3激动剂,能够与TLR3结合参与调节机体免疫功能、炎症反应和细胞行为学等过程。本研究结果显示:移植hUC-MSCs和移植TLR3激动剂聚肌胞苷酸处理后的hUC-MSCs对小鼠LN具有保护作用;与单独移植hUC-MSCs比较,移植TLR3激动剂聚肌胞苷酸处理后的hUC-MSCs对小鼠LN改善作用明显增强,提示激活TLR3可增强移植hUC-MSCs的治疗效果。
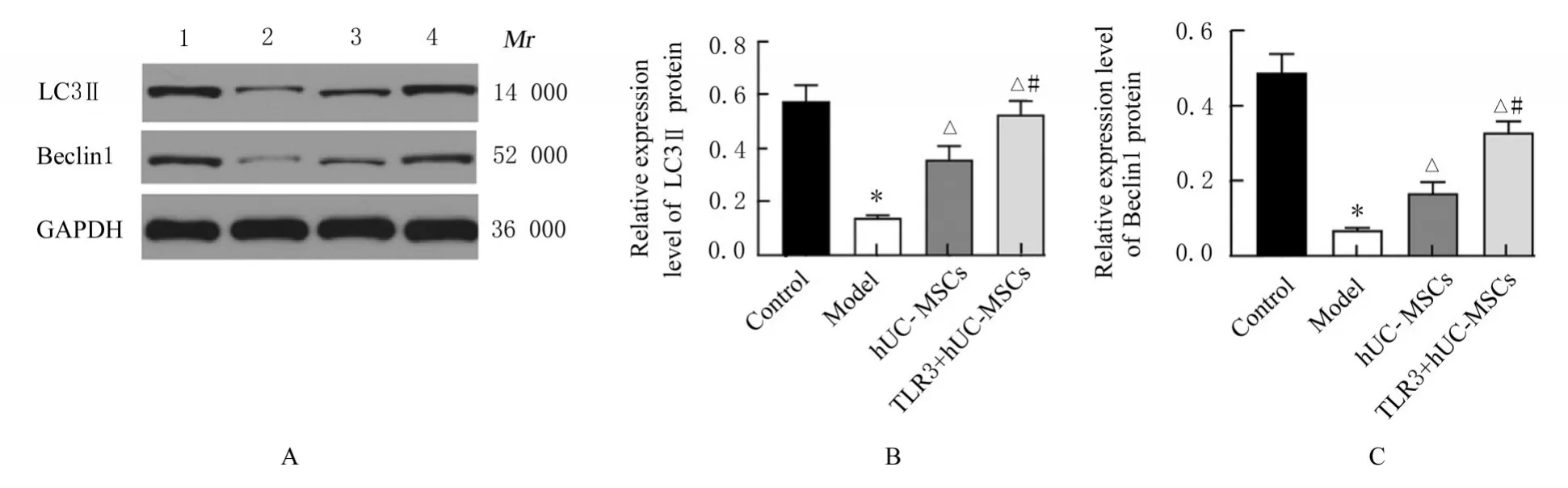
图8 各组小鼠肾组织中LC3Ⅱ和Beclin1蛋白表达电泳图(A)和直条图(B,C)Fig.8 Electrophoregram(A)and histogram(B,C)of expressions of LC3Ⅱand Beclin1 proteins in kidney tissue of mice in various groups
LN主要由Ⅲ型超敏反应所引起,可导致免疫复合物的形成。抗dsDNA抗体与DNA结合并形成抗dsDNA免疫复合物并沉积于肾脏肾小球基底膜附近的系膜、内皮下和上皮下区域,导致LN发作时产生炎症反应[15],同时,补体途径被中性粒细胞和其他炎症途径所激活[16]。研究[17]表明:免疫复合物沉积引发的炎症反应与LN的持续时间和进展密切相关。肾脏免疫复合物沉积或补体的激活促进细胞因子的分泌,从而促进炎症细胞浸润。补体途径在免疫系统中发挥关键作用,一方面可导致器官的更多病理损伤,另一方面可加剧组织炎症反应,补体C3水平升高会促进肾病间质纤维化和肾损伤[18]。研究[19]表明:通过MSCs移植治疗MRL/Lpr小鼠后,可降低抗dsDNA抗体水平和肾小球补体C3的沉积。本研究结果显示:与模型组比较,hUC-MSCs和TLR3+hUC-MSCs组MRL/Lpr小鼠肾组织中TNF-α、IL-1β、IL-6和IL-17水平均明显降低,TLR3+hUC-MSCs组小鼠肾组织中炎症因子水平更低;2组小鼠血清中抗dsDNA抗体水平降低,肾组织中IgG和C3沉积明显减少,TLR3+hUC-MSCs组小鼠血清中抗dsDNA抗体水平更低,且IgG和C3沉积更少。
自噬是维持细胞和机体稳态的核心分子途径,其在多种细胞类型和疾病中均具有保护作用,有助于塑造免疫系统,并参与多种自身免疫性疾病。研究[20-21]显示:药物和基因干预损害自噬反应促进或加重疾病。本研究结果显示:模型组MRL/Lpr小鼠肾组织中自噬相关蛋白LC3Ⅱ和Beclin1蛋白表达水平较低,hUC-MSCs组和TLR3+hUCMSCs组小鼠肾组织中LC3Ⅱ和Beclin1蛋白表达水平升高,提示hUC-MSCs中TLR3激活后可能通过诱导自噬发生,从而达到对肾组织细胞的保护作用。
综上所述,TLR3激活能够增强hUC-MSCs移植治疗小鼠LN的作用,降低小鼠24 h尿蛋白水平,降低血清中抗dsDNA抗体水平并减少肾组织中IgG和C3沉积,抑制肾组织炎症反应,调控肾组织自噬发生。本研究为hUC-MSCs移植治疗小鼠LN提供了新的思路和治疗策略。

