胃下部癌No.6组淋巴结分拣特点和转移危险因素分析
李疆 曹英豪 邓胜和 蔡开琳
目前,国内外专家已经达成共识,胃癌根治的标准是外科手术切除[1],能否彻底清除已有转移的淋巴结是决定病人预后的一个主要因素[2-3]。我国学者之前已经针对胃癌淋巴结转移相关因素开展了多项回顾性研究,但仍然缺乏对于腹腔镜下胃癌根治术后淋巴结分组分拣数据的独立分析研究。胃上部癌和食管胃结合部癌的腹腔镜手术尚存在争议,胃下部癌手术治疗规范已明确。我们选择胃下部癌作为本次研究对象。
对象与方法
一、对象
2017年1月~2017年12月间我院胃肠外科行腹腔镜下远端胃癌D2根治术的胃癌病人66例,其中男性46例,女性20例,年龄28~81岁,平均年龄(57.24±11.67)岁。纳入标准:(1)术前胃镜,超声胃镜,胃三维CT检查和病理诊断为胃下部癌;(2)术前CT评估无肝脏、肺、骨及其他远处转移;(3)术前未行辅助放化疗;(4)既往无上腹部手术史,所有病人均在腹腔镜下完成手术切除和消化道重建,无中转开腹,术后病理资料完备,明确无远处转移。本研究经医院伦理委员会审查通过,所有病人均签署知情同意书。
二、方法
1.手术和淋巴结分拣方法:所有病人均由同一团队完成,采用5孔法行腹腔镜下远端胃癌根治术,清扫范围为D2(根据日本胃癌学会《胃癌治疗指南》明确定义:No.1、3、4sb、4d、5、6、7、8a、9、11p、12a)。手术过程中仔细解剖,在主要血管离断处进行定位标记,以便术后进行淋巴结分拣。消化道重建方式为Billroth-I三角吻合和非离断Roux-en-Y吻合,消化道重建完成后均使用术中胃镜检查吻合口。术后由主刀医生按照日本胃癌学会的标准,立即分拣各组淋巴结,将各组淋巴结装袋编号送病理科。按照胃下部癌D2清扫范围将1组,3组,4sb组,4d组,5组,6组,7组,8a组,9组,11p组,12a组淋巴结分别命名为No.1、No.3、No.4sb、No.4d、No.5、No.6、No.7、No.8a、No.9、No.11p和No.12a组。
2.观察指标:临床病理资料包括性别、年龄、肿瘤浸润胃壁深度(T分期)、肿瘤直径、肿瘤组织分化程度、肿瘤是否侵犯神经、是否侵犯脉管、体质指数(BMI)、HER2评分、肿瘤周围是否有癌结节和肿瘤位置。年龄分为>60岁和≤60岁;肿瘤浸润深度分为T1-T2和T3-T4;分化程度按高分化组、中分化组(包括高-中分化)和低分化组(中-低分化组,印戒细胞癌及未分化癌归为低分化癌);BMI根据WHO标准将其分为低重组(BMI<18.5 kg/m2)、正常组(18.5 kg/m2≤BMI<25.0 kg/m2)和超重组(BMI≥25.0 kg/m2) 3组;HER2表达参照2011版《胃癌HER2检测指南》分为阳性和阴性;淋巴结分拣数据:每位病人记录并计算No.1、No.3、No.4sb、No.4d、No.5、No.6、No.7、No.8a、No.9、No.11p和No.12a各组清扫淋巴结总数、各组转移淋巴结总数、各组淋巴结转移的病人所占的比例、各组淋巴结转移比率。分析 No.6组淋巴结转移与临床病理资料的相关性;分析No.6组淋巴结转移和No.1、No.3、No.4sb、No.4d、No.5、No.7、No.8a、No.9、No.11p和No.12a各组淋巴结转移的相关性。
三、统计学方法
应用SPSS 17.0软件分析数据,计量资料比较采用单因素方差分析和秩和检验;计数资料比较采用χ2检验和Fisher’s检验;采用Logistic回归进行多因素分析;P<0.05为差异有统计学意义。
结果
1.各组淋巴结转移病人比例比较:在所有66例病人中,有33例被发现淋巴结转移(50.0%)。见表1。所有11组分拣淋巴结中,比例由高到低排列为No.3组28.8%,No.6组27.3%,No.4d组 25.8%,No.7组22.7%,No.8a组13.6%,No.5组9.1%,No.1组6.1%,No.9组6.1%,No.12a组 4.5%,No.4sb组3.0%,No.11p组0%。其中No.3组淋巴结转移的病人最多,所有病人均未发现No.11p组淋巴结转移。按照淋巴结分站统计,第1站淋巴结(No.3、No.4d、No.5、No.6组)转移为32例(48.5%),第2站淋巴结(No.1、No.7、No.8a、 No.9、No.11p、No.12a组)转移为17例(25.8%);第3站淋巴结(No.4sb组)转移为2例(3.0%);有1例病人在没有第1站淋巴结转移的情况下直接出现No.7组和No.8a组的转移;No.6组淋巴结转移病人比例与No.1、No.4sb、No.5、No.9、No.11p和No.12a组,差异有统计学意义(P<0.05)。见表1。
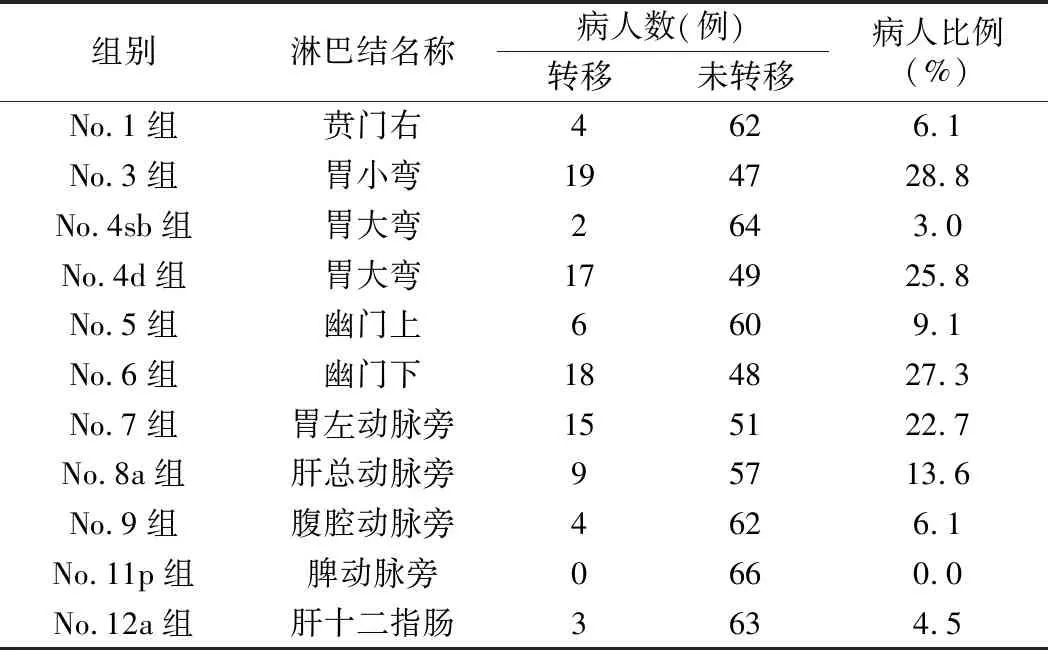
表1 腹腔镜下远端胃癌D2根治术各组淋巴结转移病人比例的比较
2.各组淋巴结转移率的比较
转移淋巴结总数和清扫淋巴结总数的比值即为淋巴结转移率。所示淋巴结转移率由高到低排列为No.6组25.8%,No.3组14.2%,No.7组12.2%,No.4d组11.6%,No.5组11.1%,No.8a组8.7%,No.12a组 4.2%,No.1组2.9%,No.4sb组2.8%,No.9组2.6%,No.11p组0%。所有病人一共清扫2 099枚淋巴结,平均淋巴结分拣个数为(31.80±11.83)枚,其中转移淋巴结为225枚,总淋巴结转移率为10.7%。No.6组与No.1、No.3、No.4sb、No.4d、No.5、No.7、No.8a、No.9、No.11p和No.12a组淋巴结转移率,差异有统计学意义(P<0.05)。见表2。
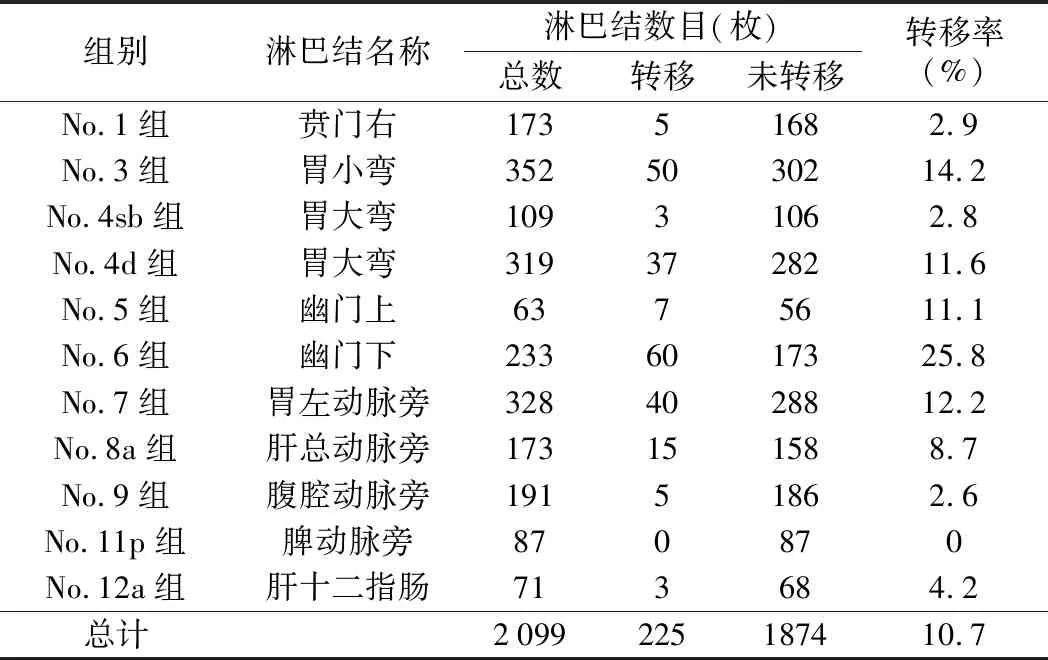
表2 腹腔镜下远端胃癌D2根治术各组淋巴结转移率比较
3.No.6组淋巴结转移和病人临床病理特征关系的单因素分析:见表3。单因素分析显示,肿瘤浸润深度T1-T2为36例,其中No.6 组阳性为5例,阴性为31例,转移比率为13.9%;T3-T4有30例,其中淋巴结阳性为13例,阴性为17例,转移比率为43.3%,差异有统计意义(χ2=7.153,P=0.007);神经侵犯32例,淋巴结阳性14例,无神经侵犯34例,淋巴结阳性为4例,神经侵犯淋巴结转移比率为43.8%,差异有统计学意义(χ2=8.503,P=0.004);脉管侵犯25例,淋巴结阳性为11例,41例无脉管侵犯,淋巴结阳性为7例,脉管侵犯淋巴结转移比率为44.0%,差异有统计学意义(χ2=5.677,P=0.017);HER2阳性的为5例,淋巴结阳性的为4例,HER2阴性的为61例,淋巴结阳性为14例,HER2阳性的淋巴结转移比率为80%,差异有统计学意义(χ2=4.979,P=0.026);肿瘤周围有癌结节7例,淋巴结阳性5例,无癌结节59例,淋巴结阳性13例,癌结节淋巴结转移比率为71.4%,差异有统计学意义(χ2=5.408,P=0.020)。No.6组淋巴结转移与病人性别,年龄,肿瘤直径,分化程度,BMI和肿瘤位置无相关性,差异无统计学意义(P>0.05)。
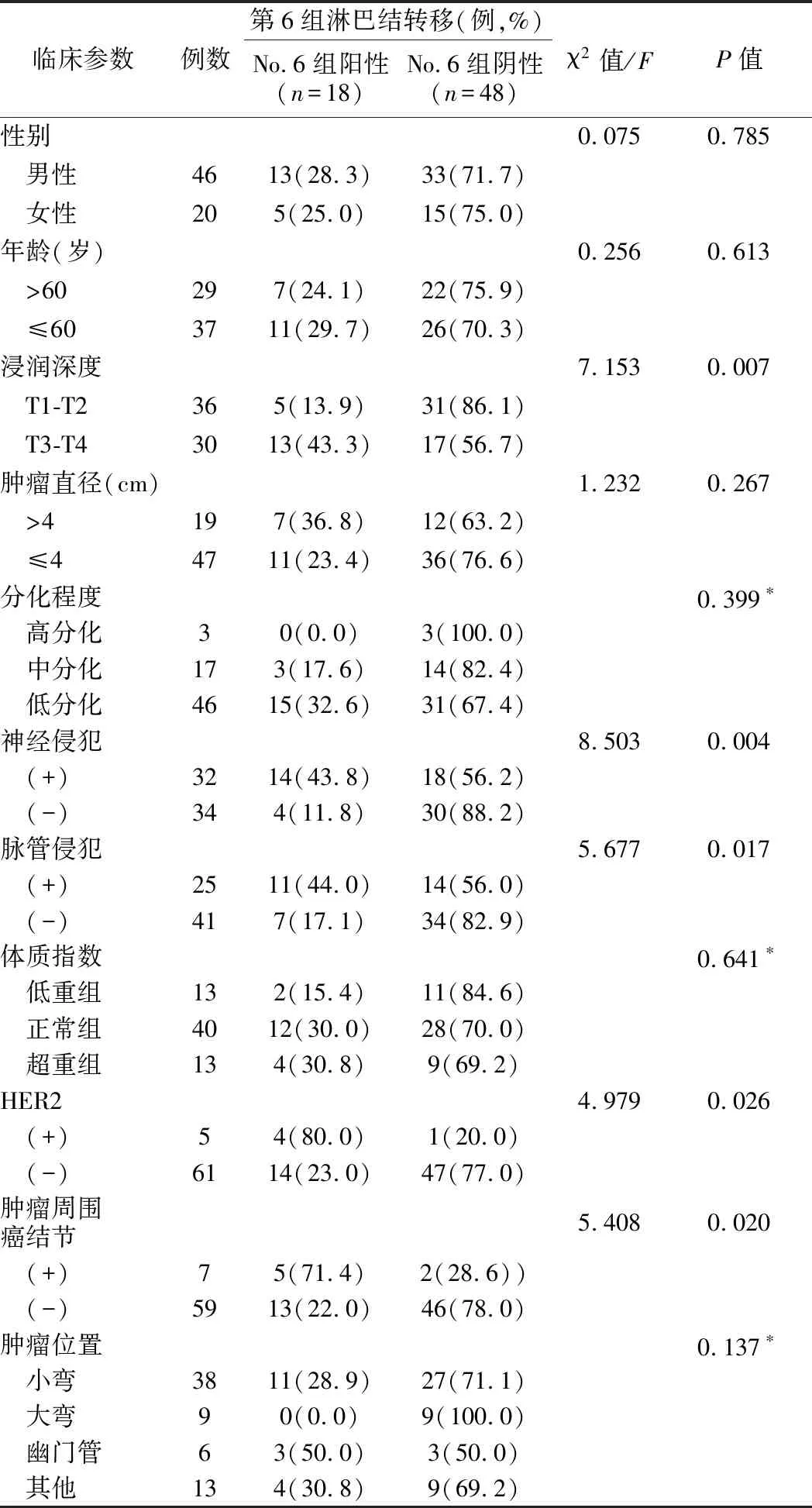
表3 No.6组淋巴结转移和病人临床病理特征关系的单因素分析
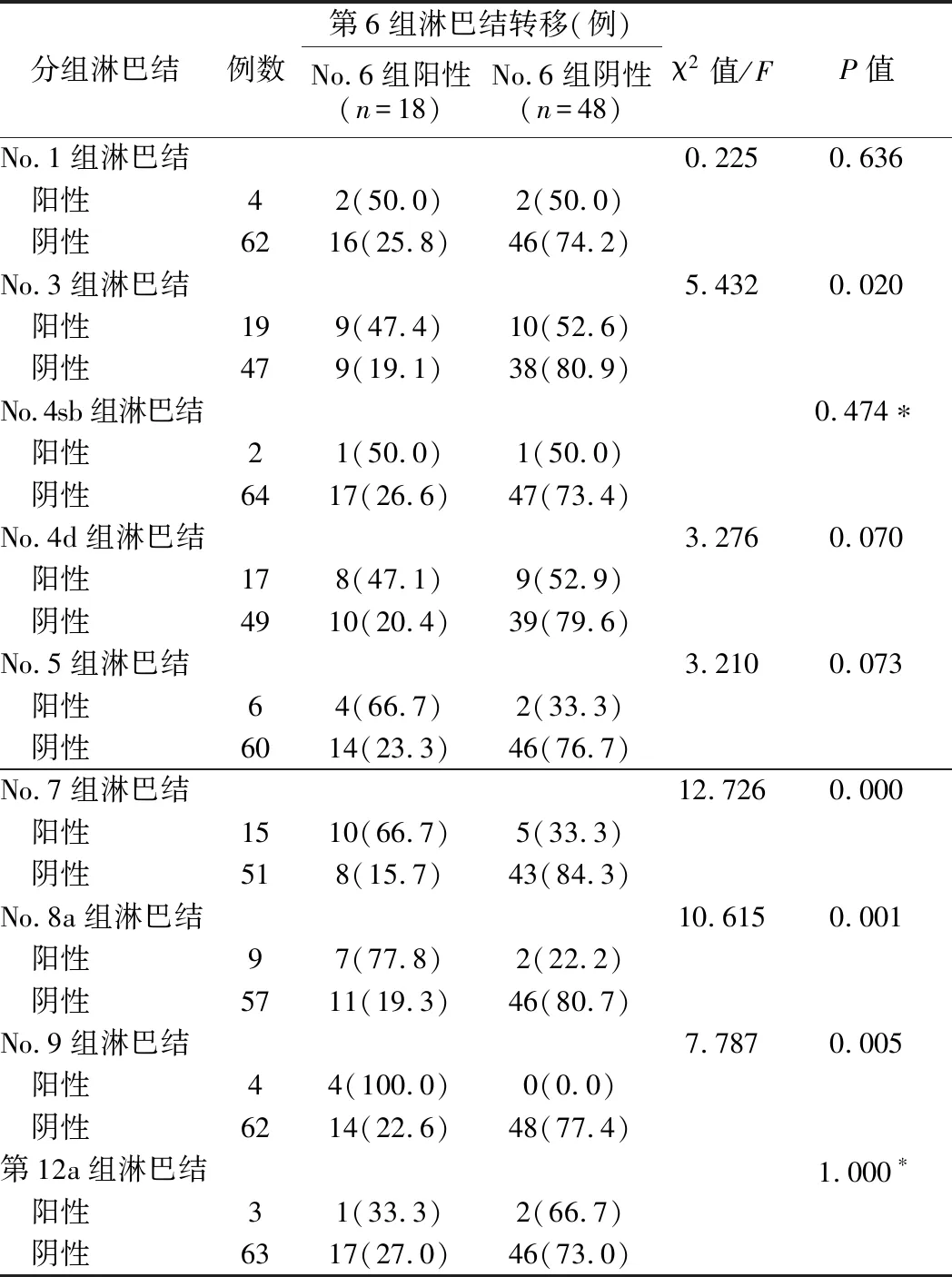
表4 No.6组淋巴结转移与其他各组淋巴结转移的关系
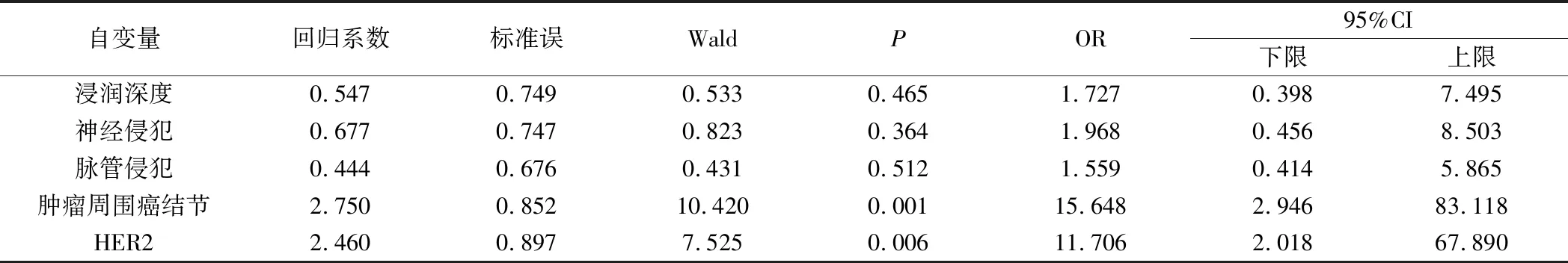
表5 No.6组淋巴结转移的多因素分析
4.No.6组淋巴结转移和其他各组淋巴结转移的关系见表4。进一步将各组淋巴结按转移与否分组,No.6组淋巴结作为第1站的胃周淋巴结,其转移与第1站No.3组(χ2=5.432,P=0.020)和第2站的No.7(χ2=12.726,P=0.000)、No.8a(χ2=10.615,P=0.001)、No.9组淋巴结转移(χ2=7.787,P=0.005)密切相关(P<0.05)。No.6组阳性的淋巴结平均分拣个数为(5.94±2.24)枚,No.6组阴性的淋巴结分拣个数平均为(2.63±2.61)枚,两者行秩和检验,差异有统计学意义(P<0.05),但进一步研究发现,No.6组淋巴结分拣个数与肿瘤直径,肿瘤浸润深度,神经侵犯,脉管侵犯等均无相关性(P>0.05)。
5.No.6组淋巴结转移的多因素分析见表5。以单因素分析差异有统计学意义的指标如肿瘤浸润深度,神经侵犯,脉管侵犯,肿瘤周围癌结节和HER2表达为自变量,以No.6 组淋巴结转移与否为因变量进行二元Logistic分析,结果显示,肿瘤周围癌结节(OR=15.648,95%CI:2.946~83.118)和HER2表达(OR=11.706,95%CI:2.018~67.890)为No.6 组淋巴结转移的独立危险因素。
讨论
我们根据胃癌D2根治术清扫范围将各组淋巴结分拣和转移数据整理并分析,总结胃下部癌No.6组淋巴结的转移特点:(1)胃周淋巴结No.3、No.4d、No.5和No.6组转移的病人比例和淋巴结转移率均位居靠前,这与国内其他研究者的数据大体一致[4-5]。本研究结果表明,所有发现淋巴结转移的33例病人中,出现胃周淋巴结转移的病人比例为97.0%,仅有1例病人没有出现第1站胃周淋巴结转移而直接出现第2站淋巴结转移,提示胃下部癌的淋巴结转移可能是按解剖学部位由近及远发生的,但也存在“跳跃”现象。因此无论早期或者进展期胃下部癌,胃周淋巴结均是需要重点清扫的对象。(2) 作为胃下部癌的第1站淋巴结,No.6组淋巴结是转移病人比例位居第2,淋巴结转移率位居第1,其转移比较普遍,这与既往研究结论相符[6-7],No.6组幽门下淋巴结是接受胃大弯侧淋巴液回流的主要胃周淋巴结,因此,在腹腔镜下远端胃癌D2根治术中,No.6组淋巴结的清扫尤为重要。(3)本研究我们还发现,No.6组淋巴结作为第1站的胃周淋巴结,其转移与第,1站No.3组和第2站的No.7、No.8a、No.9组淋巴结转移密切相关,国内外研究结果提示:No.6组淋巴结转移是No.14v组淋巴结转移的高危因素[8-9]。不同胃癌淋巴结分组转移情况可以预测远处对应淋巴结的转移[10],提示No.6组淋巴结转移是胃下部癌淋巴结转移的重要标志,能够预测远处淋巴结的转移风险,也充分说明彻底清扫No.6组淋巴结和与之转移密切相关的远处淋巴结是十分必要的。(4)单因素和多因素相关分析显示,肿瘤周围癌结节和HER2表达是No.6组淋巴结转移的独立危险因素。通过本研究我们认为可以凭借术前完善的内镜评估,内镜活检组织病理学诊断和影像学评估(给出cTNM分期意见)帮助术前评估No.6组淋巴结转移的可能性;而在术中我们可直接选取No.6组淋巴结中的疑似转移者,进行快速冰冻切片病理检查。
本研究发现,对腹腔镜下远端胃癌根治术后标本进行淋巴结分组分拣是完全可行的,病理报告中也对各分组淋巴结转移情况进行描述。同时对No.6组淋巴结分拣数据开展研究发现,其淋巴结阳性的分拣个数大于淋巴结阴性,这是否暗示更多的分拣淋巴结对发现阳性转移淋巴结是有意义的,我们之前的研究也证实淋巴结分组分拣可能发现更多的淋巴结,但不意味着淋巴结转移率的提升[11]。我们发现,和之前的研究资料相比较[12],我们研究中各组淋巴结转移率并不高,最高不超过30%,这可能与纳入病例分期较早有关。随着胃镜技术的普及,胃癌病人被更早期的诊断出来,通过胃部三维增强CT或超声内镜检查对胃癌进行术前TNM分期也已经在临床工作中得到广泛应用,从而使一部分分期较晚的病人先选择行辅助化疗及免疫治疗,这反映出目前国内胃肠外科治疗中心的发展趋势。我们会为分期更早的病人手术,然而并不意味着不存在淋巴结转移风险。
胃癌手术标本离体分拣是保证手术质量和提供胃癌精准病理学分期的重要手段[13]。胃癌根治术强调整块切除,但是如果术中没有进行标记,标本离体后很难分清各组淋巴结的确切界限,而分拣过程由不熟悉手术过程的病理科医师来完成也是勉为其难。为保证术后分拣质量,术中对各组淋巴结需做好相应标记,离体标本淋巴结分拣最好由主刀外科医师亲自操作,这样可以更准确地分拣各组淋巴结,从而保证胃癌的病理分期。
综上所述,胃癌的治疗需要多学科合作,不仅需要高质量的手术切除和辅助治疗,专业的内镜医师,影像医师和病理医师缺一不可。对于腹腔镜下远端胃癌根治术,为保障手术质量,应通过术前和术中精准评估来判断No.6组淋巴结转移与否,从而协助制定合理的淋巴结清扫范围。

