响应面法优化超声辅助提取山药素Ⅰ工艺
王晓辉,胡明航,董黎明,李 靖,陈 艳,李 昭,黄 菊
(徐州工程学院 材料与化学工程学院,江苏 徐州 221018)
山药为薯蓣的根茎,为我国传统的药食同源食物[1-2],含有多糖、氨基酸、脂肪酸和山药素类化合物等,具有降血糖、降血脂和抗氧化等药理活性,广泛用于治疗糖尿病、肾炎和癌症等临床疾病[3-4].1972年,Hashimoto等[5]由山药零余子中分离得到山药素.山药素有5种构型,山药中含量最高的山药素Ⅰ是控制山药休眠的重要因素之一,具有抗菌、抗氧化及抑制α-D-葡萄糖苷酶等生物活性的作用[3,5-7].由于山药中山药素类物质的含量较低,国外研究者主要致力于研究山药素类物质的人工合成,但合成成本较高,产品价格昂贵,其药理及生物活性研究进展缓慢[5,8].为推动山药及其活性成分的研究,近年来,我国学者如曹国栋[9]和朱金花等[10]建立了同时测定山药素类化合物的HPLC法,但对精密仪器的操作要求较高;刘绣华等[11]开发了一种从植物山药中提取山药素的方法,但对山药素Ⅰ的提取研究较缺乏.
为此,本文选取与山药素Ⅰ的结构类似,在308 nm左右处有最大吸收,且具有价格低廉优势的9-溴菲代替山药素Ⅰ作为标准品,因而山药素含量可以9-溴菲计,由此建立了铁棍山药提取液中山药素Ⅰ的紫外分光光度分析方法.在此基础上,通过单因素试验和响应面试验并结合超声技术,探讨主要因素对铁棍山药中山药素Ⅰ提取量的影响,优化提取工艺,为山药素Ⅰ的深入研究与开发提供依据.
1 实验部分
1.1 材料与试剂
铁棍山药,江苏市售;9-溴菲,TCI(上海)化成工业发展有限公司;无水乙醇,分析纯;蒸馏水,自制.
1.2 仪器与设备
粉碎机,浙江万基塑业有限公司;小型研磨机,永康市招风耳工贸有限公司;筛子,100目;电热鼓风干燥箱DHG-9070A,苏州江东精密仪器有限公司;超声波电加热清洗机UC-2H,上海泰坦科技股份有限公司;紫外-可见分光光度计UV-5500PC,上海元析仪器有限公司;低速离心机TDL-4,上海安亭科学仪器厂;电子天平CN-LQC20002,昆山优科维特电子科技有限公司;容量瓶,江苏金钥匙科教仪器设备有限公司.
1.3 方法
1.3.1 原料预处理
铁棍山药→洗净去皮→切片→50 ℃干燥粉碎→过筛→乙醇浸泡→超声提取→抽滤→离心→滤液定容.
1.3.2 标准曲线绘制
9-溴菲与山药素Ⅰ的结构类似,在308 nm左右处有最大吸收,但具有价格低廉的优势,本研究选择9-溴菲代替山药素Ⅰ作为标准品,建立铁棍山药提取液中山药素Ⅰ的紫外分光光度分析方法,山药素含量以9-溴菲计.准确称量5 mg 9-溴菲,用无水乙醇溶于25 mL容量瓶中配成0.2 mg/mL的标准储备液.各移取0、2.5、5.0、7.5、10.0、12.5 mL储备液于25 mL容量瓶中,以无水乙醇定容至刻度,摇匀、静置15 min.配成0、0.02、0.04、0.06、0.08、0.10 mg/mL的9-溴菲标准液.以无水乙醇为空白对照,以吸光度(A)对质量浓度(c)绘制标准曲线,经最小二乘法得标准曲线方程:A=6.189c+0.011 9,R2=0.998 0,说明在0~0.10 mg/mL吸光度和9-溴菲浓度呈良好的线性关系.
1.3.3 铁棍山药山药素Ⅰ含量测定
移取2 mL铁棍山药山药素Ⅰ的提取液于25 mL容量瓶中,定容、摇匀、静置 15 min,测定308 nm波长处吸光度.

式中:A为铁棍山药山药素Ⅰ提取液吸光度;V0为提取液定容体积,mL;V1为提取液定容后吸取的体积,mL;V2为稀释液定容体积,mL;m为铁棍山药粉样品质量,g.
1.3.4 单因素试验设计
称取过100目筛的干燥铁棍山药粉1.0 g,超声功率240 W,温度 50 ℃,分别在如下条件下进行提取试验.
1)液料比.在超声时间30 min和乙醇体积分数70%时,按液料比(mL/g)10∶1~50∶1.
2)乙醇体积分数.在超声时间30 min和液料比40∶1时,按乙醇体积分数20%~80%.
3)超声时间.在液料比40∶1和乙醇体积分数30%时,按超声时间20~90 min.
分别按照章节1.3.3的方法测定铁棍山药山药素Ⅰ含量,考察各单因素对山药素Ⅰ提取量的影响.
1.3.5 Box-Behnken试验设计
以山药素Ⅰ提取量为响应,以上3因素为考察变量,采用Design-expert 8.0.6软件,利用 Box-Behnken方法设计响应面试验,各因素与水平见表1.

表1 响应面试验因素与水平
2 结果与分析
2.1 单因素试验结果
2.1.1 液料比对提取量的影响
如图1所示,在液料比增加时,山药素Ⅰ的提取量先增后减,在40∶1处达到最大值.因为随着溶剂量的增多,其稀释作用降低了山药素Ⅰ的溶出阻力,但液料比过高时,山药素Ⅰ的提取量反而略有下降.为了节约溶剂及降低提取成本,液料比选择40∶1.
2.1.2 乙醇体积分数对提取量的影响
如图2所示,在乙醇体积分数增加时,山药素Ⅰ的提取量也出现最大值.因为山药素Ⅰ为水溶性分子,30%体积分数的乙醇溶液和山药素Ⅰ的极性相当.当乙醇体积分数过高时,溶液极性过低,山药素Ⅰ的溶出困难,不利于提取量的提高.过高的乙醇体积分数也加重了提取的成本,乙醇体积分数以30%为宜.

图2 乙醇体积分数对山药素Ⅰ提取量的影响
2.1.3 超声时间对提取量的影响
如图3所示,山药素Ⅰ提取量的最大值出现在超声时间为60 min处.这可能是因为超声剧烈的振热效应造成部分山药素Ⅰ破坏分解,故适宜的超声时间为60 min.

图3 超声时间对山药素Ⅰ提取量的影响
2.2 响应面试验结果
根据Box-Behnken原理,对液料比、乙醇体积分数和超声时间进行3因素3水平的响应面试验,结果见表2.

表2 响应面试验结果
Design-expert 8.0.6多元回归拟合响应值-山药素Ⅰ提取量(Y)对编码自变量液料比(Xa)、乙醇质量浓度(Xb)和超声时间(Xc)的二次多项回归方程:
Y=0.66-0.000 75Xa-0.028Xb-0.015Xc+0.007 75XaXb-0.020XaXc-
0.015XbXc-0.080Xa2-0.037Xb2-0.019Xc2,

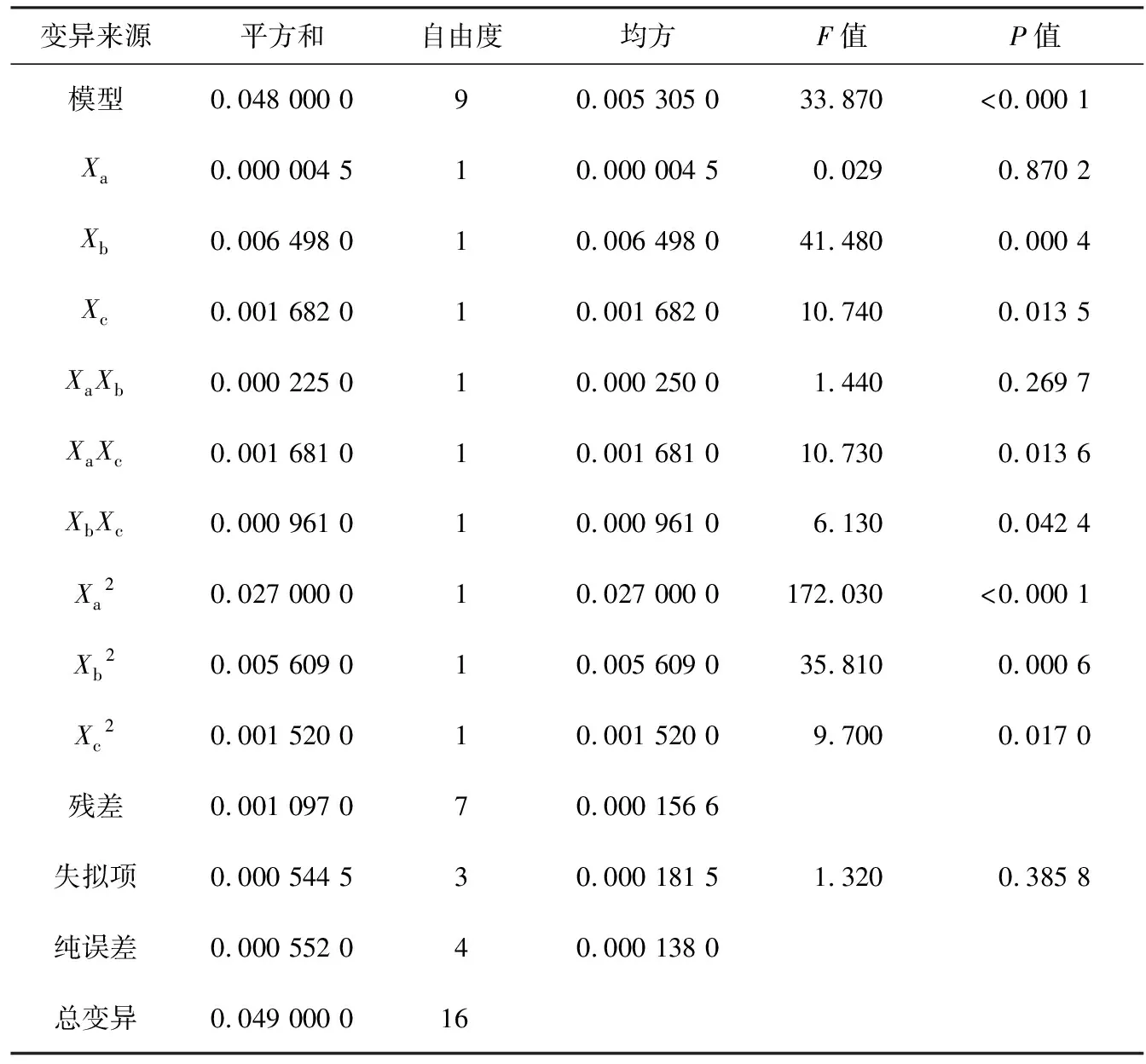
表3 回归方差分析
F值反映了单因素对山药素Ⅰ提取量的影响顺序:乙醇体积分数>超声时间>液料比.由于P(XaXc)和P(XbXc)都小于0.005,表明液料比和超声时间、乙醇体积分数和超声时间对山药素Ⅰ提取量具有显著的交互作用,液料比和乙醇体积分数间的交互作用不显著.
2.3 双因素间的交互影响作用分析
液料比和超声时间、乙醇体积分数和超声时间对铁棍山药山药素Ⅰ提取量具有显著的交互作用.
图4等高线反映了所考察双因素之间的交互作用情况.当其趋近于圆时,说明双因素之间的相互作用不显著,故图4(a)的液料比和乙醇体积分数的两因素相互作用较弱;当其接近椭圆时,相互作用显著,如图4(b)和(c).当曲线较为密布时,相互作用越明显,如图4(b)和(c).
从图4(b)可以看出,当液料比较低时,山药素Ⅰ提取量随着超声时间的增加而递增,当液料比较高时,提取量随着超声时间先增后减;当超声时间较短时,提取量随着液料比的增加略有增加,当超声时间较长时,提取量随着液料比的增加而增加.从图4(c)可知,在乙醇体积分数较低时,超声时间的增加导致提取量递减,在乙醇体积分数较高时,随着超声时间的增加提取量出现最大值;增加乙醇体积分数有利于增加提取量.

图4 交互影响显著的双因素等高线
综合来看,适当地增加超声时间和选择合适的液料比,或者适当地增加乙醇体积分数和选择合适的超声时间,均有利于提高山药素Ⅰ的提取量.在选择最佳工艺参数时,根据液料比45.7∶1(mL/g)、乙醇体积分数29.2%和超声时间63.3 min,此时山药素Ⅰ的理论提取量为0.643 4 mg/g.实际工艺参数调整为液料比46∶1、乙醇体积分数29%和超声时间63 min,3次验证试验得到山药素Ⅰ的平均提取量为 0.627 1 mg/g(RSD=1.61),略低于理论提取量2.53%.
3 结论
1)选取具有价格低廉优势的9-溴菲代替山药素Ⅰ作为标准品,建立了铁棍山药提取液中山药素Ⅰ的紫外分光光度分析方法,为探讨铁棍山药中山药素Ⅰ提取量的影响因素,优化提取工艺提供了依据.
2)在此基础上,选取液料比、乙醇体积分数和超声时间等3个对铁棍山药山药素Ⅰ提取量影响较大的因素进行响应面试验,建立了二次回归方程.方差分析和响应面分析表明,3因素及其2次项对提取量的影响顺序:乙醇体积分数>超声时间>液料比,其中,液料比和超声时间、乙醇体积分数和超声时间的二次交互作用显著.该模型的统计学意义显著,用于山药素Ⅰ提取工艺的优化较为合理,也为山药素Ⅰ的纯化、生物活性研究以及其余山药素类成分的开发提供了研究依据和研究基础.

