3种分子检测方法对肺结核的诊断价值比较*
彭利君,刘立宾,王静,方婷婷,蔡龙(浙江大学医学院附属杭州市胸科医院临床医学检验实验中心,杭州 310003)
结核分枝杆菌(Mycobacteriumtuberculosis,MTB)感染引起的结核病 (tuberculosis,TB)仍然是威胁全球人类健康的主要传染病之一[1]。肺部是临床最常见的TB发病部位,早期诊断对于传染控制、减缓疾病进展及改善患者预后至关重要。痰涂片镜检经济、易于操作,但其敏感性较低,且不能区分MTB和非结核分枝杆菌(non-tuberculous mycobacteria,NTM)感染。分枝杆菌培养敏感性较高,一直作为TB的金标准,但其检测周期长,不利于肺结核的快速诊断。随着分子诊断技术的进步,核酸扩增试验极大地促进了TB的诊断。痰是常用于诊断肺结核的样本。然而,一些活动性肺结核患者可能无法咳出痰,这被称为无痰或少痰的肺结核。研究表明,支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)较痰标本改善了肺结核的诊断[2-4]。
博奥结核/非结核分枝杆菌核酸检测(DNA-TB)、结核分枝杆菌RNA恒温扩增实时检测技术(simultaneous amplification and testing forMycobacteriumtuberculosis,SAT-TB)和Xpert MTB/RIF检测(Xpert)这3种分子检测方法在临床TB诊断中广泛运用,但这些方法在BALF样本中的诊断价值尚未得到全面评估。因此,本研究以分枝杆菌培养为金标准,旨在通过大样本量数据分析,评价DNA-TB、SAT-TB和Xpert 3种分子检测方法对BALF样本TB的诊断价值,为临床医生选择检测方法时提供依据。
1 材料和方法
1.1研究对象 收集2016年7月至2021年9月在浙江大学医学院附属杭州市胸科医院就诊并使用同一份BALF样本进行涂片、培养、DNA-TB、SAT-TB和Xpert 5项检测的9 617名门诊和住院患者的医疗记录,排除688名诊断不明确的患者,最终共纳入8 929名患者,其中5 357名(占60.0%)男性,3 572名(占40.0%)女性,年龄(59.9±19.6)岁。本研究经浙江大学医学院附属杭州市胸科医院人体研究伦理委员会批准[批准文件号:2021快审(42)号],免除患者知情同意。
1.2仪器及试剂 抗酸染色试剂(珠海贝索公司);Bactec MGIT 960液体培养仪及培养和药敏配套试剂(美国BD公司);Xpert实时荧光PCR检测仪及配套试剂(美国Cepheid公司);实时荧光定量检测仪(SLAN-96S,上海宏石公司);结核分枝杆菌核酸检测试剂盒(RNA恒温扩增法,上海仁度公司);结核/非结核分枝杆菌核酸检测试剂盒(PCR荧光探针法,博奥公司);Lowenstein-Jensen固体培养基(杭州创新公司);固体药敏及配套试剂(珠海贝索公司)。
1.3方法
1.3.1标本采集和处理 通过纤维支气管镜进行异常肺段灌洗以获得BALF标本,将标本分成五等份,每份1~3 mL,分别用于涂片、培养、DNA-TB、SAT-TB和Xpert检测。
1.3.2涂片 采用抗酸染色试剂对每份BALF样本行3张Ziehl-Neelsen抗酸染色镜检,其中1张涂片镜检阳性则为涂片阳性。MTB和NTM由于其菌体特性,涂片显示为抗酸染色阳性。
1.3.3培养及利福平的表型药敏检测 按试剂说明书操作,使用Lowenstein-Jensen固体培养基或液体培养基对BALF样本进行分枝杆菌培养和利福平药敏试验。固体培养在37 ℃温箱进行,液体培养使用BACTEC MGIT 960分枝杆菌培养仪。固体培养65 d未长出肉眼可见的菌落判为阴性,液体培养42 d仪器检测信号未达到阳性标准且人工复核阴性则判为阴性。阳性培养菌株经DNA-TB检测鉴定为MTB培养阳性,若鉴定为NTM则视为MTB培养阴性。固体或液体培养均阴性视为MTB培养阴性。利福平的表型药敏检测是将从BALF分离得到的MTB菌株在已知利福平浓度的固体或液体培养基中进行体外培养,观察其生长状况,同时与不加任何药物的对照管比较,若菌株在对照及药物培养管中均生长,为利福平耐药;若只在对照管中生长,则认为该菌株对利福平敏感。
1.3.4Xpert MTB/RIF 按试剂说明书操作,在1~2 mL未离心BALF中加入2倍体积的处理液,涡旋振荡15~30 s并室温放置15 min,取2 mL处理过的样本缓慢添加到Xpert实时荧光PCR检测仪反应盒中,然后将反应盒置于检测模块。2 h后系统可自动读出MTB检测结果与利福平耐药情况。实验结果显示MTB检出极低、检出低、检出中等和检出高为阳性,MTB未检出为阴性。
1.3.5DNA-TB检测 按试剂说明书进行操作,样品预处理并提取DNA,用实时荧光定量PCR仪检测MTB特异性多拷贝重复插入序列IS6110和分枝杆菌属共有基因hsp65基因。若基因的扩增曲线呈S型,且Ct值<40,判定为阳性,否则为阴性。hsp65阳性IS6110基因阳性为MTB阳性,hsp65阳性IS6110基因阴性为NTM阳性。hsp65阴性为MTB和NTM均阴性。
1.3.6SAT-TB检测 按照说明书操作。用实时荧光定量检测仪(SLAN-96S)扩增MTB的16S rRNA基因,根据Ct值判断结果:Ct≤35为阳性;35
1.4数据处理和统计分析 利用Python语言和Pandas包进行数据处理,采用wilson计算两侧95%置信区间(CI)。敏感性、特异性、阳性预测值(positive predictive value,PPV)、阴性预测值(negative predictive value,NPV)使用sklearn包的metrics.confusion_matrix函数计算。配对数据(敏感性、特异性)通过McNemar检验进行检验,使用statsmodels包stats.contingency_tables.mcnemar函数计算。PPV和NPV比较采用χ2检验,使用scipy包stats.chi2_contingency函数计算。以P<0.05为差异有统计学意义。几种检测方法与培养结果一致性分析采用Kappa检验,kappa≥0.75说明一致性较好,kappa<0.4说明一致性较差,0.4≤kappa<0.75说明一致性一般,使用sklearn包 metrics.cohen_kappa_score函数计算。
2 结果
2.1纳入数据的处理流程和结果 按图1流程纳入患者资料进行分析,在8 929份样本中,涂片、MTB培养、DNA-TB、SAT-TB和Xpert结果阳性率分别为10.5%(941/8 929)、22.6%(2 019/8 929)、32.5%(2 902/8 929)、27.1%(2 419/8 929)和34.1%(3 048/8 929)。
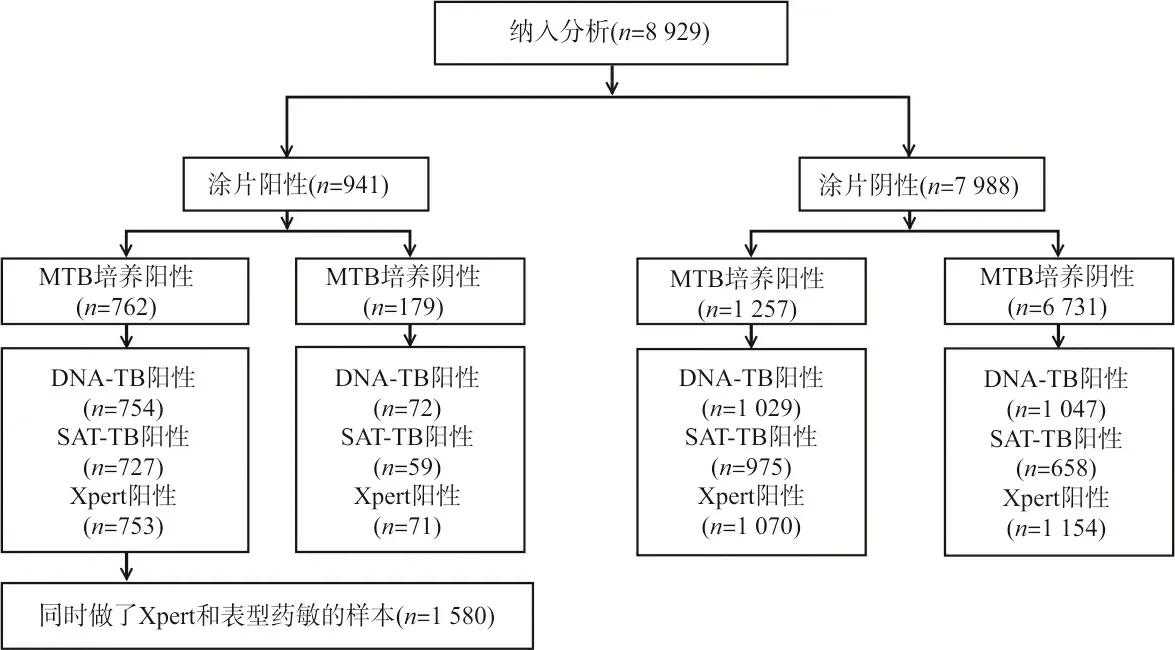
图1 参与研究的患者诊断分类流程
2.2各方法学的诊断效能比较 以MTB培养为金标准,计算涂片、DNA-TB、SAT-TB、Xpert的敏感性、特异性、PPV和NPV,并根据涂片阳性和阴性对样本分别进行计算和比较,结果见表1、2。涂片的敏感性和NPV明显低于3种分子检测(P<0.05),而特异性和PPV明显高于3种分子检测(P<0.05)。一致性分析发现,涂片与3种分子检测方法的一致性均较差(kappa<0.4)。在总体组3种分子检测的敏感性范围为84.3%~90.3%,Xpert最优;特异性范围为82.3%~89.6%,SAT-TB最优。敏感性和特异性在3种分子检测方法两两之间差异均有统计学意义(P<0.05)。PPV范围为59.8%~70.4%,SAT-TB最优。NPV范围为95.1%~96.7%,Xpert最优。PPV和NPV在DNA-TB与Xpert两者之间差异无统计学意义(P>0.05),其余2种检测方法之间差异均有统计学意义(P<0.05)。根据涂片结果进行分类比较发现:涂片阳性组的3种分子检测的敏感性和PPV分别在95.0%和91.0%以上,且检测方法之间的一致性均较好(kappa>0.75);但所有检测方法在涂片阴性组的敏感性(77.6%~85.1%)和PPV(48.1%~59.7%)明显低于涂片阳性组。涂片阴性组Xpert的敏感性(85.1%)显著高于DNA-TB(81.9%)和SAT-TB(77.6%)(P<0.05),且与DNA-TB和SAT-TB一致性表现均一般(kappa=0.680、0.602)。涂片阴性组DNA-TB的敏感性显著高于SAT-TB(P<0.05),且两者的一致性表现一般(kappa=0.695)。
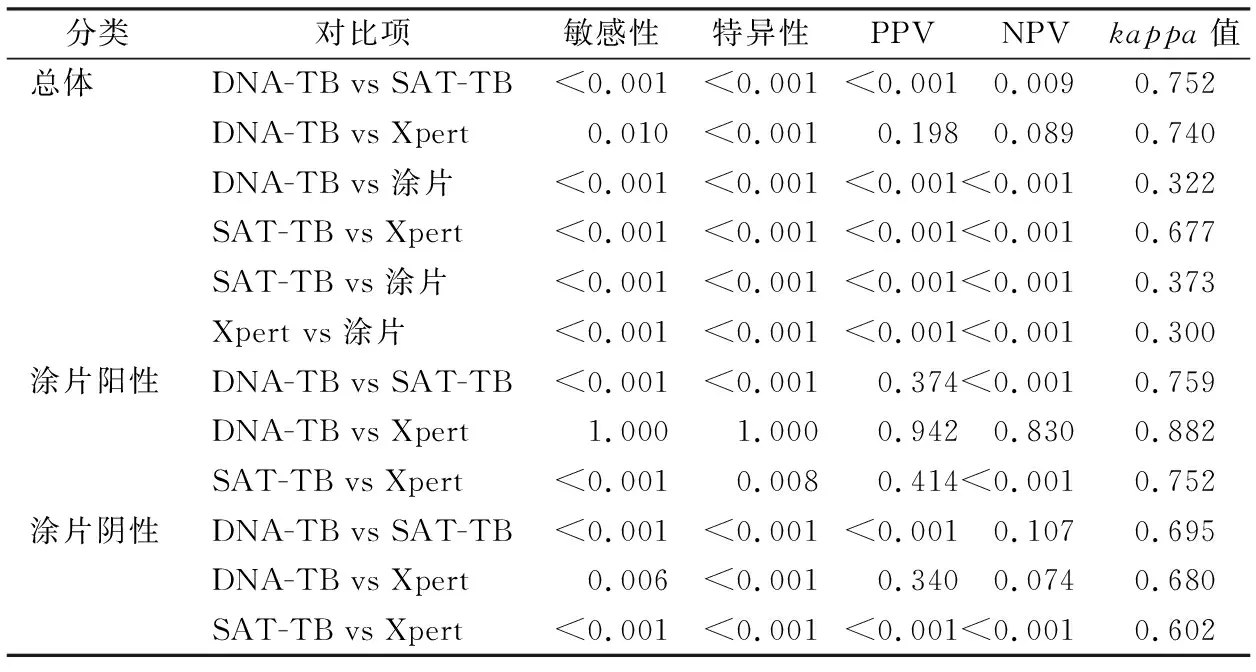
表2 涂片、DNA-TB、SAT-TB、 Xpert检测结核的诊断效能比较
2.3评估Xpert检测利福平耐药的诊断效能 表型药敏结果显示,利福平耐药率为10.4%(165/1 580)。以表型药敏为金标准,Xpert对利福平耐药的诊断敏感性为89.7%,特异性为96.9%,PPV为77.1%,NPV为98.8%。两者关于利福平耐药的一致性分析较好(kappa=0.808),见表3。

表3 Xpert MTB/RIF和表型药敏关于利福平药敏的一致性
3 讨论
DNA-TB是我国开发的一种结核DNA分子诊断技术,可同时检测 MTB和NTM感染。SAT-TB是以MTB特异的16S rRNA为靶标,可快速准确地检测存活的MTB。Xpert检测是一种全自动的实时PCR检测,可以在2 h内同时检测出MTB和利福平耐药情况,优势是操作简单,结果可靠,同时检测利福平耐药情况以指导后续治疗,缺点是成本较高。本研究表明,DNA-TB、SAT-TB、Xpert检测在BALF样本中对TB的诊断的敏感性分别为88.3%、84.3%、90.3%,明显高于在痰液样本中的诊断敏感性[5],验证了BALF是较痰液更好的肺结核检测样本。涂片阳性组的3种分子检测的敏感性和PPV分别在95.0%和91.0%以上,3种检测方法之间的较好的一致性(kappa>0.75)。但3种分子检测方法在涂片阴性组的敏感性和PPV明显低于涂片阳性组。从本研究结果来看,涂片阳性率仅为10.5%,剩余89.5%的涂片阴性患者的诊断更加需要重视。Xpert检测MTB的敏感性高于DNA-TB和SAT-TB,在涂片阴性组更为明显(P<0.05),考虑到患者既然已经通过艰难的支气管镜检查获得BALF样本,此时使用Xpert检测的收益更大。
SAT-TB的敏感性无论在总体组还是涂片阳性、涂片阴性组均低于DNA-TB和Xpert,且差异有统计学意义。SAT-TB检测的是16S rRNA,RNA在进行消化和提取的过程中更容易发生降解,这可能是导致本研究SAT-TB敏感性低的主要原因。16S rRNA的检出可代表存活的MTB,由于本研究以培养为金标准,故SAT-TB的PPV大于DNA-TB和Xpert。Xpert应用了半巢式荧光定量PCR技术,最低检出限低至131 CFU/mL[6]。DNA-TB以结核分枝杆菌复合群特有的IS6110为靶基因,该基因属于插入序列家族,在基因组可重复10~25次,提高了检测敏感性,但最低的检出限高于Xpert。在浓度较高的核酸样本中,2种方法差异不大。这能很好解释涂片阳性组两者完全无差异且一致性很好,而在涂片阴性组敏感性差异有统计学意义且一致性一般。因为涂片阳性的样本的菌量较多,核酸浓度也高。
Xpert利用5个荧光探针检测RNA聚合酶rpoB基因的81 bp耐药决定区的突变来检测利福平耐药[7]。本研究Xpert检测的利福平耐药和表型药敏的结果一致性较好(kappa=0.808),敏感性和特异性分别为89.7%和96.9%,与刘立宾等[7]的研究结果相一致。引起2种方法利福平药敏检测结果不一致的原因可能为:存在“有争议的”rpoB突变或rpoB基因发生沉默突变,这些突变并不会导致表型耐药或由rpoB核心区之外区域其他基因发生突变导致出现表型耐药[8-9]。此外,Xpert在检测细菌载量非常低的标本中,高比率的E探针杂交失败也会导致假阳性结果[10]。然而,由于本研究属于回顾性研究,无法通过DNA测序进一步验证。
本研究分析了大量BALF样本的检测结果,减少了标本的异质性,增加了结果的可靠性。但本研究对研究结果的概括方面存在一些局限性。首先,这是一项回顾性研究,患者选择可能存在偏差。其次,由于本研究模型是以培养作为金标准,计算各种方法学的诊断性能,存在有的样本培养阴性而将其判定为结核阴性,但是经过分子诊断检出阳性的情况,导致本研究的3种分子诊断方法的特异性和PPV被低估,选择临床诊断作为金标准较培养可能更为合理。
在BALF样本中3种分子检测方法对结核病的诊断敏感性均优于涂片。与DNA-TB和SAT-TB检测相比,Xpert检测BALF样本具有高敏感性、周转时间短、能同时检测利福平耐药情况、操作简单、对实验室要求低等优点。尤其是在涂片阴性的BALF样本中采用Xpert 检测对无痰、少痰或乏菌结核患者更有价值,在临床值得推广。

