半胱氨酸蛋白酶抑制剂C重组蛋白的制备*
张超,李小鹏,张传宝(北京医院 国家老年医学中心 国家卫生健康委临床检验中心 中国医学科学院老年医学研究院,北京 100730)
半胱氨酸蛋白酶抑制剂C(cystatin C,CysC)亦称作γ-微量蛋白,广泛存在于各组织细胞中。CysC由122个氨基酸残基组成,是一种低分子量、碱性非糖化蛋白质,由20号染色体短臂上的管家基因CST3编码,产生速率恒定[1]。循环中的CysC仅经肾小球滤过,并在近曲小管被重吸收,而后被完全代谢分解,因此,其血中浓度由肾小球滤过率(glomeruar filtration rate,GFR)决定,而不受诸如性别、年龄、体重、炎症等外在因素的影响,故而是一种反映GFR变化的理想内源性标志物[2]。尽管已有血清尿素(Urea)、肌酐(creatinine,Cr)等反映肾功能的指标,但研究表明,CysC是较血清Urea、Cr更灵敏和特异的指标[3]。正常情况下,CysC在血中的浓度为0.51~1.09 mg/L。当肾功能受损时,CysC在血液中的浓度随GFR变化而变化[4-5]。
CysC当前没有应用于临床检验的标准物质,而用于室间质量评价(EQA)计划的质控品需要购买。标准物质对于临床检验的意义是能够让测量“有源可溯”;EQA则是通过对质控品回报数据的统计、分析,发现临床实验室检测存在的不足,提高检测的准确性;而这些都是实现临床检验结果准确、可比、互认的前提。然而,传统标准物质和质控品制备原料主要依赖血清,其量产、种类、浓度水平、稳定性及来源均受到极大限制。近年来基因工程蛋白质重组技术迅猛发展,重组蛋白在药物研发、疫苗研发、蛋白质晶体结构解析、蛋白质功能研究等领域发挥重要作用。故本研究拟利用基因工程蛋白质重组技术,体外表达纯化CysC,为制备临床可用的CysC标准物质和质控品奠定物质基础。
1 材料与方法
1.1材料 DH5α克隆感受态及BL21表达感受态购自北京擎科公司;质粒pET-28a(+)由清华大学结构生物学高精尖创新中心惠赠。限制性核酸内切酶NcoⅠ、XhoⅠ、MluⅠ以及T4 DNA连接酶购自NEB公司。质粒提取试剂盒及DNA凝胶回收试剂盒购自北京天根公司。LB培养基、卡那霉素、异丙基硫代半乳糖苷(IPTG)、咪唑等均购自Sigma公司。CysC检测试剂盒购自北京万泰公司。DNA电泳仪购自北京市六一仪器厂;蛋白质电泳仪购自美国Bio-Rad公司;PCR仪购自美国ABI公司;Ni-NTA镍离子亲和树脂购自美国Qiagen公司;镍离子亲和层析柱购自上海生工公司;超声细胞破碎仪购自上海力辰邦西公司;7180全自动生化分析仪购自日立公司。
1.2CysC基因合成 从NCBI数据库检索获得人CysC编码序列(ID:1471),用Codon Adaptation Tool依据大肠杆菌密码子偏好进行优化,优化后序列委托擎科公司基因合成。因CysC有一段信号肽序列,为避免切割信号肽时将标签切除,在本研究中将这段78 bp的信号肽序列删除。
1.3原核表达载体构建 基因合成时在N端增加NcoⅠ酶切位点,C端增加XhoⅠ酶切位点。将双酶切片段插入pET-28a(+)载体,T4 DNA连接酶连接,并将连接产物转化E.coliDH5α感受态,利用Kan+抗性筛选,通过菌落PCR及酶切对阳性克隆进行鉴定,初步鉴定成功的菌液提取得到6×His-CysC-pET质粒,进一步测序鉴定。
1.4重组CysC表达 将构建好的6×His-CysC-pET转化至大肠杆菌E.coliBL21感受态,挑取单菌落接种至5 mL LB培养基37 ℃摇床培养过夜。以1∶250体积比将菌液接种至250 mL LB培养基,37 ℃、200 r/min培养至A600 nm=0.6~0.8,向培养基中加入终浓度为0.5 mmol/L的IPTG,37 ℃ 160 r/min诱导6 h。所有诱导后的菌液5 000×g离心5 min收集菌体,菌体重悬于20 mL蛋白质裂解液(50 mmol/L Na3PO4,pH 8.0,150 mmol/L NaCl)中,冰浴条件下用超声细胞破碎仪超声15 min(超声2 s,间隔3 s)破碎裂解菌体,裂解产物5 000×g、4 ℃离心15 min,分离上清液与沉淀。
1.5重组CysC表达条件优化 将6×His-CysC-pET表达质粒转化入大肠杆菌E.coliBL21感受态。先选取2个常用温度16、37 ℃和常用IPTG浓度0.5 mmol/L,将菌体超声破碎后离心取上清液,再将沉淀溶于高盐裂解液离心后取上清液。上清液及沉淀与镍柱Ni-NTA亲和层析,20 mmol/L咪唑清洗非特异性结合,250 mmol/L咪唑洗脱的蛋白液经SDS-PAGE电泳。进一步在0.5 mmol/L IPTG 180 r/min前提下,16、20、30、37 ℃条件下诱导6 h;确定最佳诱导温度后,在0.1、0.2、0.4、0.5 mmol/L的IPTG,37 ℃ 160 r/min的条件下诱导6 h,以获得重组CysC诱导表达最优的温度与IPTG浓度。
1.6重组CysC纯化 将裂解上清液与2 mL Ni-NTA亲和树脂在4 ℃充分混匀2 h,用20 mmol/L咪唑清洗非特异性结合,最后用250 mmol/L咪唑洗脱重组人6×His-CysC蛋白。
1.7重组CysC检测 用日立7180全自动生化分析仪及CysC检测试剂盒(万泰公司)检测重组CysC。
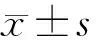
2 结果
2.1构建CysC原核表达载体CysC基因插入于NcoⅠ和XhoⅠ两酶切位点之间,并在N端融合了6×His标签,用于CysC蛋白的亲和纯化。经硫酸卡那霉素筛选的单克隆菌落,经摇菌后提纯质粒用XhoⅠ和MluⅠ酶切后得到1 100 bp左右的片段(图1),证实插入成功。将质粒送测序鉴定以证实基因序列的正确性,经DNAMAN软件对比编码CysC蛋白的碱基序列完全正确,表明6×His-CysC-pET原核表达质粒构建成功。

图1 原核表达质粒6×His-CysC-pET酶切后的琼脂糖电泳结果
2.2检测6×His-CysC-pET28a(+)是否表达 如图2所示,在亲和纯化产物中清晰可见相对分子质量约15 000电泳条带,大小与预期的6×His-CysC-pET相符,表明重组CysC蛋白诱导表达成功。同时可以看到,蛋白质表达既有可溶蛋白质也有沉淀蛋白质,当温度升高时(37 ℃)可溶蛋白质减少,包涵体蛋白质增加,可能温度升高蛋白质合成加速,故而大部分蛋白质来不及准确折叠而形成包涵体蛋白质,故在低温下诱导表达较好,且表达量也较高。因包涵体蛋白质在纯化时为变性纯化,需要复性,考虑到蛋白质的结构和功能,选择后续纯化上清液中的可溶蛋白。
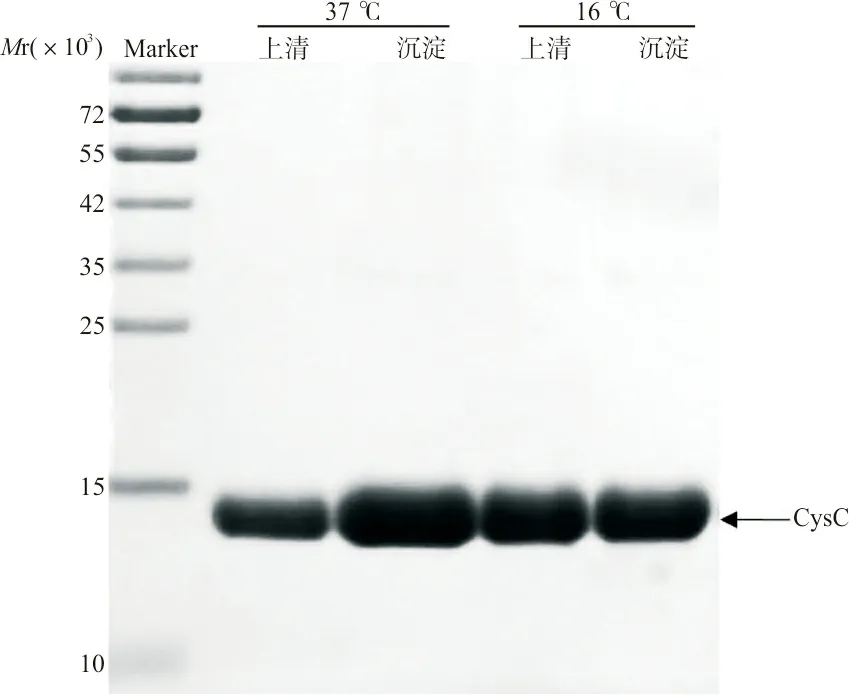
图2 不同条件下上清液和沉淀中CysC的纯化产物
2.3重组6×His-CysC-pET28a(+)诱导表达条件优化 最佳诱导温度和IPTG浓度结果见图3。在16、20、30、37 ℃条件下,160 r/min诱导6 h,CysC浓度变化不大,但在20 ℃时相对表达最高,故最佳诱导温度取20 ℃;在0.1、0.2、0.4、0.5 mmol/L IPTG,20 ℃ 160 r/min的条件下诱导6 h,IPTG浓度为0.1和0.2 mmol/L时,CysC表达量最高,考虑到IPTG浓度越高毒性也越大,故选取0.1 mmol/L为IPTG诱导的最优浓度。

图3 不同诱导条件下裂解产物上清纯化后SDS-PAGE电泳结果
2.4重组CysC稀释后与稀释倍数间呈现线性关系 将从250 mL菌液中纯化的3 mL CysC蛋白样品原液,用ddH2O稀释40、50、100、200、400等不同倍数,在日立7180全自动生化分析仪,用常规胶乳免疫比浊法分别测定不同稀释浓度下的数值分别为60.51、47.80、21.30、10.56、4.41 mg/L。以稀释倍数的倒数为横坐标,测定浓度值为纵坐标,绘制标准曲线,并添加回归方程计算R2值。如图4所示,CysC纯品蛋白稀释倍数与测点值之间呈现线性关系,提示纯化蛋白质不仅能够被临床检测,且符合线性关系。
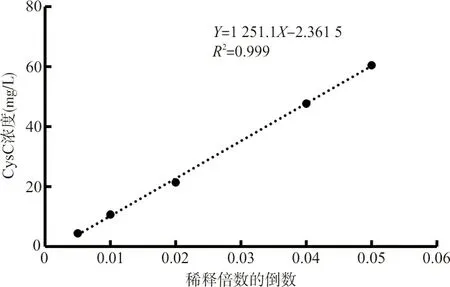
图4 稀释倍数与测定值之间线性关系
3 讨论
CysC在肾功能评价方面较之Cr具有无可比拟的优势,研究证实CysC是优于Cr的内源性标记物。Cr清除率测定受体表面积、肌肉量等因素影响,对于肌肉含量较少的婴幼儿来说,Cr很难准确监测GFR的轻微变化,而CysC在出生数月后水平即可与成人相当且血浆浓度稳定,故CysC是评价婴幼儿GFR更为理想的标志物。还有研究认为,CysC在肾移植术后对检测肾小球滤过率而言,比Cr和Cr清除率都敏感,可以快速诊断出急性排斥反应或药物治疗可能造成的肾损害[6-7]。CysC不仅应用于肾脏功能的临床诊断,在糖尿病、心血管疾病、肝硬化、妊娠高血压、先兆子痫等临床诊疗中均有重要意义。CysC检出糖尿病肾病的特异性可达100%[8];当Cr还处于正常水平时CysC就可提示GFR轻度下降,而GFR轻度下降与血同型半胱氨酸(Hcy)之间存在显著相关,而血Hcy是冠状动脉疾病的独立因素[9-10];肝硬化伴肾功能损伤时血浆体积明显降低,因此早期发现患者肾功能受累极其重要,可防止肝肾综合征的发生[11]。
如此重要的临床诊疗指标必然要求其检测的准确性,然而截至目前CysC却并没有标准物质,没有标准物质就意味着全国成千上百的临床实验室使用不同仪器、方法、试剂所检测的数值无法溯源到同一个源头。传统标准物质和质控品的原料来源于人血浆,面临取材困难、成本高昂、伦理等诸多问题,体外纯化CysC则可很好地避开这些问题,获得CysC纯品蛋白且能够被临床仪器检测,是开发标准物质和质控品的前提。结果证实所构建的去掉信号肽编码序列的CysC能够顺利被临床检测仪器所检出,确定了重组CysC的代表性序列。体外纯化的CysC蛋白即便在稀释400倍时浓度仍然可达到4.41 mg/L,远高于CysC在血中的正常浓度。1次摇菌250 mL约可纯化3 mL CysC原液,稀释后即可获得浓度为5~20 mL/L、规格为1 mL的质控品300~1 200支。由此可见,借助基因工程技术确实可快速、高效生产标准物质和质控品。从实际应用和经济效益出发,以目前开展室间质量评价计划的CysC项目为例,2021年参加实验室数量为1 716家,并且数量逐年增长,按现行购买价格每年成本费用接近百万。本项研究不但可以节省开支,降低全国EQA成本,同时还可提高对临床实验室检测质量的管理水平,缩小实验室之间的检测偏倚,提高室间质量评价结果的准确性,也为逐步推行实验室检测结果准确、可比奠定基础。
后续将对CysC纯化样品按国际标准要求进行均匀性、稳定性、基质效应及互通性的评价[12-16]。采取多中心联合定值方式,用主流常规分析方法为所纯化的CysC蛋白定值,接着将制备的候选标准物质和质控品在短时间内送达多个临床实验室进行适用性评价,收集回报结果,计算不确定度。
——一道江苏高考题的奥秘解读和拓展

