吲哚烯类受体对铜离子的高选择性识别研究
王宝娟,薛 静,徐淑明,魏 薇
(甘肃农业大学理学院,甘肃 兰州 730070)
在生物体内的代谢过程中,金属阳离子起着特殊的作用,它在细胞膜内外的传输是在与相应蛋白结合的控制下完成的[1]。从最初的废水中重金属离子的检测[2],到主族金属离子的作用研究[3],阳离子识别不断发展进步,受体分子的选择更加广泛,识别机制的研究也逐渐成熟,发展出了大量具有明显选择性和反应活性的金属配合物。
过渡金属阳离子多数都存在空轨道,可以接收来自外部的电子。因此,含有孤对电子的基团是过渡金属离子良好的配体。铜是人体必需的微量金属元素之一,在人体中的含量仅次于铁和锌。铜与蛋白质结合形成铜蛋白或含铜酶,参与生物体内电子转移、氧的输送和多种有机底物(胺、多酚和糖等)的生物氧化过程[4-5],另外还有调节体内铁的吸收、促进血红蛋白合成以及形成皮肤、头发和眼睛的色素等功能。因此,设计合成具有高选择性、高灵敏度的铜离子受体倍受关注。顺磁性的铜离子还是一种高效的荧光淬灭剂,通过电子转移或能量转移方式淬灭或增强荧光[6-8]。近年来,基于荧光法识别铜离子的研究已有较多报道[9-11],且多集中在有机介质中,但基于比色法识别铜离子的报道为数不多,且含水体系中基于比色法识别Cu(Ⅱ)的文献更少。鉴于此,研究设计合成了2位连接三吲哚烯受体化合物,其分子中含有不饱和的共轭双键基团,考察其对铜离子的识别与传感性能,初步揭示了受体与金属离子的识别作用机制。
1 实验方法
1.1 实验仪器
100 mL圆底烧瓶(蜀牛公司),磁力搅拌器(FCH202,广州市深华生物技术有限公司),布氏漏斗(150 mm,高德),抽滤瓶(250 mL,高德),定性滤纸(7 cm,广州诚仪诺仪器),紫外-可见分光光度计(Lambda-35型,1 cm石英液池,Perkin-Elmer公司),精密pH计(PHS-3C型,上海日岛科学仪器有限公司),试管(外径10 mm,长度100 mm),微量进样器(15 μL,上海高鸽)。
1.2 实验试剂
3-甲基吲哚(分析纯),无水甲醇(分析纯),原甲酸三乙酯(分析纯),浓硫酸(分析纯),丙酮(分析纯),浓盐酸(分析纯),亚硝酸钠(分析纯),60%高氯酸水溶液(质量分数),无水乙醇(分析纯),乙腈(分析纯),HEPES-NaOH缓冲溶液(pH=7),九水合硝酸铁(分析纯)、四水合硝酸镉(分析纯)、六水合硝酸钴(分析纯)、六水合硝酸锌(分析纯)、九水合硝酸铬(分析纯)、硝酸铅(分析纯)、三水合硝酸铜(分析纯)、1/2 水合硝酸汞(分析纯)、硝酸银(分析纯)、八水合硝酸镍(分析纯)、x水合高氯酸亚铁(分析纯)。
1.3 2位连接三吲哚烯受体B1的合成与表征
称取一定量的3-甲基吲哚,用20 mL无水甲醇溶解在100 mL圆底烧瓶中,加入1/3摩尔量的原甲酸三乙酯,再加入0.5 mL浓硫酸,室温下搅拌反应3 h,有白色沉淀生成,抽滤,干燥,用无水甲醇重结晶得到中间体2位连接三吲哚烷A1。中间体2位连接三吲哚烷A1的合成路线如图1所示。

图1 2位三吲哚烷A1的合成路线
称取100 mg的2位连接三吲哚烷A1,用50 mL丙酮溶解,加入5 mL水和0.5 mL浓盐酸。称取19 mg亚硝酸钠,用10 mL水溶解,缓慢滴加上述A1的丙酮溶液,滴加时间约持续15 min。滴加完毕后反应5 min,再加0.5 mL 60%的高氯酸水溶液,室温下搅拌反应1 h。旋转蒸发除去溶剂丙酮,有黑蓝色沉淀生成,抽滤,用水洗涤3次,再用无水乙醇小心洗涤3次,得到产物2位连接三吲哚烯B1。产物2位连接三吲哚烯B1的合成路线如图2所示。
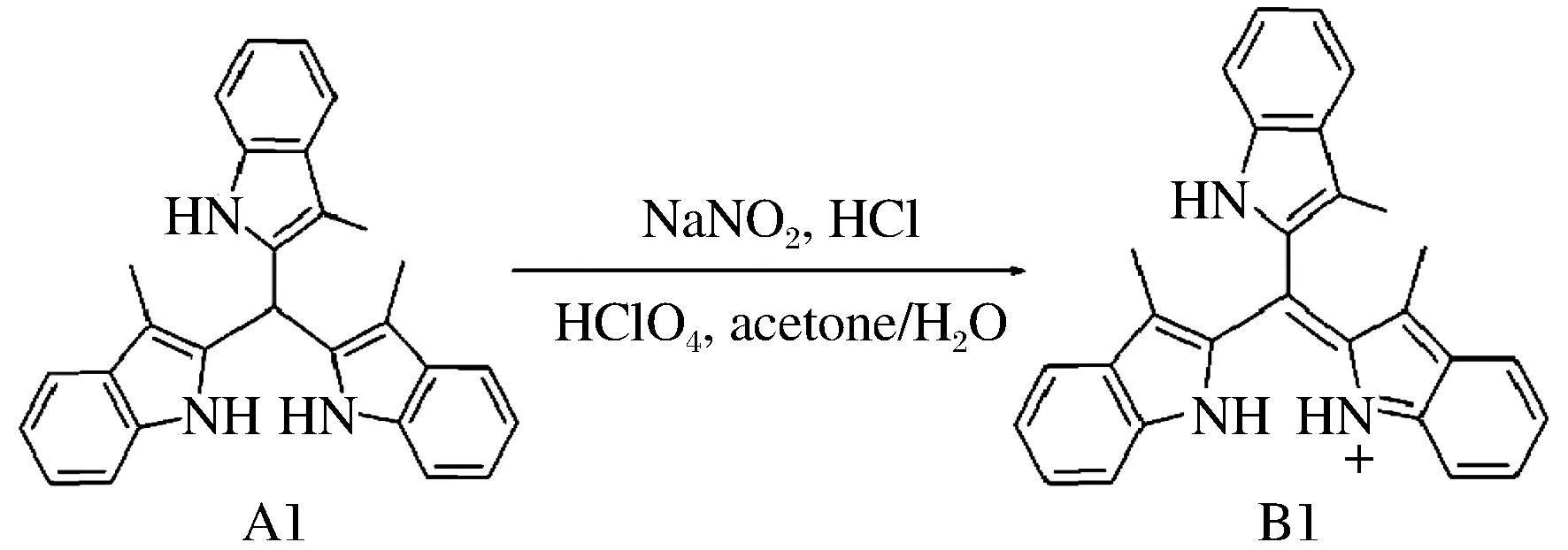
图2 2位三吲哚烯B1的合成路线
产物B1以高氯酸盐的形式存在,为墨绿色晶体。通过计算可得产物B1的产率为90%,通过显微熔点仪测得产物B1的熔点为247~249 ℃。通过紫外-可见分光光度计测得产物B1的摩尔吸光系数ε为10 566 M-1·cm-1(最大吸收波长为580 nm)。通过元素分析仪测得产物B1的主要元素含量为:C%=67.32%,H%=4.79%,N%=8.42%。产物B1的主要元素含量计算值为:C%=66.99%,H%=4.82%,N%=8.37%。通过质谱仪测得产物B1的质谱数据为:m/z402.5 ([M+H]+)。通过核磁共振仪测得产物B1的核磁共振氢谱数据为:1H NMR (DMSO-d6,400 MHz):10.81 (s,2H,N-H),7.42 (d,3H,J=8 Hz,Ar-H),7.30 (d,3H,J=8 Hz,Ar-H),6.98 (m,6H,Ar-H),2.12 (s,6H,Me-H),2.07 (s,3H,Me-H)。通过傅里叶变换红外光谱仪测得产物B1的红外谱图出峰位置为:3 612,3 283,3 056,2 946,1 702,1 610,1 519,1 425,1 382,1 115,1 027,924,882,751(以KBr压片)。
1.4 受体的金属阳离子识别测定
受体B1溶液的配制:称量0.002 g的受体B1于10 mL试管中,以乙腈稀释定容至5 mL,配制成5.0×10-4M的溶液,待用。
金属离子溶液的配制:称量相应质量的金属盐(硝酸盐或高氯酸盐)至15 mL试管中,用pH值为7.0的HEPES-NaOH缓冲溶液溶解定容(由于溶解度的问题,Fe(Ⅱ)使用高氯酸盐),配成金属离子浓度为1.0×10-2M的中性缓冲水溶液。
乙腈-水(V乙腈∶V水=1∶1)中性缓冲溶液的混合体系中受体B1与不同金属阳离子作用的紫外测定:用微量进样器分别量取0.8 mL受体B1的乙腈溶液(5.0×10-5M)于一系列试管中。用微量进样器分别量取Fe(Ⅲ)、Cd(Ⅱ)、Co(Ⅱ)、Zn(Ⅱ)、Cr(Ⅲ)、Pb(Ⅱ)、Cu(Ⅱ)、Hg(Ⅱ)、Ag(Ⅰ)、Ni(Ⅱ)、Fe(Ⅱ)等金属阳离子的中性缓冲水溶液(1.0×10-2M)各4 μL,用HEPES-NaOH缓冲溶液稀释至2 mL,再用乙腈定容至4 mL。定容后,受体B1的溶液浓度为1.0×10-5M,各种金属阳离子浓度为受体浓度的1倍,溶液为乙腈-水(V乙腈∶V水=1∶1)中性缓冲溶液的混合体系,混合均匀后于室温下测其紫外-可见吸收光谱(乙腈-水(V乙腈∶V水=1∶1)中性缓冲溶液的混合溶剂作参比)。
乙腈-水(V乙腈∶V水=1∶1)中性缓冲溶液的混合体系中受体B1与Cu(Ⅱ)作用的紫外滴定实验:分别移取3 mL受体B1的乙腈-水(V乙腈∶V水=1∶1)中性缓冲混合溶液(1.0×10-5M)于1 cm石英比色液池中。用微量进样器分别加入不同体积的Cu(Ⅱ)的中性缓冲水溶液(1.0×10-2M),混合均匀后,得到受体B1浓度恒定(1.0×10-5M),Cu(Ⅱ)浓度逐渐增大的乙腈-水(V乙腈∶V水=1∶1)中性缓冲溶液的混合体系,于室温下测其紫外-可见吸收光谱(乙腈-水(V乙腈∶V水=1∶1)中性缓冲溶液的混合溶剂作参比)。
2 结果讨论
2.1 不同金属阳离子的识别
受体B1除了具有比色识别阴离子的性能,还具有对某些金属阳离子的比色识别作用,结果如图3所示。由图3可知,受体B1的乙腈-水(V乙腈∶V水=1∶1)中性缓冲溶液本身在500~600 nm处有一个较强的吸收谱带。当加入1倍当量的各种金属阳离子时,仅Cu(Ⅱ)引起了体系紫外吸收光谱和溶液颜色的明显变化,受体B1在500~600 nm处的吸收谱带明显减弱,而在较短波数下的362 nm和453 nm处出现2个新的吸收峰,同时溶液的颜色由蓝紫色变成黄色。加入其他金属阳离子(Fe(Ⅲ)、Cd(Ⅱ)、Co(Ⅱ)、Cr(Ⅲ)、Zn(Ⅱ)、Pb(Ⅱ)、Hg(Ⅱ)、Ag(Ⅰ)、Ni(Ⅱ)、Fe(Ⅱ))时,没有出现明显的溶液颜色和光谱特征变化。

图3 受体B1的乙腈-水(V乙腈∶V水=1∶1)中性缓冲溶液中加入不同金属阳离子的吸收光谱(1.0×10-5 M)和颜色变化(5.0×10-5 M)
2.2 受体与铜离子作用的紫外滴定
乙腈-水(V乙腈∶V水=1∶1)中性缓冲溶液中B1(1.0×10-5M)与Cu(Ⅱ)作用的紫外滴定光谱如图4所示。由图4可见,受体分子B1中逐渐加入Cu(Ⅱ)时,在500~600 nm处的吸收谱带逐渐减弱直至完全消失,在362 nm和442 nm处出现2组逐渐增强的新吸收峰,同时可明显观察到在458 nm处有1个等吸收点。

图4 乙腈-水(V乙腈∶V水=1∶1)中性缓冲溶液中B1(1.0×10-5 M)与Cu(Ⅱ)作用的紫外滴定光谱
实验结果表明,受体B1对Cu(Ⅱ)不仅具有较高的比色识别选择性,而且还具有较高的灵敏性,能够快速与Cu(Ⅱ)反应。在紫外滴定实验中发现,大约加入2.8倍当量的Cu(Ⅱ)就可使受体B1在500~600 nm处的吸收峰降至最低,达到滴定饱和。因此,受体B1对Cu(Ⅱ)快速响应的性质为Cu(Ⅱ)的定量检测提供了有利条件。利用Hildebrand-Benesi方程[12]对光谱滴定数据进行拟合,呈现良好的线性关系(如图4中左上角插图),说明受体B1与Cu(Ⅱ)形成1∶1的配合物。由线性拟合得到直线方程为
y=6.440 28+0.004 5x,
可以计算出受体B1与Cu(Ⅱ)作用的结合常数K=1 431.2 M-1(R=0.998 5)。
由于受体B1分子为三吲哚烯不饱和共价键,在激发态时具有分子内电荷转移(ICT)的特性[13],在乙腈-水(V乙腈∶V水=1∶1)中性缓冲溶液体系中,Cu(Ⅱ)与受体分子形成多氢键化合物,使溶液颜色由蓝紫色变为黄色,吸收峰发生蓝移(Δλ=220 nm)。由于加入Cu(Ⅱ)可使体系的颜色发生明显变化,因此可裸眼检测到Cu(Ⅱ)的存在。
3 结论
研究设计合成了2位连接三吲哚烯类受体的金属阳离子识别性能,该受体分子在乙腈-水(V乙腈∶V水=1∶1)中性缓冲溶液体系中能高选择性的比色识别Cu(Ⅱ),且对Cu(Ⅱ)可快速响应,初步推测受体对Cu(Ⅱ)的比色识别可能涉及三吲哚烯不饱和共价键的分子内电荷转移特性,使溶液体系的颜色发生明显变化,实现了裸眼检测Cu(Ⅱ)。

