miRNA参与植物多酚改善脂代谢紊乱作用的研究进展
秦 虹,宋子羽,郑温雅
(中南大学湘雅公共卫生学院营养与食品卫生学教研室,湖南 长沙 410078)
脂代谢包括甘油三酯和胆固醇等脂类的摄取、转运、生物合成和降解,脂代谢紊乱可导致血脂异常、脂质异位沉积及相关代谢疾病,如肥胖、非酒精性脂肪肝等。通过调节脂代谢紊乱是预防或延缓代谢性疾病发生发展的有效策略。microRNA(miRNA)与脂代谢关系密切。miRNA是19~22个核苷酸大小的短链RNA分子,在脂质稳态的正常维持中至关重要,其异常表达与代谢性疾病的病理机制有着紧密联系。目前多种天然植物多酚类药物单体被研究发现有降脂、降糖、抗炎、抗氧化等功能,可以通过多种途径参与脂代谢的调节,其作用已越来越受到关注。植物多酚对脂代谢相关miRNA是否发挥调控作用的研究有助于进一步揭示植物多酚类物质调节脂质代谢的分子机制,本文旨在对相关miRNA参与植物多酚对脂代谢调节的研究进行总结,拟从甘油三酯(triglyceride,TG)及其代谢产物脂肪酸的代谢,胆固醇代谢等常见脂代谢途径展开综述,以进一步了解植物多酚与miRNA调节脂代谢的机制,为预防和治疗代谢性疾病提供中西医药上新的靶点和思路。
1 miRNA与脂代谢
miRNA是一种内源性的非编码小分子单链RNA,在动植物中存在正负调控机制及类激素作用,其中较常见的是负调控机制[1]。miRNA可通过靶向结合mRNA的3′非翻译区(3′UTR),抑制蛋白质翻译或介导靶mRNA降解调节靶基因表达,参与基因的转录后调控[1]。
生物信息学研究预测人类miRNA能调节30%~60%编码蛋白基因的表达,包括脂代谢途径的多个靶基因,例如,miR-33是位于胆固醇调节元件结合蛋白(sterol-regulatory element binding protein,SREBP)基因内的一种内含子miRNA,其靶基因包括了脂肪酸氧化相关的肉毒碱棕榈酰转移酶(carnitine palmityl transferase-1,CPT1),胆固醇代谢相关的胆固醇输出泵ATP绑定结合子A1(ATP binding cassette A1,ABCA1)、脂蛋白脂酶(poprotein lipase,LPL)等[2];此外,不同miRNA的靶基因既能独立调控,又可相互影响,如miR-122和miR-34a分别通过直接/间接途径调控脂质合成相关基因脂肪酸合酶(fatty acid synthase,FASN)的表达。人群研究也表明,miRNA的表达与脂代谢紊乱相关疾病有关。如基于人群的前瞻性Bruneck研究[3]表明,循环中miR-122表达升高与肥胖、代谢综合征和血脂状况不佳等有关。可见miRNA是循环脂质的重要调节因子,通过调节其表达,继而改善脂代谢可能有益于代谢性疾病的治疗。
2 植物多酚通过miRNA调节脂代谢
植物多酚是植物中最为丰富和复杂的次生代谢产物,含有多个酚羟基结构,广泛存在于植物的根、皮、叶和果实中。植物多酚共享一个碳环,但结构不同,根据它们的结构,可大致分为类黄酮(例如花色苷、黄酮醇、黄烷醇、黄烷酮、黄酮和异黄酮)和非类黄酮(例如酚酸、黄嘌呤、草酯、木脂素和丹宁)[4]。在对85种植物多酚及其衍生物的筛选中,发现38种具有较强的降脂活性,且其中18种在目前体内外实验中没有显示毒性,由于植物多酚易于获得且大多毒性较低,因此利用其缓解脂代谢紊乱相关疾病具有重要的研究价值和潜力[5]。近些年来研究发现,植物多酚在不同体内外模型中表现出抗肥胖、抗动脉粥样硬化、抑制肝脏脂质沉积等药理作用,同一种多酚的作用机制具有多靶点、多环节、综合协调的特点,发挥对TG和胆固醇代谢方面的多个分子信号的调控作用。当机体出现代谢紊乱时,多种失调的miRNA通路与脂质生成、脂肪酸氧化、胆固醇转运外排密切相关,已有研究发现,植物多酚可改善脂代谢紊乱时组织或细胞的miRNA表达量[6]。例如,持续服用植物多酚混合物可逆转高脂饮食造成的小鼠肝脏miRNAs的异常表达[6],摄入营养剂量的多酚对apoE缺陷小鼠的肝脏miRNAs也具有调节作用[7]。一些植物多酚的单体化合物如白藜芦醇(resveratrol,RSV)和纯表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)等可直接与miRNA结合,通过这种转录后机制调控脂代谢[8]。不论植物多酚是否通过与miRNA直接结合发挥作用,其最终影响脂代谢的特征主要集中在调节TG及胆固醇代谢上。
2.1 植物多酚通过miRNA调节甘油三酯代谢
2.1.1促进脂肪酸氧化 植物多酚可通过调控miR-33、miR-378促进CPT1、过氧化物酶体增殖物激活受体-γ共激活因子1(peroxisome proliferator activated receptor - γ coactivator 1,PGC-1)等脂肪酸氧化相关基因的表达,脂肪酸作为甘油三酯代谢的中间产物,其氧化有助于减少组织中的脂质堆积。以槲皮素为主的荔枝果肉酚类物质(lychee pulp phenolics,LPPs)可抑制小鼠肝脏中miR-33表达,并在转录和蛋白水平上调CPT1α的表达,从而增加脂肪酸的氧化[9]。柑桔皮中的类黄酮提取物(citrus peel flavonoid extracts,CPFE)也可抑制油酸诱导HepG2细胞中miR-33的表达,CPT1α在转录水平的表达有所增加[10]。Jeon等[11]的研究发现,给予漆黄素,一种广泛存在于蔬菜水果中的多酚时,可以减弱HFD对小鼠肝脏中miR-22、miR-146a、miR-146b、miR-802和miR-378表达的诱导作用,其中,miR-378可抑制其直接靶点核呼吸因子-1 (nuclear respiratory factor-1,NRF-1),NRF-1可调节线粒体功能,与过氧化物酶体增殖物激活受体-γ共激活因子1(peroxisome proliferator activated receptor - γ coactivator 1,PGC-1)密切相关,而漆黄素可下调miR-378和PGC-1的表达,从而改善HFD导致的线粒体功能障碍,促进脂肪酸氧化。
2.1.2抑制甘油三酯和脂肪酸合成 植物多酚可通过miR-122/FASN途径抑制脂肪酸的合成。Arola-Arnal等[12]用葡萄籽原花青素提取物(grape seed proanthocyanidin extract,GSPE)50 μL处理HepG2细胞5 h后,鉴定出15个差异表达的miRNA,其部分靶基因与脂代谢途径有关。进一步研究发现,肥胖大鼠持续摄入低剂量的原花青素3周(低于人类饮食摄入量:5 mg·kg-1),可使肝脏中miR-122的表达水平正常化,FASN蛋白表达减少[13]。Escudero等[14]给健康大鼠饮食添加GSPE(5、15、25、50·kg-1)喂养3周后发现,GSPE可抑制miR-122在肝脏中的表达,并以剂量依赖的方式降低餐后血清中的TG含量。因此,GSPE对血脂的改善可能与其对miR-122的调节有关。LPPs作用在小鼠肝脏时表现出相似的结果,LPPs可抑制miR-122的表达,并在转录和蛋白水平抑制FASN的表达,从而减少脂肪酸合成[9]。CPFE同样可抑制油酸诱导HepG2细胞中miR-122表达,FASN在转录水平的表达减少,这很可能是CPFE发挥体外降脂作用的机制[11]。然而,Baldini等[15]研究表明,水飞蓟宾作为黄酮类化合物水飞蓟素的主要成分之一,可上调油酸酯/棕榈酸酯诱导的大鼠肝癌细胞FaO中miR-122的表达,但并未将水飞蓟宾对脂代谢的有益作用与miR-122的变化联系起来,故miRNA的水平变化也可能是植物多酚在改善脂代谢紊乱后所伴随的结果。
植物多酚还可通过对不同miRNA的调节抑制SREBP-1/FASN轴,从而抑制脂肪酸合成、减少TG含量。雄性肥胖大鼠的肾周脂肪组织的miRNA微阵列显示,RSV干预后,3个miRNA表达降低,13个表达升高,进一步研究表明,仅有miR-539-5p的预测靶基因Sp1在RSV治疗的大鼠中蛋白表达有相应的减少,Pearson相关性研究和3T3-L1细胞的体外研究均表明RSV诱导的Sp1蛋白表达的降低能由miR-539-5p调节,SP1与SREBP-1协同激活FASN基因的启动子,在脂肪合成中发挥重要作用[16]。紫檀芪是RSV的天然类似物,Wu等[17]研究表明,紫檀芪能恢复高糖对大鼠肝脏和BRL-3A、HepG2细胞miR-34a表达的干扰,通过miR-34a对沉默调节蛋白1抗原(sirtuin 1,SIRT1)/SREBP-1通路的调节抑制FASN、硬脂酰辅酶A去饱和酶1(stearoyl-CoA desaturase-1,SCD1)的蛋白表达,改善高糖诱导的肝脂质积累,同时,双重荧光素酶报告基因检测发现,miR-34a可与SIRT1 3′-UTR结合并在转录水平下调其表达,miR-34a可能是果糖干扰的SIRT1 / SREBP-1脂肪合成途径的上游靶标。此外,白藜芦醇葡萄糖苷可从虎杖中提取,是RSV的天然前体,可明显增加高果糖诱导的BRL-3A和HepG2细胞中miR-200a的表达,下调Kelch样ECH关联蛋白1(Kelch-like ECH-associated protein 1,Keap1),Keap1可阻断转录因子NF-E2相关因子2(NF-E2-related factor 2,Nrf2)的抗氧化途径并上调SREBP-1的表达,导致脂质沉积,双重荧光素酶报告基因检测发现Keap1是miR-200a的靶基因并可被其抑制,白藜芦醇葡萄糖苷可通过恢复高糖诱导的的肝细胞miR-200a表达下调,通过Keap1/Nrf2通路降低SREBP1的蛋白表达,其靶基因FASN和SCD1的蛋白水平降低,减少了脂肪酸的合成[18]。这些研究表明,RSV及其类似物在脂肪和肝脏组织中可在不同miRNAs的参与下通过调节SREBP-1/FASN、SCD1途径发挥对TG合成的抑制作用。
2.1.3通过其他途径减少甘油三酯蓄积 针对不同植物多酚的研究也发现了不同的miRNAs,它们靶向调节与甲状腺激素、哺乳动物雷帕霉素靶蛋白相关的基因表达继而减少TG蓄积。杨梅素是一种在植物界广泛存在的类黄酮,常见于杨梅科、松科等植物中,可抑制HFD诱导小鼠肝脏中的miR-205和miR-146b的上调,并在转录和蛋白水平上上调miR-205和miR-146b的靶蛋白肝1型脱碘酶 ( type 1 deiodinase,DIO1) 和甲状腺激素受体b (thyroid hormone receptor b,TRb)的表达,同时调节甲状腺激素反应性脂代谢基因,减少细胞中TG含量[19]。GSPE可明显降低HFD诱导的小鼠肝脏中miR-96的上调,从而改善血清TG异常,但GSPE本身对miR-96并无调节作用,在LO2细胞中敲低miR-96表达可有哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR),叉头蛋白转录因子O1(forkhead box transcription factor O1,FOXO1)等基因表达改变,且未观察到mTOR上游信号蛋白激酶B(protein kinase B,PKB or AKT)的改变,可推测miR-96通过下调mTOR发挥调节脂代谢的作用[20]。
综上所述,植物多酚可改变多种miRNA的表达并影响其靶基因的转录或蛋白水平,从而改善TG代谢,但这种调节也可能是植物多酚激活其他信号通路间接作用的结果,因此可对植物多酚调节miRNA的具体机制进行深入研究,并考虑其他TG代谢通路的影响。
2.2 植物多酚通过miRNA调节胆固醇代谢巨噬细胞内胆固醇的内流和外流,以及细胞内胆固醇合成,游离胆固醇和胆固醇酯之间的转换是泡沫细胞形成的决定因素,泡沫细胞在动脉粥样硬化的发展中起着关键作用。植物多酚可以通过调节胆固醇外流、酯化、摄取来维持细胞内胆固醇稳态,抑制泡沫细胞的形成。一些具有调节胆固醇稳态作用的miRNA也参与了这一过程。
2.2.1增加细胞胆固醇外流 植物多酚可通过miR-7,miR-33调节ABCA1以增加细胞胆固醇外流。ABCA1促进胆固醇流出至细胞外的载脂蛋白1(ApoAⅠ)并增加高密度脂蛋白(high density lipoprotein,HDL)的形成,胆固醇进而通过HDL逆向转运至肝脏进行代谢,是减少细胞胆固醇积累,预防泡沫细胞形成的重要过程。Li等[21]的研究表明,在人单核细胞(THP-1)分化的巨噬细胞中添加氧化低密度脂蛋白(ox-LDL)以诱导泡沫细胞形成后,葛根素可通过降低miR-7水平并激活腺苷5′-磷酸依赖的蛋白激酶(adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK)/过氧化物酶体增殖剂激活受体γ(peroxisome proliferators-activated receptor γ,PPAR γ)/LXRα途径促进ABCA1介导的胆固醇外流,荧光素酶报告基因试剂盒发现miR-7显著降低了丝氨酸/苏氨酸激酶11(serine/threonine kinase 11,STK11)的3′-UTR活性,从而影响了STK11调控的AMPK的表达,进一步研究表明miR-7 mimic可以抑制葛根素诱导的上述途径的激活,减少胆固醇外流。Liu等[22]等发现,紫毛忍冬浆果多酚(Lonicera caerulea berry polyphenols,LCBP)在THP-1源性巨噬细胞中激活了SIRT1,进一步刺激了miR-33和SREBP-2表达的下调,ABCA1表达的上调,减少细胞胆固醇合成并促进其外流,miR-33可抑制ABCA1的转录,其亚型miR-33a位于其宿主基因SREBP-2的内含子区域,这提示miR-33可能参与LCBP对泡沫细胞形成的抑制。ECGG也可呈浓度和时间依赖性下调miR-33a的表达,进而上调ABCA1的蛋白水平,促进细胞胆固醇流出[23]。
2.2.2减少细胞胆固醇酯化 植物多酚可通过miR-9抑制酯酰辅酶A:胆固醇酰基转移酶1(Acy1 Coenzyme A:Cholesterol Acyltransferases1,ACAT1)来减少胆固醇的酯化,致使巨噬细胞中存在更多的游离胆固醇,并可以通过血液循环从细胞中运出至肝脏,这对维持胆固醇的体内稳态至关重要。Shao等[24]研究发现,在GSP(25 mg·L-1,48 h)处理THP-1源性ox-LDL诱导分化的泡沫细胞后,靶向ACAT1的miRNA miR-9的相对表达降低,靶向ABCA1的miR-33等没有变化,miR-9 mimic可增加miR-9水平进而下调ACAT1的表达,减少胆固醇酯的合成,其抑制剂作用相反,表明GSP对泡沫细胞形成的抑制作用与其对miR-9的调控有关。
2.2.3调控细胞胆固醇摄取 植物多酚可能在miR-590的参与下调控细胞胆固醇的摄取。川陈皮素可增加THP-1源性巨噬细胞中的miR-590并降低LPL的表达,而miR-590通过结合LPL 靶基因的3′UTR显著抑制LPL表达,当添加miR-590 mimic处理时细胞脂质水平(包括TC、游离胆固醇和胆固醇酯)较只接受川陈皮素时进一步降低,添加miR-590抑制剂时细胞脂质水平升高,LPL存在于动脉壁的巨噬细胞中时可锚定一些致动脉粥样硬化脂蛋白以加速细胞脂质的摄取,促进泡沫细胞形成,因此,川陈皮素可能通过增强miR-590对LPL表达的抑制作用来降低细胞胆固醇水平,但是如何调节miR-590仍有待进一步探索[25]。
上述研究表明,在巨噬细胞中,植物多酚可能通过调节靶向ABCA1、ACAT1、LPL的miRNA表达来促进细胞中胆固醇外流,减少胆固醇摄取,从而抑制泡沫细胞的形成。在体内实验中,植物多酚在肝脏表现出相似的效果。在HFD喂养的小鼠中,LPPs可抑制肝miR-33的表达,增加其靶基因ABCA1的表达,以促进胆固醇流出,但LPPs下调miR-33的途径尚不清楚[9]。GSPE可在1 h内降低大鼠肝脏中miR-33水平,3 h内增加了ABCA1的表达,该结果强化了miR-33介导GSPE调节胆固醇代谢作用的假设[13]。GSPE对miRNA的调节在体内外实验和不同组织中表现出不同的效果,该效果可能还与提取物纯度、干预时间有关。综上,miRNA可参与植物多酚对胆固醇代谢的调节,但具体调节机制尚不明确,不同的酚类和处理模型对结果也有一定影响,后续可集中探索某种多酚在体内外实验中对靶向胆固醇代谢基因的miRNA调节作用的差异及机制。
3 临床应用
目前,人们越来越多关注植物多酚,因其在人体内可被有效吸收利用及其表现的对人体健康的良好作用。目前已有许多临床实验研究植物多酚摄入对人脂代谢调控的中长期影响。Wang等[26]指出,服用RSV补充剂可降低受试者的血浆LDL-c水平,提高血清脂联素水平,但肥胖的成年人膳食补充EGCG对体质量降低的影响较小。另一项临床实验则发现持续摄入高剂量富含儿茶素的绿茶提取物可降低肥胖成人的体脂和胆固醇[27],近期一项针对6~10岁肥胖女性儿童的研究也发现摄入400 mg·d-1的脱咖啡因绿茶多酚可降低身体质量指数[28]。由于多酚的药代动力学具有一定的复杂性,个体差异,肠道微生物群的代谢活动等都会影响临床应用的结果。因此,提取植物多酚单体作为药物广泛应用于人体调节脂代谢尚有一定难度,需要在其单体及代谢产物调控人体脂代谢的分子机制方面进行进一步研究,而目前多酚化合物通过miRNAs调节脂代谢的临床研究就比较缺乏,主要的研究也仅针对一些膳食摄入多酚与脂代谢的关系。Daimiel等[29]研究发现,摄入富含多酚的特级初榨橄榄油后,受试者的循环miRNAs发生了变化,其中下调的血浆let-7e已被证明与HDL呈负相关,但尚无法判断这些循环 miRNA水平的变化对相应靶细胞的影响。一项随机对照实验发现,食用富含多酚类物质的蓝莓可以调节miRNA的表达,其中miR-126-5p参与了单核细胞的炎症反应,可能间接影响了脂代谢[30]。这些研究提示,从植物中提取多酚用于脂代谢相关疾病的药物治疗具有一定开发潜力,其中发挥关键调控作用的miRNA有望成为药物开发利用的新靶点,发挥对人体代谢的调控作用。
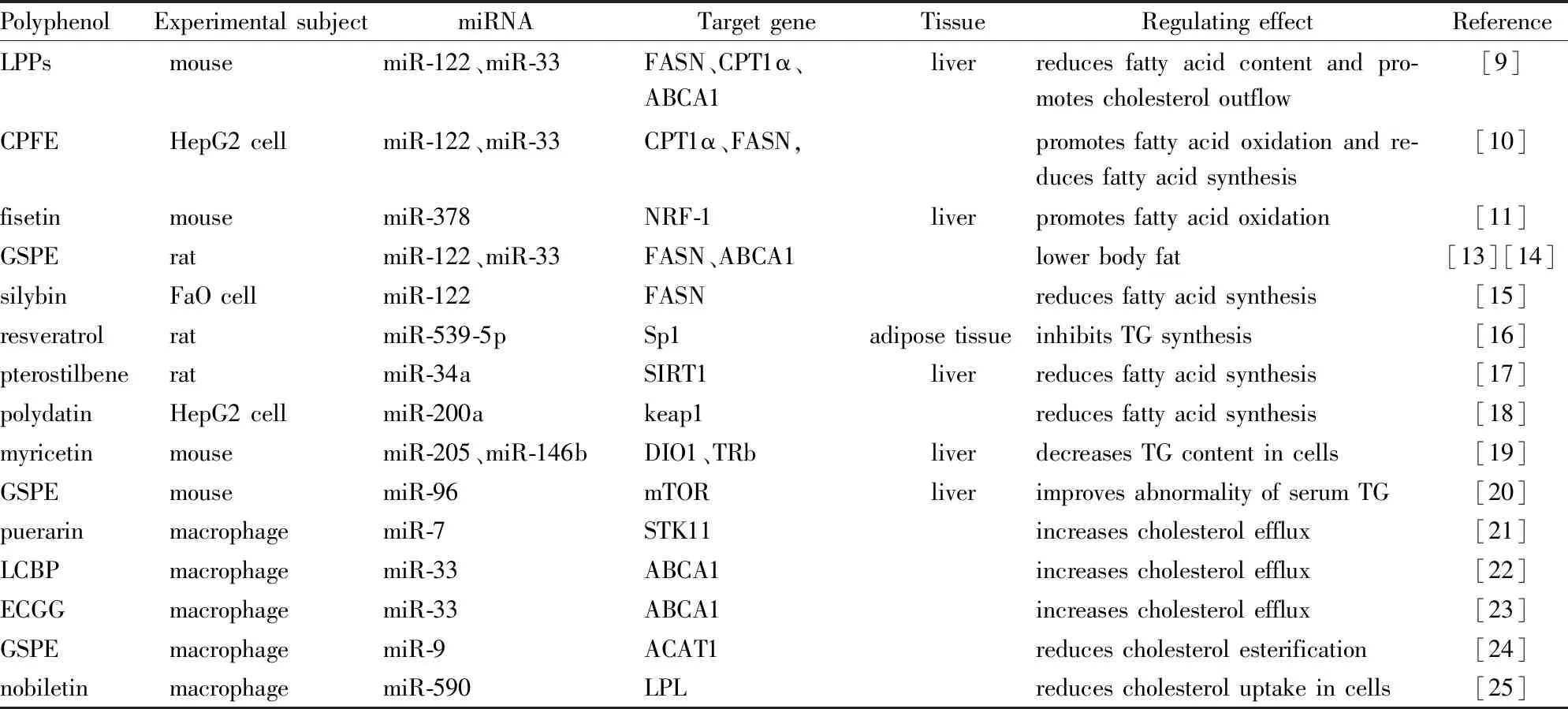
Tab 1 Role of polyphenols in lipid metabolism through miRNA
4 小结
脂代谢紊乱可诱导肥胖等多种慢性代谢性疾病的发生发展,因此维持机体脂质平衡至关重要。目前,许多动物与细胞实验表明植物多酚可通过miRNA促进脂肪酸氧化,抑制脂质合成从而减少脂质蓄积,通过增加细胞胆固醇外流,减少细胞胆固醇酯化及摄取来调节胆固醇代谢(相关研究归纳见Tab 1)。部分植物多酚的化学结构使其可以直接特异性结合miRNA并调控其靶基因,但鲜少有研究探索植物多酚构象与miRNA结合方式之间关系,此外,其对miRNA水平上的调节也可能是脂代谢紊乱改善后的伴随现象。由于植物多酚与miRNA种类繁多,涉及机制复杂,多酚的种类,提取物纯度,实验模型都可能造成不同的结果,且植物多酚通过miRNA调节脂代谢这一机制仍缺少相关临床数据进行验证。因此,明确不同结构的植物多酚与miRNA的关系,以及miRNA在其中发挥的作用,有助于进一步了解、完善其对脂代谢的调控机制,找到更多有效的miRNA作用靶点,为利用植物多酚改善脂代谢紊乱相关疾病提供新的思路。

