糖尿病视网膜病变、纤维蛋白原及血细胞比容与2型糖尿病颈动脉狭窄的关系
于 顺,闫军伟,杨雪娇,李永欣,焦学飞,刘 兵,吴 江,郭明金
1青岛大学附属医院血管外科,山东 青岛 266555
2青岛大学附属医院眼科,山东 青岛 266003
随着中国社会经济的快速发展,老龄化不断加速,脑卒中的发病率持续升高,严重危害人们的身体健康[1]。其中,缺血性脑卒中发病率不断上升,约占脑卒中的80%,而颈动脉粥样硬化性狭窄与缺血性脑卒中关系密切[2]。积极开展颈动脉狭窄筛查,早期发现与颈动脉狭窄相关的危险因素,对预防缺血性脑卒中具有重要意义。眼底视网膜的血管是人体全身唯一可以看到的血管,糖尿病视网膜病变(diabetic retinopathy,DR)是常见的微血管并发症,发病率已超过1/3[3]。研究表明,DR与颈动脉斑块及颈动脉内中膜厚度(intima-media thickness,IMT)密切相关[3-5]。2型糖尿病(type 2 diabetes mellitus,T2DM)是一种慢性代谢性疾病,伴有多种并发症,包括DR、糖尿病神经病变、糖尿病肾病及心血管疾病,其中,DR是其常见的并发症[6-8]。本研究旨在探讨T2DM患者发生颈动脉狭窄的影响因素,早期发现积极干预,降低缺血性卒中发生率,现报道如下。
1 资料与方法
1.1 一般资料
收集2016年8月至2020年12月青岛大学附属医院收治的T2DM患者的临床资料。纳入标准:明确诊断为T2DM;住院期间均行颈部血管超声检查;住院期间有眼科会诊记录。排除标准:患有白内障、青光眼及DR以外的其他眼底疾病;伴严重肾脏疾病、血液系统疾病、循环系统疾病等。根据纳入与排除标准,最终共纳入175例T2DM患者,根据颈动脉超声检查结果将其分为狭窄组(n=86)和无狭窄组(n=89)。狭窄组中,狭窄程度:轻度狭窄10例,中度狭窄47例,重度狭窄或闭塞29例;DR分期:无DR 40例,非增殖期视网膜病变(non-proliferative diabetic retinopathy,NPDR)期38例,增殖期视网膜病变(proliferative diabetic retinopathy,PDR)期8例。
1.2 方法
记录患者的一般资料,如年龄、性别、体重指数(body mass index,BMI)、吸烟史、高血压病史等。记录患者的眼科检查情况,包括视力、眼压、眼部B超、眼底检查等,由1名眼科副主任医师根据眼科会诊记录对DR进行诊断与分期,若两侧眼均有DR则以较重侧为准。记录患者的实验室指标,包括总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、甘油三酯(triglyceride,TG)、血尿素氮(blood urea nitrogen,BUN)、尿酸(uric acid,UA)、肌酐(creatinine,Cr)、胱抑素C(cystatin C,Cys C)、空腹血糖(fasting blood glucose,FBG)、纤维蛋白原(fibrinogen,FIB)、血细胞比容(hematocrit,HCT)等。由1名超声科副主任医师进行颈动脉彩色多普勒超声检查,采用北美症状性颈动脉内膜切除术试验(North American Symptomatic Carotid Endarterectomy,NASCET)评估颈动脉狭窄程度,若两侧颈动脉均有狭窄,则以较重侧为准。
1.3 判定标准
(1)糖尿病诊断标准[9]:即糖尿病症状+随机血糖≥11.1 mmol/L,或FBG≥7.0 mmol/L,或口服葡萄糖耐量试验2 h血糖≥11.1 mmol/L。(2)DR分期[10]:Ⅰ期,微血管瘤、小出血点;Ⅱ期,出现硬性渗出;Ⅲ期:出现棉絮状软性渗出;Ⅳ期,新生血管生成、玻璃体积血;Ⅴ期,纤维血管增殖、玻璃体机化;Ⅵ期,牵拉视网膜脱离失明。Ⅰ~Ⅲ期为NPDR,Ⅳ~Ⅵ期为PDR。(3)颈动脉狭窄<30%为轻度,30%~69%为中度,70%~100%为重度狭窄或闭塞。
1.4 统计学方法
应用SPSS 26.0软件对数据进行统计分析,符合正态分布且方差齐性的计量资料以(±s)表示,组间比较采用两独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,两组间比较采用Mann-WhitneyU检验,多组间比较采用Kruskal-WallisH检验;计数资料以n(%)表示,组间比较采用χ2检验;将单因素分析中P<0.1的影响因素全部纳入Logistic回归模型进行多因素分析。采用Kendall's tau-b相关系数进行相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 T2DM患者发生颈动脉狭窄影响因素的单因素分析
单因素分析结果显示,高血压病史、DR、FIB、HCT均为T2DM患者颈动脉狭窄的影响因素(P<0.05)。(表1)

表1 T2DM患者发生颈动脉狭窄影响因素的的单因素分析
2.2 T2DM患者发生颈动脉狭窄影响因素的多因素分析
将单因素分析中P<0.1的影响因素即年龄、高血压病史、DR、HDL-C、FIB、HCT作为自变量,颈动脉狭窄(无=0,有=1)作为因变量进行Logistic回归模型分析,结果显示,DR、HDL-C、FIB均是T2DM患者发生颈动脉狭窄的影响因素(P<0.05)。(表2)
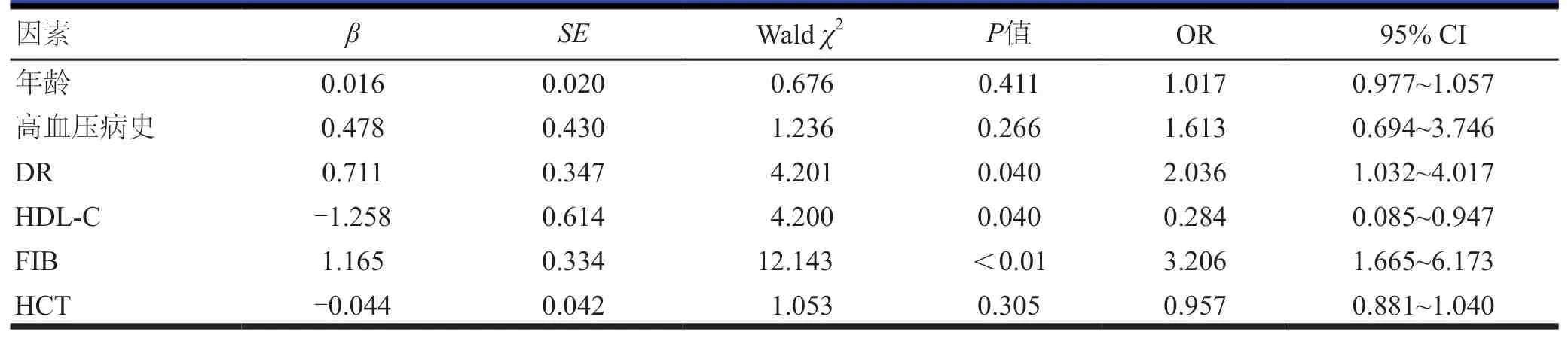
表2 T2DM患者发生颈动脉狭窄影响因素的多因素分析
2.3 不同狭窄程度患者FIB水平的比较
轻度、中度、重度狭窄或闭塞患者FIB水平分别为3.35(2.62,3.87)、3.03(2.59,3.45)、3.21(2.79,3.97)g/L,三者比较,差异无统计学意义(P>0.05)。
2.4 DR分期与颈动脉狭窄程度的关系
Kendall's tau-b相关系数分析显示,DR分期与颈动脉狭窄程度不存在相关性(r=-0.023,P=0.816)。
3 讨论
糖尿病的微血管和大血管并发症通常被视为独立的疾病[4],但两者关系密切,存在共同影响因素,且致病途径相同[11-13]。Alonso等[4]研究显示,在无心血管疾病且肾功能正常的T2DM患者中,DR与颈动脉粥样硬化负荷相关。Ichinohasama等[14]研究表明,颈动脉IMT与T2DM患者眼部缺血密切相关并可导致轻度NPDR。上述研究均提示DR与颈动脉粥样硬化密切相关。Drinkwater等[3]研究表明,颈动脉狭窄多与DR相关。本研究结果显示,DR是T2DM患者发生颈动脉狭窄的独立危险因素之一,但DR分期与颈动脉狭窄程度不存在等级相关性,提示颈动脉狭窄程度不随DR分期增加而加重。
FIB是一种340 kD的糖蛋白,主要在肝细胞中表达[15]。FIB不仅是一种促血栓形成的促炎因子,还直接诱导动脉粥样硬化形成[16-17],与颈动脉粥样硬化密切相关。Sabeti等[18]研究表明,FIB水平与颈动脉粥样硬化的进展密切相关。FIB升高为颈动脉斑块形成的独立危险因素之一[19]。Assayag等[20]将无神经症状患者的颈动脉狭窄程度与炎症因子间进行年龄、性别、BMI及HCT校正,结果显示,颈动脉狭窄程度与FIB水平存在微弱的相关性。既往关于FIB与颈动脉狭窄的研究多集中在急性脑梗死(acute cerebral infarction,ACI)患者中,孙原等[21]研究表明,ACI患者FIB水平与其神经功能缺损的严重程度及颈动脉狭窄密切相关;郭俊华等[22]研究显示,ACI患者颈动脉狭窄程度越严重,FIB水平也越高;米国青等[23]颈动脉狭窄短暂性脑缺血发作(transient ischemic attack,TIA)进展脑梗死的研究表明,FIB升高是颈动脉狭窄性TIA进展为脑梗死的危险因素之一。本研究多因素分析结果显示,FIB水平升高为T2DM患者发生颈动脉狭窄的独立危险因素之一。
HDL-C为抗动脉粥样硬化的主要脂蛋白,与颈动脉斑块及颈动脉狭窄密切相关[24-25]。Nasr等[26]研究显示,单次输注重组高密度脂蛋白可急性改变与颈动脉斑块不稳定相关的血浆生物标志物。较低水平HDL-C是颈动脉狭窄的独立预测因子[25]。本研究结果显示,较低HDL-C水平是T2MD颈动脉狭窄的独立危险因素。HCT指血细胞在全血中所占的容积百分比,目前,HCT与颈动脉粥样硬化的关系尚存在争议。Totsimon等[27]研究显示,HCT水平在颈动脉狭窄组患者与无颈动脉狭窄组患者之间、症状组患者(即有缺血性卒中或TIA病史)与无症状组患者之间无差异,然而,在无症状患者中,无颈动脉狭窄组患者HCT水平明显低于狭窄组患者。Assayag等[20]研究表明,随着颈内动脉狭窄程度的增加,HCT水平逐渐降低,但差异无统计学意义。此外,徐倩茹等[19]发现颈动脉斑块组患者HCT水平明显低于无颈动脉斑块组患者,HCT水平参与了颈动脉斑块的形成。本研究结果显示,颈动脉狭窄组患者HCT明显低于无颈动脉狭窄组患者,提示较低HCT水平可能为T2DM患者发生颈动脉狭窄的危险因素之一。
综上所述,高血压病史、DR、较高FIB水平、较低HCT水平、较低HDL-C水平均可能为T2DM患者发生颈动脉狭窄的危险因素,其中DR、FIB可能为颈动脉狭窄的独立影响因素。临床工作中应密切观察上述影响因素,早发现、早治疗,从而降低缺血性脑卒中的发病率。

