miR-27a调控Sfrp1对肾小管上皮细胞EMT的影响*
田平平, 邹琴, 卢雨微, 郭兵, 石明隽**
(1.新乡医学院 三全学院 护理学院, 河南 新乡 453003; 2.贵州医科大学 基础医学院 病理生理学教研室, 贵州 贵阳 550025)
微小核糖核酸(microRNA, miRNA)是一类由内源基因编码的、长度为19~25个核苷酸的非编码单链RNA分子,能与mRNA 3′UTR区的靶序列特异性结合,抑制靶蛋白的翻译[1-2],miRNA异常与多种疾病的发生发展有关[3-4]。有研究报道,在高糖培养的肾小球系膜细胞和链脲佐菌素(STZ)诱导的糖尿病肾病(diabetic nephropathy, DN)大鼠肾组织中miR-27a表达增加,敲低miR-27a可以抑制高糖诱导的系膜细胞增殖,也可以抑制细胞外基质(extracellular matrix,ECM)相关促纤维化基因的表达[5]。分泌型卷曲相关蛋白1(secreted frizzled-related protein 1, Sfrp1)是分泌型卷曲相关蛋白家族(secreted frizzled-related protein family, Sfrps)成员之一,亦是miR-27a最主要的靶基因[6-7],过表达miR-27a可以抑制Sfrp1蛋白的表达[8-9]。研究发现,Sfrp1诱导了肿瘤细胞的上皮-间充质转化(epithelial-mesenchymal transition, EMT)表型[10],EMT是上皮细胞向间质细胞转变并执行间质细胞功能的一种形态学变化,也是促进肾纤维化进程的重要原因之一。因此,本研究拟从体外观察过表达和敲低miR-27a后对Sfrp1及EMT相关分子表达的影响,探索在高糖环境下的miR-27a能否通过调控Sfrp1的表达影响EMT的发生,为DN的治疗提供新的依据。
1 材料与方法
1.1 实验材料
1.1.1细胞来源 大鼠肾小管上皮细胞(NRK-52E细胞,购自美国菌种保藏中心,ATCC)。
1.1.2主要试剂 Trizol Regent(美国ambion公司),Sfrp1和β-actin引物(上海生工生物技术工程服务有限公司),Revert Aid TM Firststrand cDNA Synthesis Kit(美国Thermo公司),2×SuperReal PreMix Plus(天根生化科技有限公司),miR-27a、U6引物和Bulge-LoopTMmiRNA qRT-PCR Primer试剂盒(广州锐博生物公司),pMIR-REPORT-Sfrp1野生型和突变型质粒(上海毅乐生物科技有限公司),抗col-Ⅳ抗体(美国Sigma公司),抗β-actin抗体(武汉普美克生物技术有限公司),抗α-SMA抗体(武汉proteintech公司),抗Sfrp1抗体、抗E-cadherin抗体(北京博奥森生物技术有限公司),DMEM培养基、胎牛血清(美国Gibico公司)。
1.2 研究方法
1.2.1细胞培养与转染 NRK-52E细胞置于DMEM培养基+10%胎牛血清、5%CO237 °C培养箱中培养,细胞长至70%时分为正常糖(NG组,5.5 mmol/L)和高糖(HG组,30 mmol/L)两组,48 h后收取蛋白和RNA备用;高糖培养的NRK-52E细胞长至70%时分成miR-27amimics阴性对照组(miR-27amnc组)、miR-27amimics组(miR-27am组)、miR-27ainhibitor阴性对照组(miR-27ainc组)、miR-27ainhibitor组(miR-27ai组),转染4~6 h后用新鲜高糖培养基(30 mmol/L)替换原培养基,48 h后收取蛋白和RNA备用。
1.2.2Western blot法检测Sfrp1、E-cadherin、α-SMA、col-Ⅳ蛋白表达 按照蛋白提取试剂盒说明书提取NRK-52E细胞总蛋白,SDS-PAGE凝胶电泳分离,待溴芬兰跑至分离胶时,调电泳仪为120 V、电泳约60 min后,将其转至预先准备好的PVDF膜上,5%脱脂牛奶封闭1 h,TBST洗膜3次,每次5 min,一抗孵育,浓度分别为β-actin(1 ∶4 000)、Sfrp1(1 ∶500)、E-cadherin(1 ∶300)、α-SMA(1 ∶300)、col-Ⅳ(1 ∶1 000);4 ℃孵育12 h;次日,TBST洗膜;二抗室温孵育1 h,TBST洗膜,ECL 液显色,Bio-Rad凝胶成像系统扫描检测 PVDF 膜上的目的蛋白灰度,检测 PVDF 膜上的目的蛋白,利用Image Lab 5.1 图像分析软件进行分析并统计。
1.2.3实时荧光定量PCR(reverse transcriptionre realtime fluorescence quantitative,RT-qPCR )检测miR-27a及Sfrp1 mRNA的表达 Trizol法提取NRK-52E细胞总RNA,按照逆转录试剂盒说明书合成cDNA,应用Bio-rad荧光定量 PCR仪检测miR-27a及Sfrp1 mRNA的表达。miR-27a、U6引物由广州锐博生物公司合成。β-actin、Sfrp1引物由上海生工生物技术工程服务有限公司合成。mRNA的相对表达量用2-ΔΔct方法分析。
1.2.4双荧光素酶报告基因实验 TargetScan 生物信息软件预测miR-27a和Sfrp1mRNA的3′UTR区的结合位点,并由上海毅乐生物科技有限公司设计Sfrp1野生型和突变型质粒,见图1,分别命名为pMIR-REPORT-Sfrp1野生型(wt Sfrp1-3′UTR)和pMIR-REPORT-Sfrp1突变型(mtSfrp1-3′UTR)。将NRK-52E细胞分为野生型Sfrp1-3′UTR+miR-27amimics阴性对照组(wtSfrp1-3′UTR+miR-27amnc组)、野生型Sfrp1-3′UTR+miR-27amimics组(wtSfrp1-3′UTR+miR-27am组)、突变型Sfrp1-3′UTR+miR-27amimics阴性对照组(mtSfrp1-3′UTR+miR-27amnc组)以及突变型Sfrp1-3′UTR+miR-27amimics组(mtSfrp1-3′UTR+miR-27am)。进行转染前1天,将NRK-52E细胞铺入24孔板中,使转染时细胞密度达到约50%,分别取50 nmolmiR-27amimics(或)miR-27amimics negative control、海肾荧光质粒20 ng和Sfrp1野生型(或突变型)质粒200 ng 混合于DMEM培养基中,转染4~6 h后弃去培养基,加入含2%血清的高糖培养基;48 h后按照Dual-Luciferase®Reporter Assay System说明书操作。PBS液清洗细胞3次,吸净24孔板中PBS液,每孔加入PLB 100 μL,于水平摇床上常温裂解15~20 min;将裂解液吸至1.5 mL EP管中,4 ℃ 12 000 r/min离心3~5 min;吸等量上清转移至新的1.5 mL EP管中;上机检测,分别加入LARⅡ100μL和Stop & Glo® Buffer液100 μL,利用荧光素酶报告基因检测仪检测萤火虫荧光值与海肾荧光值的比值进行分析。
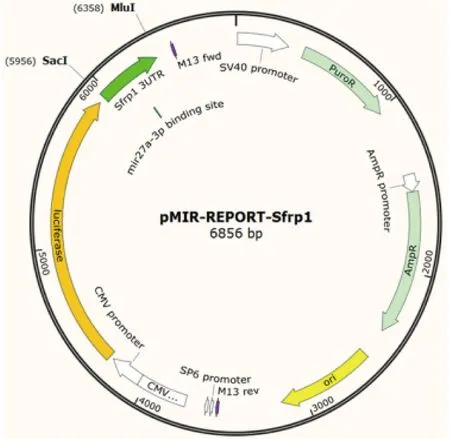
图1 pMIR-REPORT-Sfrp1质粒图谱Fig.1 Vector map of pMIR-REPORT-Sfrp1
1.3 统计学方法
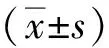
2 结果
2.1 NG和HG组细胞中miR-27a、Sfrp1、E-cadherin、col-Ⅳ、α-SMA的表达
RT-qPCR结果显示,与NG组相比,HG组miR-27amRNA表达明显增高(P<0.05),而Sfrp1 mRNA表达降低(P<0.05);见表1。Western blot结果显示,与NG组比较,HG组Sfrp1、E-cadherin表达降低(P<0.05),而col-Ⅳ、α-SMA蛋白表达增高(P<0.05);见图2、表2。
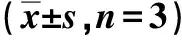
表1 NG、HG组细胞中miR-27a、Sfrp1 mRNA表达Tab.1 Expression levels of miR-27a and Sfrp1 mRNA between NG and HG
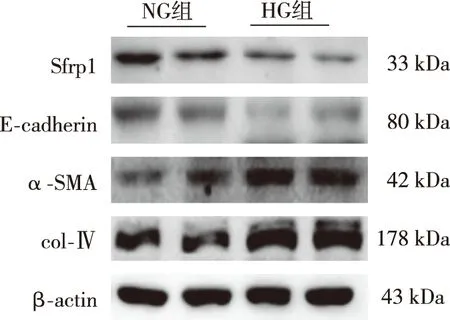
图2 NG、HG组细胞Sfrp1、E-cadherin、α-SMA、col-Ⅳ蛋白表达(Western blot)Fig.2 Expression levels of Sfrp1, E-cadherin, α-SMA, and col-Ⅳ protein between NG and HG groups(Western blot)
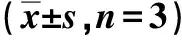
表2 NG、HG组细胞中Sfrp1、E-cadherin、α-SMA、col-Ⅳ蛋白表达Tab.2 Expression levels of Sfrp1, E-cadherin, α-SMA, and col-Ⅳ protein between NG
2.2 miR-27a 靶向调控Sfrp1
双荧光素酶报告基因实验结果显示,与wtSfrp1-3′UTR+miR-27amnc 相比,wtSfrp1-3′UTR+miR-27am组的相对荧光素酶活性降低(P<0.05);而当Sfrp1基因 3'UTR 的潜在结合位点发生点突变后,突变型质粒mtSfrp1-3′UTR+miR-27amnc与mtSfrp1-3′UTR+miR-27am组荧光素酶活性未见明显差异,差异无统计学意义(P>0.05)。见表3。提示miR-27a能与Sfrp1 mRNA 3′UTR区结合,抑制Sfrp1的表达。
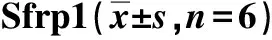
表3 荧光素酶报告基因检测miR-27a靶向调控Tab.3 Luciferase reporter gene assayed-regulation of Sfrp1 by
2.3 过表达miR-27a后NRK-52E细胞中miR-27a、Sfrp1、E-cadherin、col-Ⅳ、α-SMA的表达水平
RT-qPCR结果显示,与miR-27amnc组相比,miR-27am组miR-27amRNA表达增高(P<0.05),Sfrp1 mRNA表达降低(P<0.05)。见表4。Western blot结果显示,与miR-27amnc组比较,miR-27am组Sfrp1、E-cadherin表达降低(P<0.05);而col-Ⅳ、α-SMA的蛋白表达增高(P<0.05)。见图3、表5。
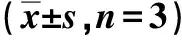
表4 miR-27a mnc和miR-27a m组细胞中miR-27a、Sfrp1 mRNA表达Tab.4 Expression levels of miR-27a and Sfrp1 mRNA in miR-27a mnc and miR-27a m
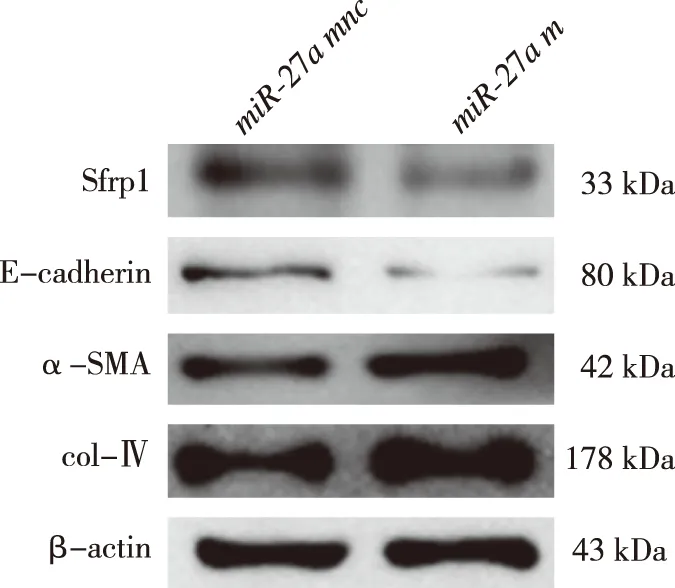
图3 miR-27a mnc和miR-27a m组细胞中Sfrp1、E-cadherin、α-SMA、col-Ⅳ蛋白表达(Western blot)Fig.3 Expression levels of Sfrp1, E-cadherin, α-SMA, and col-Ⅳ protein between miR-27a mnc andmiR-27a m groups(Western blot)
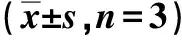
表5 miR-27a mnc和miR-27a m组细胞中Sfrp1、E-cadherin、α-SMA、col-Ⅳ蛋白表达Tab.5 Expression of Sfrp1, E-cadherin, α-SMA, and col-Ⅳprotein between miR-27a mnc and
2.4 抑制miR-27a后NRK-52E细胞中miR-27a、Sfrp1、E-cadherin、col-Ⅳ、α-SMA的表达水平
RT-qPCR结果显示,与miR-27ainc组相比,miR-27ai组miR-27a表达降低(P<0.05),而Sfrp1表达增高(P<0.05)。见表6。Western blot结果显示,与miR-27ainc组比较,miR-27ai组Sfrp1、E-cadherin表达增高(P<0.05);而col-Ⅳ、α-SMA的蛋白表达降低(P<0.05)。见图4、表7。
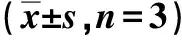
表6 miR-27a inc和miR-27a i组细胞中miR-27a、Sfrp1 mRNA表达Tab.6 Expression levels of miR-27a and Sfrp1 mRNA between miR-27a inc and miR-27a i
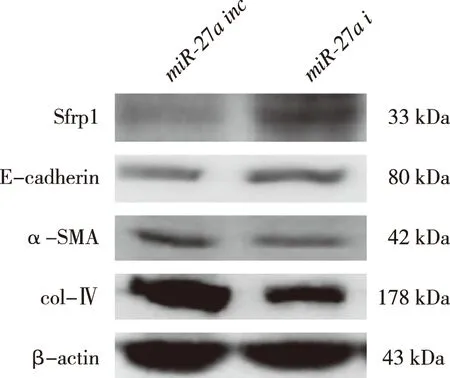
图4 miR-27a inc和miR-27a i组细胞中Sfrp1、E-cadherin、α-SMA、col-Ⅳ蛋白表达(Western blot)Fig.4 Expression levels of Sfrp1, E-cadherin, α-SMA, and col-Ⅳ protein between miR-27a inc andmiR-27a i groups(Western blot)
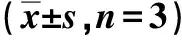
表7 miR-27a inc和miR-27a i组细胞中Sfrp1、E-cadherin、α-SMA、col-Ⅳ蛋白表达Tab.7 Expression levels of Sfrp1, E-cadherin, α-SMA, and col-Ⅳ protein between miR-27a inc and
3 讨论
DN是糖尿病(diabetes mellitus, DM)所致的一种常见并发症,也是引起终末期肾脏疾病(end-stage renal disease, ESRD)的常见原因[11]。大量研究表明,肾脏纤维化是导致DN和ESRD的主要病理因素[12-13]。而EMT是促进肾纤维化进程的重要原因之一[14]。当发生EMT时可引起E-cadherin表达减少或丢失,同时α-SMA表达增多。α-SMA是肌成纤维细胞的标志蛋白,肌成纤维细胞能够分泌大量ECM并发生沉积,最终引起肾脏纤维化的发生。本研究以NRK-52E细胞为研究对象,分别给予正常糖和高糖处理48 h,结果显示HG组E-cadherin表达减少,α-SMA、col-Ⅳ表达增多,提示高糖环境可以诱导EMT的发生,促进肾脏纤维化。
近年研究发现,在真核生物中miRNA的调控作用涉及个体发育、细胞分化、增殖、代谢、凋亡和肿瘤等。研究证实,miRNA在肾脏纤维化疾病以及糖尿病肾病中也起着重要作用,miRNA与肾脏疾病的发生有关[15-20],是引起肾脏疾病的一个新的重要因素,但其具体调控机制仍不清楚。研究发现,miR-27a可以通过调控Sfrp1影响肝细胞癌的转移[9]。本研究结果显示高糖培养的NRK-52E细胞中,miR-27a表达增多,Sfrp1表达减少。双荧光素酶报告基因实验结果提示,在共同转染了miR-27amimics和Sfrp1野生型质粒时,荧光活性明显减弱;而在突变型质粒组未见明显变化,证实miR-27a可以靶向调控Sfrp1。
Sfrp1是Wnt信号通路抑制因子之一[21-22]。本课题组前期研究结果发现,在糖尿病肾病大鼠肾组织中,Sfrp1 mRNA和蛋白表达较正常组大鼠均减少,导致Wnt信号通路活化并促进了肾脏纤维化的发生[23-24]。也有研究发现, 在结直肠癌中,Sfrp1可能通过 Wnt/β-catenin 信号通路EMT 的过程[25]。但Sfrp1调控EMT过程的具体机制仍不清楚。为进一步证实miR-27a是否通过靶向调控Sfrp1对肾小管上皮细胞EMT产生影响,本研究分别将高糖培养的NRK-52E细胞转染miR-27amimics和inhibitor,结果发现在过表达miR-27a后,Sfrp1表达减少,E-cadherin表达降低,α-SMA、col-Ⅳ表达增多;在miR-27a抑制剂组,Sfrp1、E-cadherin、α-SMA、col-Ⅳ表达水平发生了相反的变化。说明过表达miR-27a可以抑制Sfrp1的表达进而促进高糖状态下NRK-52E细胞EMT的发生;而抑制miR-27a后,可逆转这一现象,进一步证实了miR-27a可以通过调控Sfrp1的表达进而影响高糖诱导的NRK-52E细胞EMT进程。
综上所述,高糖环境下,NRK-52E细胞中miR-27a可以靶向调控Sfrp1的表达,影响EMT的发生,从而参与糖尿病肾病肾脏纤维化的过程。
——一道江苏高考题的奥秘解读和拓展

