雷公藤提取物中主要物质基础及其抗肿瘤活性研究
胡 丹, 丁同同, 李 江, 邓璐璐, 吴树燕, 穆淑珍*
( 1. 贵州医科大学 省部共建药用植物功效与利用国家重点实验室, 贵阳 550014; 2. 贵州省中国科学院天然产物化学重点实验室, 贵阳 550014; 3. 贵州医科大学 药学院, 贵阳 550025 )
雷公藤()是卫矛科(Celastraceae )雷公藤属()植物,又名莽草、黄藤木、断肠草等,主要分布于中国长江中下游地区、西南地区以及韩国、日本等地(利剑余,2017)。雷公藤以根、叶、花及果入药,其味辛、苦,性寒,有大毒,具有祛风除湿、消肿止痛、杀虫解毒等功效(马哲等,2011),主要用于治疗类风湿性关节炎、肾小球肾炎红斑狼疮等自身免疫性疾病及各种皮肤病(刘为萍等,2010)。国内外学者对雷公藤植物的根、叶及果实等部分进行了化学成分研究。迄今为止,从雷公藤中分离得到单体化合物200多种,主要包括倍半萜、二萜、三萜、木质素、生物碱类、黄酮类等(马伟光等,2006)。其中,二萜、三萜、生物碱类化合物是其主要活性成分。在药理及临床研究方面,雷公藤具有抗炎、免疫抑制、抗肿瘤、抗菌、抑制生育等生物活性(Chou & Mei,1936)。随着生命科学和分子生物学的飞速发展,有些新发现使雷公藤物质基础的研究备受关注。Liu等(2015)发现雷公藤红素能降低小鼠45%的体重,并可能对2型糖尿病、脂肪肝等疾病有治疗效果;Chang等(2021)研究发现雷公藤内酯酮是一种极具转化应用前景的非激素类男性避孕候选药。雷公藤的临床疗效显著,利剑余(2017)发现雷公藤具有一定的生理毒性,通常在几小时内脏器会发生严重的功能障碍以及严重的器质性损害,对肝、肾的毒性最为明显,有时甚至会导致死亡。经研究发现雷公藤中产生毒性反应的成分是其主要活性成分二萜类,二萜是雷公藤中目前研究较多的化学成分。然而,对雷公藤中其他成分的研究较少,其广泛的生物活性依然有待继续挖掘。
鉴于雷公藤高效的生物活性,为提高雷公藤临床上的利用度,探究雷公藤中主要物质基础及其他成分的生物活性显得尤为重要。因此,我们对雷公藤提取物进行了化学成分的分离与鉴定,并对得到的化合物进行了抗肿瘤的活性筛选。本研究从雷公藤提取物中共分离出12个单体化合物(图1),结构类型涉及萜类、酚酸类和醌类。并且,在体外活性筛选方面,首次发现雷公藤提取物中醌类化合物(化合物)具有明显的抗神经母瘤细胞增殖活性。
1 材料与仪器
1.1 材料和试剂
雷公藤药材购自贵阳市花果园药材中药市场,经贵州中医药大学董丽莎教授鉴定为雷公藤()的根部。
SH-SY5Y细胞株、K562细胞株、Hel细胞株(上海奥陆生物科技有限公司);甲氨蝶呤水合物(Enetgy Chemical,批号:DJ210110);细胞凋亡荧光Hoechst 33342/PI双染试剂盒(Solarbio Life Sciecnces,批号:CA1120);双抗(青霉素+链霉素,HyClone,批号:J140032);DMEM培养基、RPMI1640培养基、胎牛血清(Gibco公司);甲醇、乙醇、氯仿、乙酸乙酯、石油醚(国药集团化学试剂有限公司)。Sephadex LH-20葡聚糖凝胶(40 ~ 70 μm,瑞士Amersham Pharmacia Biotech AB 公司);柱层析硅胶(200 ~ 300目和300 ~ 400目),硅胶H (10 ~ 40 μm)和薄层层析硅胶GF254(0.20 ~ 0.25 mm)(青岛海洋化工厂)。
1.2 仪器
Sim-HPLC半制备色谱仪(Wasters, Delta 600);酶标仪(Therm scientific, VARIOSKANLUX);显微镜(Leica, Dmi8);流式细胞仪(ACEABIO, Novocyte); ESI-MS电喷雾质谱仪(布鲁克道尔顿公司);600 MHz型超导核磁共振仪(瑞士Bruker公司)。
2 研究方法
2.1 提取分离
称取雷公藤药材20 kg,用95%乙醇回流提取3 次,每次3 h。收集提取液浓缩至原体积的 1/3,少量多次加水,浓缩至无醇味。乙酸乙酯萃取至无颜色,浓缩旋干萃取液,取适量溶剂溶解,中性氧化铝拌样,洗脱剂为乙酸乙酯过中性氧化铝层析柱(100~200 目),浓缩回收溶剂得到雷公藤多苷粗品104 g。
雷公藤多苷粗品用40~80 目硅胶拌样,使其均匀吸附于硅胶上,10倍量的硅胶柱层析(200~300 目)粗分段,以不同体积比的氯仿∶甲醇(70∶1~1∶1)进行梯度洗脱。通过薄层层析(TLC)跟踪观察组分在紫外分析仪下的荧光及显色情况,合并相似部分,共分为 6 段,标记为 Fr.1(400 mg)、Fr.2(2.5 g)、Fr.3(40 g)、 Fr.4(20 g)、Fr.5(40 g)和 Fr.6(4.1 g)。将 Fr.5段先通过MCI柱,用不同体积比的甲醇∶水混合溶剂进行梯度洗脱,洗脱比例为50∶1、70∶1、90∶10、100∶0。使用TLC跟踪观察组分在紫外分析仪下的荧光及显色情况,合并相似部分,标记为Fr.5.1(200 mg)、Fr.5.2(1.5 g)、Fr.5.3(12.9 g)、Fr.5.4(21.7 g)。将Fr.5.1段经葡聚糖凝胶柱层析及反复重结晶得到化合物(8 mg)。将Fr.5.4经半制备分离技术得到化合物(8 mg)、(6 mg)、(12 mg)、(9 mg)和(15 mg)。将Fr.1经反复重结晶、正反相硅胶柱层析得到化合物(88 mg)。将Fr.2经MCI柱层析、葡聚糖凝胶柱层析及半制备高效液相色谱等分离手段得到化合物(32 mg)、(25 mg)。将Fr.4经葡聚糖凝胶粗分段后过半制备得到化合物(9 mg)、(15 mg)和(12 mg)。
2.2 生物活性测试
2.2.1 用MTT法筛选化合物活性 收集对数生长期的SH-SY5Y细胞、K562细胞、Hel细胞,重悬得到细胞悬液并进行细胞计数,按照每孔90 μL的体积将细胞接种于96孔板中,在5% CO、37 ℃条件下的细胞培养箱中培养过夜待其细胞贴壁后,加入10 μL含药培养基,使得药物终浓度为100、50、20、10、5、2.5 μmol·L,每个浓度3个复孔。于5% CO、37 ℃细胞培养箱中培养48 h。每孔加入10 μL浓度为5 mg·mL的MTT溶液,放置在培养箱中继续培养4 h。弃掉上清液,每孔加入DMSO 160 μL,震荡15 min使得甲臜紫色结晶完全溶解。将96孔板按要求放置于酶标仪中,选择的波长为490 nm,在此条件下测定吸光度OD值。根据测得的OD值计算细胞抑制率。
抑制率(%)=[-]/×100。
2.2.2 Hoechst染色 收集对数生长期SH-SY5Y细胞、K562细胞、Hel细胞,重悬得到细胞悬液并进行细胞计数,均匀铺于6孔板中,在5% CO、37 ℃条件下的细胞培养箱中培养待其贴壁,细胞密度长至70%~80%时加入不同浓度的药物(终浓度为10、20、50 μmol·L),继续培养24 h,弃去培养液,先加入0.8 mL细胞染色缓冲液,再加入5 μL Hoechst染色液,最后加入5 μL PI染色液,混匀,4 ℃孵育25 min,弃去染色液,用PBS洗涤1次,在荧光显微镜下观察并拍照。对K562细胞和Hel细胞每个样品收集1×10~1×10个细胞于1.5 mL离心管内,离心,弃去上清液。细胞沉淀用0.8 mL细胞染色液重悬,先加入5 μL Hoechst染色液,再加入5 μL PI染色液,混匀,4 ℃孵育25 min,PBS洗涤1次,流式细胞仪检测。
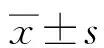
3 化合物结构鉴定结果
化合物无色油状液体,ESI-MS:447 [M + Na],分子式CHO。H-NMR(600 MHz, CDCl): 5.15/5.21(t,=3.6 Hz, 1H, H-12), 1.10(s, 3H, H-23), 1.06(s, 3H, H-24), 1.08/1.07(s, 3H, H-25), 1.06/1.02(s, 3H, H-26), 1.08/1.15(s, 3H, H-27), 0.81/0.84(s, 3H, H-28), 0.80/0.87(s, 3H, H-29), 0.92/0.87(s, 3H, H-30);C-NMR(150 MHz, CDCl): 218.02(C-3), 145.43/139.88(C-13), 124.36/ 121.67(C-12), 59.30/47.62(C-18), 55.41(C-5), 47.59/47.47(C-4), 47.08/47.03(C-9), 46.94/39.85(C-19), 42.39(C-22), 42.01/41.66(C-14), 40.16/39.94(C-8), 39.75/31.25(C-20), 39.65/39.46(C-1), 37.27/36.84(C-10), 34.88/31.40(C-21), 34.38(C-2), 33.95/32.68(C-17), 33.49/17.64(C-29), 32.62/32.33(C-7), 28.94/28.58(C-28), 28.24(C-15), 27.09/26.75(C-16), 26.64/26.29(C-23), 26.04/23.71(C-27), 23.85/23.81(C-11), 23.35/21.67(C-30), 21.55(C-24), 19.82(C-6), 16.99/16.89(C-26), 15.63/15.39(C-25)。以上数据与 Quintǎo等(2014)报道一致,故鉴定该化合物为,-amyrenone。

图 1 化合物1-12结构式Fig. 1 Structures of compounds 1-12
化合物白色固体粉末,ESI-MS:521 [M + Na],分子式CHO。H-NMR(600 MHz, CDCl): 5.28(s, 1H, H-12), 4.51(s, 1H, Hα-3), 2.83(dd,=13.7, 3.9 Hz, 1H, Hβ-18), 2.06(s, 3H, Me-OAc), 1.27(s, 3H, Me), 1.14(s, 3H, Me), 0.95(d,=8.7 Hz, 6H, 2Me), 0.94(s, 3H, Me), 0.92(s, 3H, Me), 0.76(s, 3H, Me);C-NMR(150 MHz, CDCl): 184.49(C-28), 171.08(C=O acetate), 143.61(C-13), 122.54(C-12), 80.94(C-3), 55.29(C-5), 47.55(C-9), 46.56(C-19), 45.83(C-17), 41.53(C-14), 40.88(C-15), 39.27(C-8), 38.06(C-1), 37.69(C-4), 36.99(C-10), 33.79(C-21), 33.07(C-30), 32.51(C-7), 32.44(C-22), 30.67(C-20), 28.04(C-23), 27.66(C-15), 25.92(C-27), 23.59(C-29), 23.52(C-2), 23.39(C-16), 22.85(C-11), 21.32,(CH-acetate), 18.17(C-6), 17.18(C-26), 16.66(C-24), 15.39(C-25)。以上数据与 Carvalho和Seita(1993)报道一致,故鉴定该化合物为3-acetoxyolean-12-en-28-oic acid。
化合物白色固体粉末,ESI-MS:341 [M + Na],分子式CHO。H- NMR(600 MHz, CDCl): 5.22(dd,=12.0, 2.3 Hz, 1H, H-20), 4.15(d,=12.0 Hz, 1H, H-20), 2.23~0.83(m, 27H, -CH);C-NMR(150 MHz, CDCl): 175.57(C-19), 78.06(C-16), 72.97(C-20), 56.75(C-15), 50.13(C-5), 49.22(C-9), 47.16(C-13), 43.77(C-8), 41.97(C-10), 39.60(C-14), 38.69(C-7), 37.66(C-4), 36.91(C-3), 24.96(C-12), 23.48(C-17), 22.09(C-18), 21.37(C-6), 19.91(C-2), 16.47(C-11)。以上数据与 Yu等( 1992)报道一致,故鉴定该化合物为antriptolactone。
化合物淡黄色固体粉末,ESI-MS:219 [M + Na],分子式CHO。H-NMR(600 MHz, CDOD): 7.53(t,=8.5 Hz, 1H, H-6′), 7.50(s, 1H, H-2′), 6.82(d,=8.2 Hz, 1H, H-5′), 3.91(m, 2H, H-3), 3.86(s, 3H, OCH), 3.10(m, 2H, H-2);C-NMR(150 MHz, CDOD): 198.30(C-1), 152.07(C-4′), 147.71(C-3′), 129.18(C-1′), 123.36(C-6′), 114.43(C-5′), 110.47(C-2′), 57.54(C-3), 54.98(OCH), 40.26(C-2)。以上数据与 Fu等(2008)报道一致,故鉴定该化合物为-hydroxypropioquaiacone。
化合物黄色固体粉末,ESI-MS:177 [M-H],分子式CHC。H-NMR(600 MHz, CDCl): 9.54(t,=6.5 Hz, 1H, H-3), 7.37~7.31(m, 1H, H-2′), 7.04(dd,=8.2, 1.9 Hz, 1H, H-6′), 7.00(d,=1.9 Hz, 1H, H-5′), 6.88(dd,=11.6, 7.4 Hz, 1H, H-1), 6.52(dd,=15.8, 7.8 Hz, 1H, H-2), 3.87(d,=4.2 Hz, 3H, OCH);C-NMR(150 MHz, CDCl): 194.10(C-3), 153.75(C-3′), 149.35(C-4′), 147.27(C-1′), 126.43(C-2), 126.08(C-1), 124.15(C-6′), 115.18(C-5′), 109.77(C-2′), 55.97(OCH)。以上数据与 Wang等( 2012)报道一致,故鉴定该化合物为3-(4-hydroxy-3-methoxyphenyl)-propenal。
化合物白色固体粉末,ESI-MS:167 [M-H],分子式CHO。H-NMR(600 MHz, CDOD): 6.72(d,=1.7 Hz, 1H, H-2), 6.63(d,=8.0 Hz, 1H, H-6), 6.57(dd,=8.0, 1.8 Hz, 1H, H-5), 3.75(s, 3H, OCH), 3.63(t,=7.2 Hz, 2H, H-2′), 2.65(t,=7.1 Hz, 2H, H-1′);C-NMR(150 MHz, CDOD): 147.44(C-3), 144.48(C-4), 130.44(C-1), 121.01(C-6), 114.72(C-5), 112.29(C-2), 63.15(C-2′), 54.96(OCH), 38.44(C-1′)。以上数据与Liu和Luo(2012)报道一致,故鉴定该化合物为3-methoxy-4-hydroxy phenylethanol。
化合物白色无定性粉末,ESI-MS:151 [M-H],分子式CHO。H-NMR(600 MHz, CDOD): 9.68(s, 1H, CHO), 7.37(d,=6.5 Hz, 2H, H-2, 6), 6.89(d,=8.6 Hz, 1H, H-5), 3.86(s, 3H, OCH);C-NMR(150 MHz, CDOD): 191.43(C-7), 153.38(C-4), 148.25(C-3), 128.94(C-1), 126.66(C-6), 115.17(C-5), 109.73(C-2), 54.99(C-8)。以上数据与Kwon等(2001)报道一致,故鉴定该化合物为vanillin。
化合物白色无定性粉末,ESI-MS:185 [M + H],分子式CHO。H-NMR(600 MHz, CDOD): 6.01(s, 2H, H-2, 6), 3.68(s, 6H, 3, 5-OCH), 3.58(s, 3H, 4-OCH);C-NMR(150 MHz, CDOD): 154.04(C-3, 5), 153.56(C-1), 130.74(C-4), 92.54(C-2, 6), 59.92(4-OCH), 54.98(3, 5-OCH3)。以上数据与柳庆龙等(2017)报道一致,故鉴定该化合物为3, 4, 5-三甲氧基苯酚。
化合物白色固体粉末,ESI-MS:137 [M-H],分子式CHO。H-NMR(600 MHz, CDOD): 7.76(2H, d,= 8.5 Hz, H-2, 6), 6.74(2H, d,= 8.5 Hz, H-3, 5);C-NMR(150 MHz, CDOD): 168.86(COOH), 161.88(C-4), 131.66(C-2, 6), 121.34(C-1), 114.71(C-3, 5)。以上数据与王洪平等(2013)报道一致,故鉴定该化合物为对羟基苯甲酸。
化合物淡黄色固体粉末,ESI-MS:123 [M + H],分子式CHO。H-NMR(600 MHz, CDOD): 9.66(s, 1H, CHO), 7.67(d,= 8.7 Hz, 2H, H-2, 6), 6.82(d,=8.6 Hz, 2H, H-3, 5);C-NMR(150 MHz, CDOD): 191.52(CHO), 163.79(C-4), 132.11(C-2, 6), 128.87(C-1), 115.53(C-3, 5)。以上数据与钱群刚等(2019)报道一致,故鉴定该化合物为对羟基苯甲醛。
化合物淡黄色固体粉末,ESI-MS:153 [M-H],分子式CHO。H-NMR(600 MHz,CDOD): 6.97(s, 1H, H-5), 6.78(s, 2H, H-3, 6), 4.53(s, 2H, H-1′), 3.85(s, 3H, OCH);C-NMR(150 MHz, CDOD): 147.56(C-3), 145.54(C-5), 132.84(C-1), 119.71(C-4), 114.59(C-2), 110.73(C-6), 63.93(C-7), 54.95(OCH)。以上数据与Challice等(1980)报道一致,故鉴定该化合物为vanillyl alcohol。
化合物黄色固体粉末,ESI-MS:191 [M+Na],分子式CHO。H-NMR(600 MHz, CDCl): 5.88(s, 2H, H-3, 5), 3.84(s, 6H, OCH×2);C-NMR(150 MHz, CDCl): 176.70(C-1), 186.48(C-4), 157.33(C-2, 6), 107.43(C-3, 5), 56.50(OCH×2)。以上数据与Kwon等(2001)报道一致,故鉴定该化合物为2, 6-dimethxy-1, 4-benzoquinone。
4 生物活性测试结果
4.1 用MTT法筛选化合物活性
本研究首先对分离得到的化合物进行抗肿瘤活性筛选。采用SH-SY5Y细胞株、K562细胞株、Hel细胞株检测化合物的抗肿瘤作用,表1结果表明,给药浓度为50 μmol·L时化合物对K562细胞株和Hel细胞株具有很强的抑制作用,对SH-SY5Y细胞株具有较强的抑制作用。由于化合物给药浓度50 μmol·L时,SH-SY5Y细胞株、K562细胞株、Hel细胞株均具有很强的抑制作用,因此对其IC值进行了测定(阳性药为甲氨蝶呤水合物,给药浓度为1 mg·L),结果显示化合物对SH-SY5Y细胞株、K562细胞株、Hel细胞株均有较强的抑制率,IC值分别为(35.6±2.8)、(28.8±0.5)、(14.3±0.9)μmol·L。
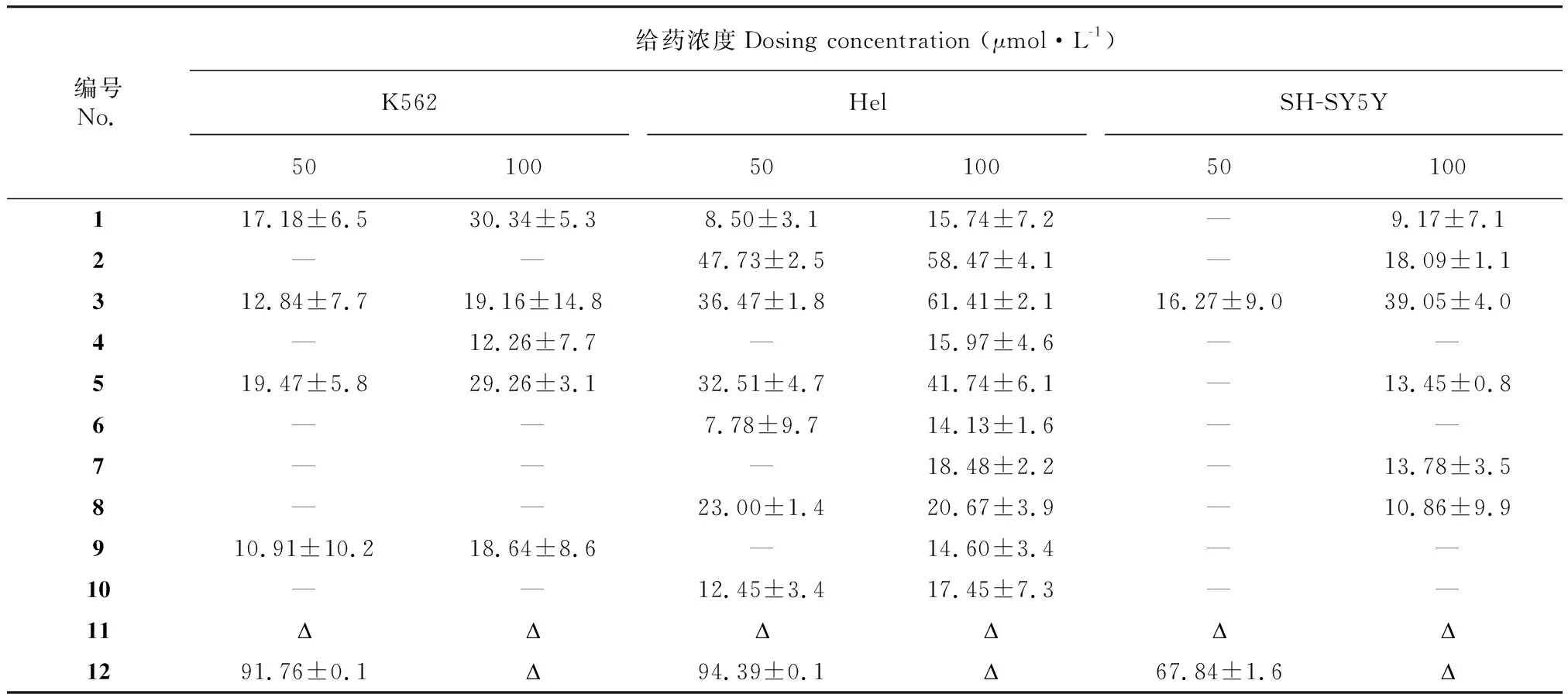
表 1 化合物1-12在不同给药浓度下对各种肿瘤细胞系的抑制率 (单位:%)Table 1 Inhibition rates of compounds 1-12 against various cancer cell lines at different dosing concentrations (Unit: %)
4.2 Hoechst染色
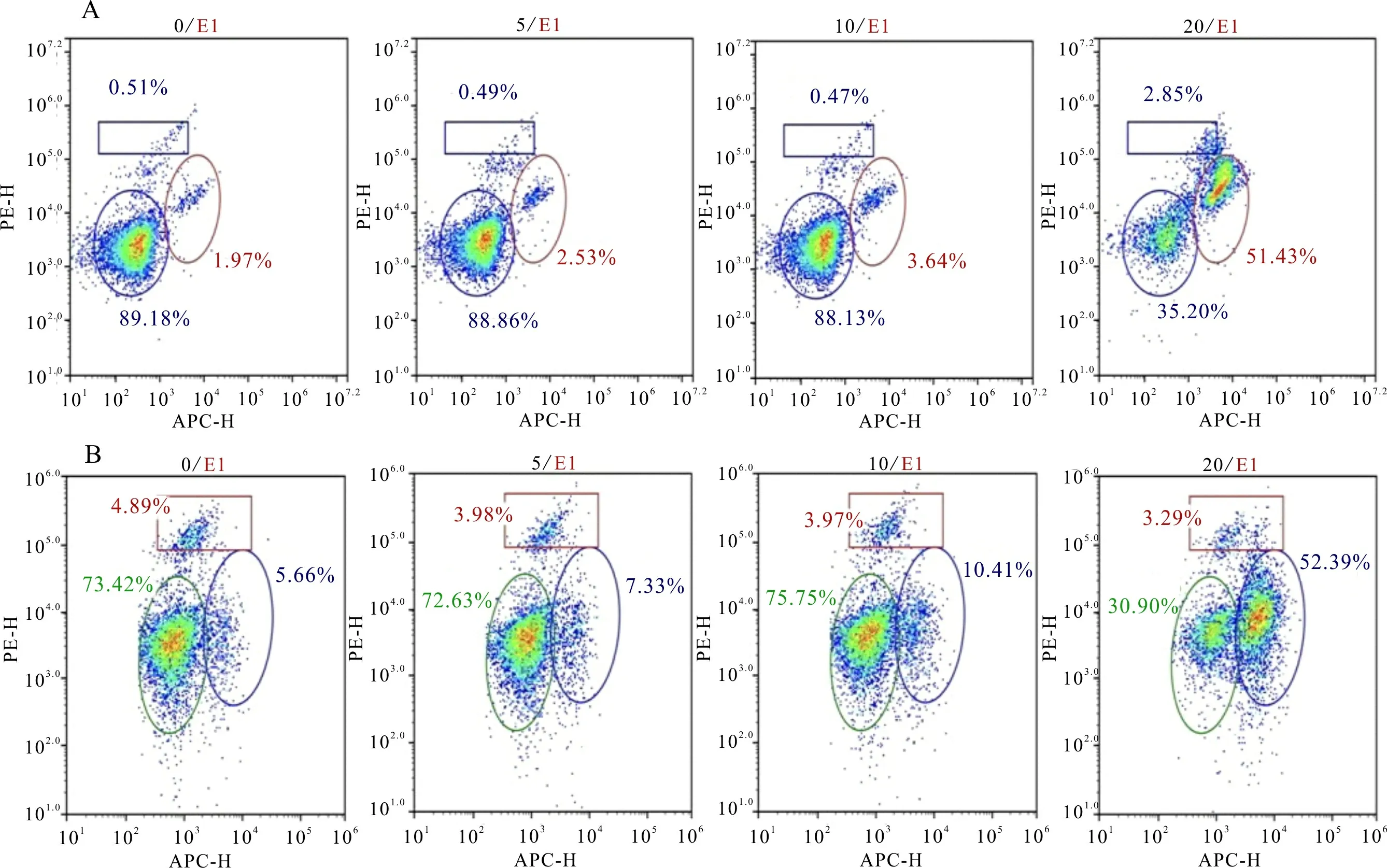
为进一步检测化合物的促凋亡作用,我们分别对不同浓度化合物作用的细胞用细胞凋亡荧光Hoechst 33344/PI双染试剂盒进行了染色处理,SH-SY5Y细胞株为贴壁细胞,染色后用荧光显微镜拍摄染色剂对细胞核的染色情况。图2结果显示,与空白组相比,给药组细胞皱缩变圆、核膜破裂、核质流出,且具有明显的剂量依赖性。由于K562细胞株和Hel细胞株为半贴壁细胞,其染色后难以用荧光显微镜拍出清晰的图片,因此采用流式细胞仪检测其凋亡情况。从图3和图4的结果可以看出,与空白组相比,随着化合物浓度的增加,两种细胞凋亡比例也随之增加,表明化合物可以促进2种细胞的凋亡,且该作用和浓度呈剂量依赖关系。

1为空白组; 2,3,4的给药浓度分别为10、20、50 μmol·L-1。1 in the figure is the blank group; Administration concentrations of 2, 3, and 4 are 10, 20 and 50 μmol·L-1, respectively.图 2 SH-SY5Y细胞在化合物12作用下Hoechst荧光染色图Fig. 2 Hoechst fluorescence staining image of SH-SY5Y cells under the action of Compound 12
A. Hel细胞在化合物12作用下的流式检测图; B. K562细胞在化合物12作用下的流式检测图。0、5、10、20分别代表药浓度为0、5、10、20 μmol·L-1,下同,其中E1为进样细胞中的活细胞,PE和APC分别代表藻红蛋白与别藻蓝蛋白,H代表电脉冲信号高度。A. The flow cytometry diagram of Hel cells under the action of compound 12; B. The flow cytometry diagram of K562 cells under the action of Compound 12. 0, 5, 10, and 20 respectively represent the drug concentration of 0, 5, 10, 20 μmol·L-1, the same below, where E1 is the live cell in the injection cell, PE and APC represent phycoerythrin and allophycocyanin, H represents the height of the electrical pulse signal.图 3 Hel细胞和K562细胞在化合物12作用下流式检测图Fig. 3 Flow cytometric image of Hel cell and K562 cell under the action of Compound 12
图 4 不同浓度药物对两种细胞的凋亡柱状图Fig. 4 Histogram of apoptosis of two kinds of cells with different concentrations of drugs
5 讨论与结论
本研究从雷公藤醇提物中共分离鉴定了醌类化合物1个,萜类化合物3个以及酚酸类化合物8个,并对这些化合物进行了抗肿瘤活性筛选发现,化合物、、、对不同肿瘤细胞均呈现出一定的抑制活性,其中醌类化合物的抗肿瘤活性最为显著,对SH-SY5Y细胞株、Hel细胞株、K562细胞株的IC值分别为35.6、14.3、28.8 μmol·L(文献值IC=25.5 μmol·L)(刘睿等, 2005)。这是化合物首次报道对SH-SY5Y细胞株和Hel细胞株的增殖影响,其作用机制还有待进一步确认。
雷公藤的生物活性研究主要集中于二萜、三萜和生物碱,大量研究表明,这些活性物质均有一定的毒性,其中二萜类成分毒性最大,如雷公藤甲素对人乳腺癌、结肠癌、卵巢癌均有明显的抑制作用,特别是对卵巢癌,平均半数生长(G150)显著低于紫杉醇(Guan et al., 1989),但其对肝细胞却具有明显的损伤作用且具有一定的剂量依赖性(Zhang et al., 2016);雷公藤红素的抑瘤率为65%~93%,超过了紫杉醇(翟边,2016),而雷公藤红素对心血管系统却有着潜在的危害。这一原因大大限制了雷公藤在临床上的推广与应用。本研究发现的醌类化合物具有较强的抗肿瘤活性,而关于该植物中醌类化合物的生物活性尚未见报道。这一研究表明了雷公藤中的醌类化合物在抗神经母瘤细胞方面具有很大的潜力,这为后续雷公藤中其他活性成分的开发提供了实验基础。

