酪蛋白-葡萄糖美拉德反应产物抗氧化活性研究
黄建蓉,李秋萌,姚逸澄,宋丰林,徐金瑞,王志江,侯方丽
(广东药科大学 食品科学学院,广东 中山 528453)
美拉德反应在食品加工中广泛存在,除赋予产品独特的色、香、味外,还能产生有益的生物活性物质,增强食品的抗氧化活性[1-3]。面包、蛋糕、饼干等焙烤食品在高温烘焙阶段发生美拉德反应,对于产品的色泽和风味发挥着重要作用,其反应产物的抗氧化活性值得关注。焙烤食品生产常用牛乳或乳粉、果葡糖浆等为原料,其中所含的酪蛋白与果糖或葡萄糖在高温条件下即可以发生美拉德反应,本文研究了在常用的烘焙工艺条件下,酪蛋白-葡萄糖体系发生美拉德反应得到的产物的抗氧化活性,并与茶多酚和芦丁的抗氧化活性进行比较,可为进一步探讨焙烤食品的抗氧化活性提供理论依据。
1 材料与方法
1.1 试剂
酪蛋白(分析纯):广东环凯微生物科技有限公司;葡萄糖(分析纯):天津市永大化学试剂有限公司;茶多酚(纯度≥98%)、芦丁(纯度≥95%)、2,4,6-三(2-吡啶基)-1,3,5-三嗪(TPTZ,纯度≥98.5%):北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH):东京化成工业株式会社;三氯化铁、硫酸亚铁、无水乙酸钠、无水乙醇(均为分析纯):天津市大茂化学试剂厂;冰醋酸(分析纯):天津市富宇精细化工有限公司;盐酸(分析纯):广州化学试剂厂。
1.2 仪器与设备
SC-80C全自动色差计 北京康光光学仪器有限公司;AE124C电子分析天平 上海舜宇恒平科学仪器有限公司;DGX-9053B-2干燥箱 上海福玛实验设备有限公司;SHZ-Ⅲ循环水式真空泵 上海亚荣生化仪器厂;SB-25-12DT超声波清洗机 宁波新芝生物科技股份有限公司;UV-1800紫外可见分光光度计、RF-5301PC荧光分光光度计 日本岛津公司。
1.3 方法
1.3.1 酪蛋白-葡萄糖美拉德反应提取物制备
按照3∶1的比例称取酪蛋白和葡萄糖,并按二者总质量的15%加入蒸馏水混合均匀,以模拟真实焙烤食品体系烘烤前的配料组成状态,置于蒸发皿中,在130 ℃烘烤30 min。反应结束后取出冷却至室温,用SC-80C色差计的反射样品测定模式检测反应前后体系的色差值L*、a*、b*,并根据下式计算总色差△E。
△E=(△L*2+△a*2+△b*2)1/2。
式中:L*表示亮度数值;a*表示红色到绿色两种原色之间的变化区域;b*表示黄色到蓝色两种原色之间的变化区域;△L*表示明度差异;△a*表示红/绿差异;△b*表示黄/蓝差异。
酪蛋白-葡萄糖反应混合物加入适量蒸馏水或60%乙醇超声提取10 min,然后全部转移至容量瓶中,按混合物质量∶定容体积为1∶10的比例用相应溶剂定容,经过滤分别得到酪蛋白-葡萄糖美拉德反应产物(MRPs)水提物溶液和醇提物溶液。取一定量的提取物溶液真空冷冻干燥至恒重,称量计算得到溶液质量浓度(mg/mL)。
1.3.2 紫外可见吸收光谱分析
紫外可见吸收光谱的测定参考文献[4]的方法并略作调整。酪蛋白-葡萄糖MRPs水提物溶液稀释5倍,醇提物溶液稀释10倍,分别以蒸馏水和60%乙醇为基线,在250~500 nm范围扫描溶液紫外可见吸收光谱,此为反应后光谱。以未经烘烤的酪蛋白-葡萄糖体系为对照,按1.3.1中制备MRPs提取物溶液的方法制备对照液,同法扫描紫外可见吸收光谱,即为反应前光谱。
1.3.3 荧光光谱分析
荧光光谱的测定参考文献[5]的方法并略作调整。设置荧光激发和发射狭缝宽度均为5 nm,荧光激发波长345 nm,扫描360~560 nm发射光谱。按1.3.2项方法制备光谱扫描用样液,分别得到反应前后MRPs水提取和醇提物荧光光谱图。
1.3.4 总抗氧化能力测定——FRAP法
参考文献[6]的方法并略作调整。将0.2 mol/L pH 3.6的醋酸盐缓冲液、10 mmol/L TPTZ溶液、20 mmol/L FeCl3溶液按10∶1∶1(体积比)混合,搅拌均匀得FRAP工作液。
FeSO4标准曲线的绘制:将1 mmol/L 的FeSO4溶液稀释5倍,分别取0.2,0.4,0.6,0.8,1.0,1.2,1.4,1.6,1.8 mL于9支试管中,用蒸馏水补至2 mL;加入3 mL FRAP工作液,混匀;于37 ℃反应10 min,在593 nm 处测定吸光度。以FeSO4溶液浓度(mmol/L)为横坐标,吸光度为纵坐标,绘制FeSO4标准曲线。
MRPs水提物总抗氧化能力测定:将水提物原液分别稀释10,20,30,50,100倍,分别取2 mL于5支试管中,各加入3 mL FRAP工作液,混匀;于37 ℃反应10 min,在593 nm 处测定吸光度。将吸光度代入FeSO4标准曲线计算得到FeSO4浓度(mmol/L),以FeSO4浓度数值表示FRAP值。FRAP值越大,总抗氧化能力越强。
茶多酚总抗氧化能力测定:配制浓度为26.7 mg/mL的茶多酚水溶液,分别稀释20,25,30,35,40,45,50倍,同法测定茶多酚FRAP值。
MRPs醇提物总抗氧化能力测定:将醇提物分别稀释10,20,30,50,100倍,同法测定醇提物FRAP值。
芦丁总抗氧化能力测定:用60%乙醇配制浓度为25 mg/mL的芦丁溶液,分别稀释2,2.5,3,3.5,4,4.5,5倍,同法测定芦丁FRAP值。
1.3.5 DPPH自由基清除能力测定
参考文献[7-8]的方法并略作调整。将MRPs水提物分别稀释2.5,5,8,10,15,20倍,加上原液一共7个浓度梯度。各取1 mL至7支具塞试管中,加入2 mL 0.1 mmol/L DPPH·乙醇溶液,摇匀,避光反应30 min,于517 nm波长处测吸光度,记为Ai。另取7支试管,分别加入1 mL 7个浓度梯度的样液和2 mL无水乙醇,摇匀,于517 nm波长处测吸光度,记为Aj。另取1支试管,加入1 mL蒸馏水和2 mL 0.1 mmol/L的DPPH·乙醇溶液,摇匀,于517 nm波长处测吸光度,记为A0。用下式计算DPPH·清除率。
清除率(%)=[A0-(Ai-Aj)]/A0×100。
茶多酚DPPH·清除率的测定:将26.7 mg/mL茶多酚分别稀释5,8,10,20,25,30,40,50,100倍,加上原液一共10个浓度梯度。同法测定和计算茶多酚对DPPH·的清除率。
MRPs醇提物DPPH·清除率的测定:将MRPs醇提物分别稀释2.5,5,8,10,15,20倍,加上原液一共7个浓度梯度。同法测定和计算MRPs醇提物对DPPH·的清除率。
芦丁DPPH·清除率的测定:将25 mg/mL的芦丁60%乙醇溶液,分别稀释1.67,2.5,5,25,50,250,500倍,加上原液一共8个浓度梯度。同法测定和计算芦丁对DPPH·的清除率。
2 结果与分析
2.1 酪蛋白-葡萄糖美拉德反应体系建立
2.1.1 酪蛋白-葡萄糖体系反应前后色泽变化
酪蛋白-葡萄糖(3∶1)反应前色差参数L*=86.15、a*=-0.83、b*=10.33,经过130 ℃烘烤30 min后,色差参数L*=60.02、a*=14.99、b*=33.31,反应后明度值L*明显减小,红绿值a*、黄蓝值b*明显增大,反应后与反应前色差△E=31.34。烘烤对美拉德反应的发生有重要作用,食品色泽的改变是美拉德反应产物生成的宏观体现,色差参数值的变化可以作为判断美拉德反应进程的依据之一。在该焙烤条件下,酪蛋白与葡萄糖发生了明显的美拉德反应,使得体系褐变,颜色发生了明显变化。
2.1.2 美拉德反应产物提取液制备
按照1.3.1项方法,得到MRPs水提液浓度为25.55 mg/mL,MRPs醇提液浓度为25.90 mg/mL。
2.2 酪蛋白-葡萄糖美拉德反应产物光谱分析
2.2.1 紫外可见吸收光谱
研究表明[9-11],大多数美拉德反应在紫外区294 nm附近都有特征光吸收,而且294 nm光吸收在颜色形成前出现,此处的吸收是美拉德反应中间阶段通过 Strecker裂解产生的酮类、醛类等无色小分子中间物,这些物质作为美拉德反应的中间产物与荧光化合物相比稳定很多,是褐色素形成的前体,其主要为吡喃、呋喃、吡啶、糠醛等及其衍生物,此处的吸光强度可间接反映无色小分子物质的产生情况,吸光度值越大,中间产物越多。由图1可知,MRPs水提物和醇提物均在289 nm处出现吸收峰,在此波段下出现强吸收,说明该体系发生了糖类脱水分解并且发生裂解而产生一些酮类及醛类无色小分子。在360~490 nm区间的光吸收主要是由美拉德反应高级阶段产生的类黑素引起,在420 nm处吸光度值的变化可用来表征类黑素生成程度。反应后体系在420 nm处吸光度增加,说明美拉德反应高级阶段产物的生成,吸光度的变化体现出反应的褐变程度。

图1 酪蛋白-葡萄糖美拉德反应前后紫外可见吸收光谱
2.2.2 荧光光谱
一些在美拉德反应过程中产生的小分子荧光物质,其典型光谱特征为激发波长340~370 nm,发射波长420~440 nm[12]。美拉德反应体系中荧光强度与紫外光吸收强度的发展表现为不同的动力学行为,所以荧光小分子物质被认为是不同于具有紫外光吸收物质的小分子产物,荧光中间小分子体比无色中间体反应活性更高,更易参与高级阶段合成类黑素等物质。由图2可知,在激发波长为345 nm时,MRPs水提物和醇提物最强荧光发射波长在426 nm处,符合美拉德反应生成荧光物质的特征。

图2 酪蛋白-葡萄糖美拉德反应前后荧光光谱
与反应前的水提物相比,反应前醇提物出现了较强荧光,原因在于乙醇和水作为常用的有机溶剂,本身都不具有荧光特性,但当乙醇分子与水分子结合后会通过氢键形成闭合或者不闭合的链式结构,从而具有了荧光特性[13-14],因此在413 nm处出现了60%乙醇水溶液的荧光峰。由于美拉德反应产物具有荧光特性,反应后提取物荧光强度明显增大,反应后醇提物在413 nm处的荧光峰消失,荧光峰出现在美拉德产物特征峰426 nm的位置。
2.3 美拉德反应产物抗氧化活性
2.3.1 美拉德反应产物总抗氧化能力
总抗氧化能力测定FeSO4标准曲线见图3。以y表示593 nm处的吸光度,x表示FeSO4浓度(mmol/L),得到线性回归方程y=6.415x+0.1249(R2=0.9952),在0.02~0.18 mmol/L范围内吸光度与FeSO4浓度呈良好的线性关系。
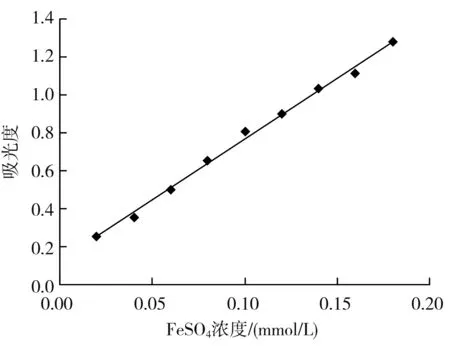
图3 FeSO4标准曲线
由图4可知,MRPs水提物、茶多酚、MRPs醇提物和芦丁的FRAP值均随着各自浓度的增加而增大,并呈良好的线性关系,以y表示FRAP值,x表示样液浓度(mg/mL),回归方程分别为y=0.0506x+0.0116(R2=0.9969),y=1.1305x+0.044(R2=0.9949),y=0.0627x+0.015(R2=0.9958),y=0.0862x+0.0089(R2=0.9668)。要达到FRAP值为0.11,MRPs水提物、茶多酚、MRPs醇提物和芦丁所需浓度分别为1.945,0.0584,1.515,1.173 mg/mL。在1 mg/mL浓度下,MRPs水提物和MRPs醇提物的FRAP值分别为0.062和0.078。MRPs总抗氧化能力与茶多酚差距较大,与芦丁较为接近,醇提物的总抗氧化能力略强于水提物。

图4 美拉德反应产物总抗氧化能力
2.3.2 美拉德反应产物对DPPH自由基的清除能力
由图5可知,MRPs水提物、MRPs醇提物和芦丁对DPPH自由基的清除率均随着各自浓度的增加而增大,在低浓度范围内增幅较大,在高浓度范围内增幅变缓,并呈良好的对数相关关系,用y表示DPPH自由基清除率(%),x表示样液浓度(mg/mL),得到回归方程分别为y=23.531ln(x)+18.522(R2=0.987),y=21.091ln(x)+22.58(R2=0.9884),y=13.212ln(x)+74.559(R2=0.9468),由此计算IC50分别为3.810,3.670,0.156 mg/mL。茶多酚对DPPH自由基清除能力在0.0534~0.1335 mg/mL浓度范围内呈线性增长,线性回归方程为y=906.54x-40.234(R2=0.9861),浓度在0.1335~2.67 mg/mL范围内,清除率几乎不变,约为80%。根据线性回归方程计算得到茶多酚IC50为0.0995 mg/mL。MRPs对DPPH自由基的清除能力与茶多酚和芦丁差距较大,醇提物对DPPH自由基的清除能力略强于水提物。
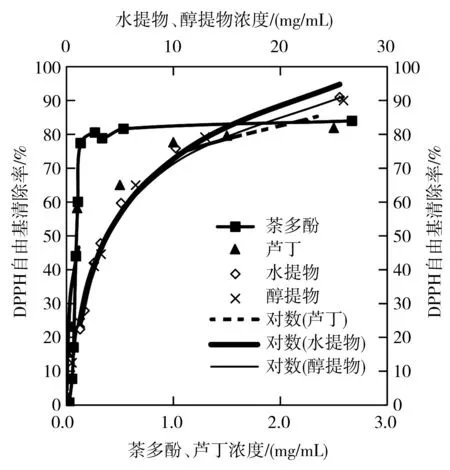
图5 美拉德反应产物对DPPH自由基清除作用
3 结论
酪蛋白-葡萄糖在烘焙条件下发生美拉德反应,体系色泽发生明显变化,美拉德反应产物水提物和60%乙醇提取物的紫外可见分光光谱图在420 nm处吸光度比反应前增大,在289 nm处出现吸收峰,荧光发射光谱峰值出现在426 nm处,符合美拉德反应生成物的特征。美拉德反应产物总抗氧化能力和DPPH自由基清除能力与浓度均有量效关系,分别呈线性相关关系和对数相关关系,醇提物的总抗氧化能力和DPPH自由基清除能力均略强于水提物。

