帕金森病运动症状治疗药品浅析及开发策略探讨
张 雯,闫志猛,封 静,陈 超
(山东省药学科学院,山东省化学药物缓释制剂工程技术研究中心,国家药监局药物制剂技术研究与评价重点实验室,山东省黏膜与皮肤给药技术重点实验室,山东 济南 250101)
帕金森病(Parkinson′s disease,PD)是一种常见于中老年人的神经系统退行性疾病,以震颤、肌强直、动作迟缓、姿势平衡障碍的运动症状和睡眠障碍、认知和精神障碍等非运动症状为临床表现[1],其高病残率严重威胁中老年人的身心健康。据统计,欧美60岁以上PD患病率达1 %,80岁以上超过4 %;我国65岁以上人群患病率为1.7 %,预计2030年我国PD患病人数将上升至500万,几乎占全球患病人数的一半[2]。目前尚未发现能逆转或治愈PD的确切药物或疗法,临床上均以对症治疗为主,辅以康复治疗,其中药物治疗是最主要且首选的治疗手段[3]。PD运动症状的常用治疗药物有左旋多巴、多巴脱羧酶抑制剂(dopa-decarboxylase inhibitor,DDCI)、多巴胺受体激动剂(dopamine receptor agonist,DA)、单胺氧化酶B型抑制剂(monoamine oxidase type B inhibitor,MAO-BI)和儿茶酚-O-甲基转移酶抑制剂(catechol-O-methyl transferase inhibitor,COMTI)等。
1 左旋多巴
PD症状主要因脑内黑质纹状体发生病变,导致多巴胺能神经元中的多巴胺含量降低所致。左旋多巴通过在脑内脱羧成多巴胺,补充纹状体中多巴胺的含量,从而改善PD症状。左旋多巴是治疗PD的标准疗法,是PD药物治疗中最有效的对症治疗药物[1]。事实上,仅有1 %的左旋多巴可通过血脑屏障进入中枢,其余大部分均在脑外代谢脱羧成多巴胺,后者还会刺激外周多巴胺受体引起多方面的副作用,起效缓慢,故临床上较少单独使用左旋多巴,多以左旋多巴/多巴脱羧酶抑制剂的组合形式给药[4]。
随着疾病进展和治疗时间延长,接受左旋多巴治疗的PD患者可能再次出现或突然恢复僵硬、强直和震颤,称为药物剂量之间的“关”期。长期应用左旋多巴也可能导致不自主、不受控制的运动,称为运动障碍。运动障碍发作、正常运动和“关”期发作之间突然和不可预测的转换会严重影响PD患者的生活质量[5]。
2018年以来在欧美上市的左旋多巴干粉吸入剂(Inbrija®,Acorda),经肺部给药,可在PD患者“关”期补充额外的左旋多巴,快速改善“关”期状态,减少每日“关”期时间,同时并不增加运动障碍的发生率[6]。Inbrija®自上市来销售收入逐年上升,2021年达到0.296亿美元[7],目前国内暂无企业仿制该品种。
2 DDCI
DDCI(卡比多巴、苄丝肼)不能通过血脑屏障,单独应用无效,与左旋多巴联用可阻止外周多巴胺的形成,增加其进入中枢神经系统的量,加强疗效并减少外周副作用[5]。复方左旋多巴制剂可作为晚发型PD患者和运动功能改善需求高的较年轻患者的治疗药物首选[1]。
2.1 左旋多巴/卡比多巴
国内在市的有复方卡比多巴片(西莱美®,精华)和卡左双多巴缓释片(息宁®,默沙东),普通片相对起效快,而缓释片维持时间相对长,但起效慢、生物利用度较低[1]。2015年美国上市的左旋多巴/卡比多巴缓释胶囊(Rytary®,Amneal)为缓控释微丸制剂,用药频率仍为3次/d,其目的不是提高患者的用药顺应性,而是通过平稳给药显著缩短“关”期时间,减少症状波动[8]。2021年Rytary®的销售收入约为1.7亿美元[9],国内暂无企业仿制该品种。
晚期特发性PD伴随剧烈的运动波动,对口服治疗无反应,是进行性疾病,会长期使人衰弱,欧盟统计发病率约为0.24 ‰。卡比多巴/左旋多巴肠用混悬液(Duopa®,AbbVie)2001年在欧洲获批“孤儿药”,2015年、2016年相继在美国、日本获批,主要用于治疗晚期PD患者运动波动。Duopa®的给药系统为药械结合装置,即采用一个小输液泵直接将混悬液经胃部输送至十二指肠,药物缓慢释放可达16 h,能显著降低运动并发症和“关”期时间[10]。2021年Duopa®的销售收入达5.11亿美元[11],国内暂无企业仿制该品种。
2.2 左旋多巴/苄丝肼
多巴丝肼是左旋多巴与苄丝肼按4:1制成的复方制剂,在临床试验和治疗应用中已证明这一比例具有最佳疗效[4]。国内在市的有多巴丝肼胶囊(优多巴®等,益生源)、多巴丝肼片(美多芭®,罗氏)。多巴丝肼片/胶囊位居2020年国内重点省市公立医院抗PD药用药第二位,其中,美多芭®占据了98 %以上的用药份额,国产多巴丝肼胶囊约占2 %[12]。
3 DA
DA能模拟内源性多巴胺,通过刺激突触后多巴胺受体,减少自由基形成,保护存活的黑质神经元[3]。DA有麦角类和非麦角类两种类型,其中麦角类DA由于可能引起瓣膜病变的严重不良反应,临床已不主张使用,而主要推荐采用非麦角类,可单用或与左旋多巴联用治疗PD,并作为早发型患者病程初期的首选药物[1]。
3.1 普拉克索
普拉克索中的氨基苯并噻唑结构能选择性作用于多巴胺受体D2亚家族(包括3种亚型:D2、D3、D4),通过兴奋纹状体突触前D2、D3自身受体,减少多巴胺合成、释放和更新,从而减轻PD患者的运动障碍[13]。盐酸普拉克索由Boehringer Ingelheim开发,1997年在欧盟获批普通片(Sifrol®),后在美国、日本和中国上市了普通片和缓释片。普拉克索口服吸收迅速完全,绝对生物利用度高于90 %,普通片的最大血药浓度(Cmax)在服药后1~3 h出现,缓释片口服后大约6 h血浆浓度可达峰值,连续给药5 d内可达稳态血药浓度[14]。
盐酸普拉克索片位居2020年国内重点省市公立医院抗PD药用药第一位[12],是仿制大热品种。2018年以来共有4家国内药企获批普通片、10家国内药企获批缓释片,与进口原研药形成 “4+1”和“10+1”的竞争格局。
3.2 罗匹尼罗
盐酸罗匹尼罗由GlaxoSmithKline开发,是一种对D2/D3/D4具有高选择性非麦角类DA,也是FDA批准的第一个用于治疗不宁腿综合征(restless legs syndrome,RLS)的药物,和普拉克索同为治疗原发性RLS的一线用药[15]。国内在市的有盐酸罗匹尼罗片(枢复来®,植恩)和盐酸罗匹尼罗缓释片(力备®,GSK),均适用于与左旋多巴联用治疗原发性PD的症状和体征,缓释片还可用于左旋多巴疗效减退或治疗效果出现反复波动时(剂末现象或“开关”波动)。
3.3 罗替高汀
罗替高汀通过持续刺激D3/D2/D1受体,使脑复合物的尾状核-壳核的D3、D2和D1受体活化而产生抗PD作用。罗替高汀既可单用,也可与左旋多巴联用治疗早、晚期PD。罗替高汀首过效应非常强,口服生物利用度极低,UCB Pharma S.A将其开发成透皮贴剂(Neupro®),每日1贴即可持续24 h稳定血药浓度,使PD患者“关”期缩短,“开”期延长,并减轻运动障碍,特别适用于吞咽困难的患者[16]。目前国内在市药品仅有罗替高汀贴片(优普洛®,UCB),其2021年的全球销售收入为3.07亿欧元[17],暂无国内企业仿制该品种。
3.4 吡贝地尔
吡贝地尔为非麦角类选择性多巴胺D2、D3受体激动药,其作用时间长而稳定,可单独用于治疗早期PD,也可与左旋多巴联用治疗中、晚期PD。吡贝地尔能较好地控制患者运动症状及非运动症状,改善老年人智能缺陷所致的如注意力和记忆力下降等精神症状和睡眠状态[18]。目前国内在市药品仅有2018年获批进口的吡贝地尔缓释片(泰舒达®,Servier),位居2020年国内重点省市公立医院抗PD药用药第四位[12],2018年后无国内企业申报该品种。
3.5 阿扑吗啡
阿扑吗啡为强效D1、D2受体激动药,在中、晚期PD患者出现口服药物困难的情况时,可皮下注射阿扑吗啡。阿扑吗啡皮下注射液(Apokyn®,MDD)可在10 min内逆转“关”期症状,作用可持续长达2 h,最常见的不良反应是恶心和头晕,在给药前通常需要使用止吐剂(三甲苯甲酰胺)[19]。阿扑吗啡舌下膜(Kynmobi®,Sunovion)通过将药物直接输送到口腔表面的循环中来克服口服药物产生的严重首过效应。将膜置于舌下3 min时,薄膜溶解并释放药物,血药浓度达峰时间(Tmax)在0.5~1 h,可迅速缓解PD患者的“关”期症状,是按需治疗的又一选择[19]。与皮下注射一样,舌下膜含服前通常需要提前服用三甲苯甲酰胺以减少可能的恶心和呕吐。在“关”期发作患者中,舌下膜表现出较低的Cmax和相对生物利用度,但在10~30 mg剂量范围内表现出与皮下注射相似的AUC,由于用药方便,舌下含服比皮下注射更实用[20]。2021年Apokyn®和Kynmobi®的销售收入分别为0.992亿美元和2亿日元[21-22],国内暂无适应症为PD相关的阿扑吗啡在市药品。
4 MAO-BI
MAO-BI参与多巴胺的分解和代谢过程,抑制B型单胺氧化镁的活性,可提高脑内多巴胺浓度,且对神经元有保护作用[3]。MAO-BI可单独用于治疗PD,也可与左旋多巴复合制剂联合使用,能推迟PD患者运动并发症出现,且减少左旋多巴复合制剂的使用剂量。临床上主要推荐用于治疗早期PD患者,特别是早发型或初治PD,也可用于进展期PD患者的添加治疗[1]。
4.1 司来吉兰
一项对司来吉兰治疗PD有效性和安全性的Meta分析结果表明,司来吉兰在改善PD患者统一帕金森病评分量表(unified Parkinson’s disease rating scale,UPDRS)总评分,精神、行为和情绪评分(UPDRS I),日常生活能力评分(UPDRS II),运动评分(UPDRS III),韦氏综合评定量表(Webster)评分等方面均具有显著效果,也未提高不良事件发生率及病死率[23]。
2006年在美国上市的司来吉兰口崩片(Zelapar®,Bausch),采用Zydis冻干速溶技术,片剂可于数秒内在口腔内溶解并吸收进黏膜,无需吞咽或液体吞服,比传统制剂给药更快(Tmax:10~15 min vs 40~90 min),相对生物利用度更高。临床研究表明,Zelapar在2.5 mg剂量下观察到“关”期时间减少最显著,临床试验期间因其良好的耐受性和用药便利性,受到患者青睐[24]。国内在市药品有盐酸司来吉兰片和胶囊,在2020年国内重点省市公立医院抗PD药用药格局中,司来吉兰和雷沙吉兰分别占第五、第六位,两者用药份额占比均为4.6 %[12],国内目前无企业仿制。
4.2 雷沙吉兰
雷沙吉兰是第二代MAO-BI,与第一代司来吉兰化学结构相似,其效力比司来吉兰高3~15倍,且不产生苯丙胺类代谢物[25]。在改善运动并发症方面,雷沙吉兰相对于司来吉兰证据更充分,在多国指南中被列为运动并发症治疗临床有效性的A级证据[1]。国内临床研究结果表明,与司来吉兰相比,雷沙吉兰的临床疗效更好,安全性更高[26-27]。甲磺酸雷沙吉兰片已在国内在市3家,另有3家企业在申报,是仿制热门品种。
4.3 沙芬酰胺
沙芬酰胺为第三代水溶性小分子MAO-BI,对MAO-B的选择性远大于司来吉兰和雷沙吉兰,同时对MAO-B的抑制作用是可逆的,安全性更高[28]。沙芬酰胺吸收迅速,口服后约2~4 h达峰,绝对生物利用度约95 %,可用于中、晚期症状波动性PD治疗或辅助左旋多巴/卡比多巴治疗“关”期[29]。甲磺酸沙芬酰胺片(Xadago®,Zambon)2021年销售收入0.58亿欧元[30],作为原研药已在国内申报进口,目前国内暂未有沙芬酰胺的制剂上市。
4.4 唑尼沙胺
日本上市的唑尼沙胺口崩片(Trerief®,住友)适用于其他抗PD药物效果不足时用药,国内上市的唑尼沙胺片为抗癫痫用药,无治疗PD相关适应症。在单纯PD患者的临床获益性上,唑尼沙胺不具有明显优势,但对PD合并癫痫患者具备一定价值[31]。
5 COMTI
COMT能将约90 %的左旋多巴转化为3-O-甲基多巴,可与左旋多巴在血脑屏障的运输上竞争受体。COMTI能抑制外围左旋多巴代谢,从而增加左旋多巴到大脑的运输量,用于左旋多巴附加疗法,改善波动效应[31]。第一代托卡朋因具有潜在致命性、急性肝损害现已较少在临床使用[3]。
5.1 恩他卡朋
作为第二代选择性外周COMTI,恩他卡朋能有效抑制左旋多巴的3-O-甲基化,增加左旋多巴在中枢的生物利用度,从而提高左旋多巴的疗效,减少用量及服药次数,并改善左旋多巴长期治疗引起的运动波动,耐受性良好,安全性优于托卡朋[32]。
Orion Pharma相继开发了恩他卡朋片(Comtan®、Comtess®)和恩他卡朋双多巴片(Stalevo®)。在一项对运动波动患者进行的开放、平行和对照研究中,对比了Stalevo®和左旋多巴/卡比多巴/恩他卡朋三者合用的效果,在UPDRS评分、运动波动问卷及不良反应方面,两者没有明显区别,81 %患者更喜欢Stalevo®,原因在于其剂型恒定、使用简便、易于携带[33]。恩他卡朋片(珂丹®)和恩他卡朋双多巴片(达灵复®)均已在国内进口,两者分别占在2020年国内重点省市公立医院抗PD药用药第三和第八位,用药份额占比分别为10.2 %和2.3 %[12]。2021年Comtess®、Comtan®和Stalevo®销售额共0.95亿欧元[34],目前国内只有海南通用康力制药在申报恩他卡朋片,无企业申报恩他卡朋双多巴片。
5.2 奥匹卡朋
第三代COMTI奥匹卡朋是一种具亲水性的1,2,4-二唑类似物,3号位的NO修饰旨在提高其COMT抑制能力和降低细胞毒性,与托卡朋和恩他卡朋在化学结构式上有明显差异。对比恩他卡朋和安慰剂,奥匹卡朋能有效缩短“关”期时间,从而有效缓解左旋多巴治疗带来的波动效应,其在各项日常生活能力水平和非运动症状量表的评分方面暂未显现治疗差异[35]。原研Bial-Portela & Ca,S.A申报进口我国的奥匹卡朋胶囊未获批。
6 其他
6.1 金刚烷胺
盐酸金刚烷胺是一种N-甲基-D-门冬氨酸受体拮抗剂,主要作用机制是促进多巴胺释放,抑制多巴胺的再吸收,并可阻断谷氨酸兴奋性神经毒性作用,以及抗乙酰胆碱作用,可保护神经元。在临床中发现,大部分单独接受金刚烷胺治疗的患者中运动迟缓、肌肉强直症状得到不同程度改善,但对震颤的治疗效果相对较差[36]。
如前所述,长期使用左旋多巴引起的运动障碍是治疗PD的重大挑战。盐酸金刚烷胺缓释胶囊(Gocovri®,Adamas)是目前唯一获批用于治疗左旋多巴相关运动障碍的口服药物,推荐剂量为274 mg,每天睡前一次可提供持续一天的高水平金刚烷胺,用于治疗患者一天中会出现的运动障碍。在一项为期13周和25周的随机、双盲III期试验中,与安慰剂相比,每日一次274 mg的金刚烷胺缓释胶囊显著改善了左旋多巴引起的运动障碍,增加了无运动障碍并发的“开”期时间,减少了早上和全天内出现的伴随运动障碍的“开”期和“关”期时间[37-38]。Gocovri 2021年的销售额达0.716亿美元[21],国内目前无企业申报该品种。
盐酸金刚烷胺缓释片(Osmolex ER®,ADAMAS)由缓释核心和速释外层组成,缓释核心由渗透泵系统控制,其释放是由药物核心内容物和胃肠道液体之间的渗透梯度驱动的,在速释层溶解后药物输送基本保持恒定。Osmolex ER®每日早上用药一次,给药后约7.5 h达到血药浓度峰值,稳态下258 mg Osmolex ER®的暴露量与每日两次129 mg金刚烷胺速释糖浆的生物等效[39]。一项135人参加的临床试验结果表明,258 mg Osmolex ER®可显著增加无运动障碍的“开”期时间,同时减少了伴有运动障碍的“开”期时间[40]。国内目前无企业申报该品种。
6.2 苯海索
苯海索属抗胆碱能药物,临床上主要适用于有震颤的患者,而对无震颤的患者不推荐应用,长期应用可能会导致认知功能下降,60岁以上的PD患者尽可能不用或少用[1]。
6.3 伊曲茶碱
作为腺苷A2A受体拮抗剂,伊曲茶碱可阻断腺苷A2A受体在大脑纹状体和苍白球表达,进而阻滞PD中D2受体激活所引起的γ-氨基丁酸和纹状体神经元的过度兴奋性,从而平衡基底神经节,改善患者的运动障碍。临床用药结果表明,伊曲茶碱对改善伴有步态冻结障碍PD患者功能具有很好的临床效果[41]。伊曲茶碱片(Nouriast®和Nourianz®,Kyowa Kirin)2020年销售收入分别为87亿日元和45亿日元[42],国内石药欧意已申报3类仿制。
6.4 屈昔多巴
屈昔多巴是一种人工合成的去甲肾上腺素前体药物,当交感神经系统受损时,屈昔多巴在L-芳香族氨基酸脱羧酶的作用下,在外周和中枢神经通过脱羧作用转化为去甲肾上腺素,从而使神经系统去甲肾上腺素水平升高。PD患者中,典型的步态障碍包括弯腰、步态冻结、脚步拖曳和跌倒等,冻结步态出现在大约7 %的早期PD和超过半数的晚期PD患者中。临床研究表明,屈昔多巴在改善强直、震颤和轮替运动功能效果明显[43]。
屈昔多巴由日本住友制药开发,1989年首次在日本上市(Northera®),2014年在美国以孤儿药获批用于治疗与PD、单纯性植物神经衰竭及多系统萎缩有关的、有征兆的神经性直立性低血压。国内有重庆圣华曦药业独家获批屈昔多巴原料药和胶囊剂,可改善由PD引起的步态僵直和直立性头晕。Northera®在2021年销售额为6.65亿丹麦克朗[44],目前国内无其他企业申报该品种。
7 开发策略探讨
随着我国老龄化程度的不断加深和中老年人对生活质量要求的提高,PD患者对治疗药物的需求和要求也会随之提高。依据Fortune Business Insights发布的报告[45],预计到2026年底全球PD药物市场价值将达到83.832亿美元,年复合增长率为8.1 %。通过对在市PD运动症状常用治疗药品的梳理可见(表1),我国在市PD治疗药品基本可覆盖绝大部分药物类别,但也有国产仿制品种集中度高,普通制剂居多,特殊或复杂剂型偏少等问题。而一些复方制剂(如恩他双多巴片)、缓控释制剂(如吡贝地尔、罗匹尼罗缓释片)和特殊制剂(如罗替高汀贴片)均以进口药为主,形成了国内PD治疗药物市场长期由进口药把持的局面。可喜的是,无论是通过合作引进(如奥匹卡朋),还是自主研发(如沙芬酰胺、伊曲茶碱),国内药企在逐渐缩短与欧美日新药上市的时间差。
7.1 改良型新药
在集中带量采购挤压药品利润空间和仿制药市场竞争日益激烈的双重压力下,国内越来越多的药企正积极布局改良型新药。上海汉都医药科技于2021年申报了2.2类新药卡左双多巴控释片,浙江京新药业于2021年申报了2.2;2.3类新药普拉克索雷沙吉兰缓释胶囊,是国内PD缓控释固体制剂领域的新突破。山东绿叶制药开发的2.2类新药注射用罗替高汀缓释微球,注射给药后药物在体内持续缓慢释放达2周,药效可维持14 d,并且全天24 h内药效平稳,目前在III期临床试验中。
Inbrija®、Rytary®、Kynmobi®、Gocovri®、Osmolex ER®是FDA于2015年后批准的505b2类新药,主要针对原有上市剂型进行改良,为疾病治疗提供了新的方案,同时也提升了PD患者的用药体验。具有明显临床优势也是我国改良型新药的立项之本,505b2类新药的获批实例或许会带来一些启示,如Zelapar®的速溶冻干技术可推广到雷沙吉兰,Kynmobi®口溶膜技术可应用到首过效应明显的罗替高汀等。
7.2 仿制药
原料供应问题是国内企业申报仿制药时所面临的首要问题,最先解决原料供应问题的企业往往能获得产品独家垄断的优势。新一代的化合物在有效性和安全性上更具优势,从而能迅速占领市场,推进药品迭代。除奥匹卡朋外,表1所列其它品种的原料药均有国内企业申报,如屈昔多巴、伊曲茶碱、罗替高汀为独家申报。
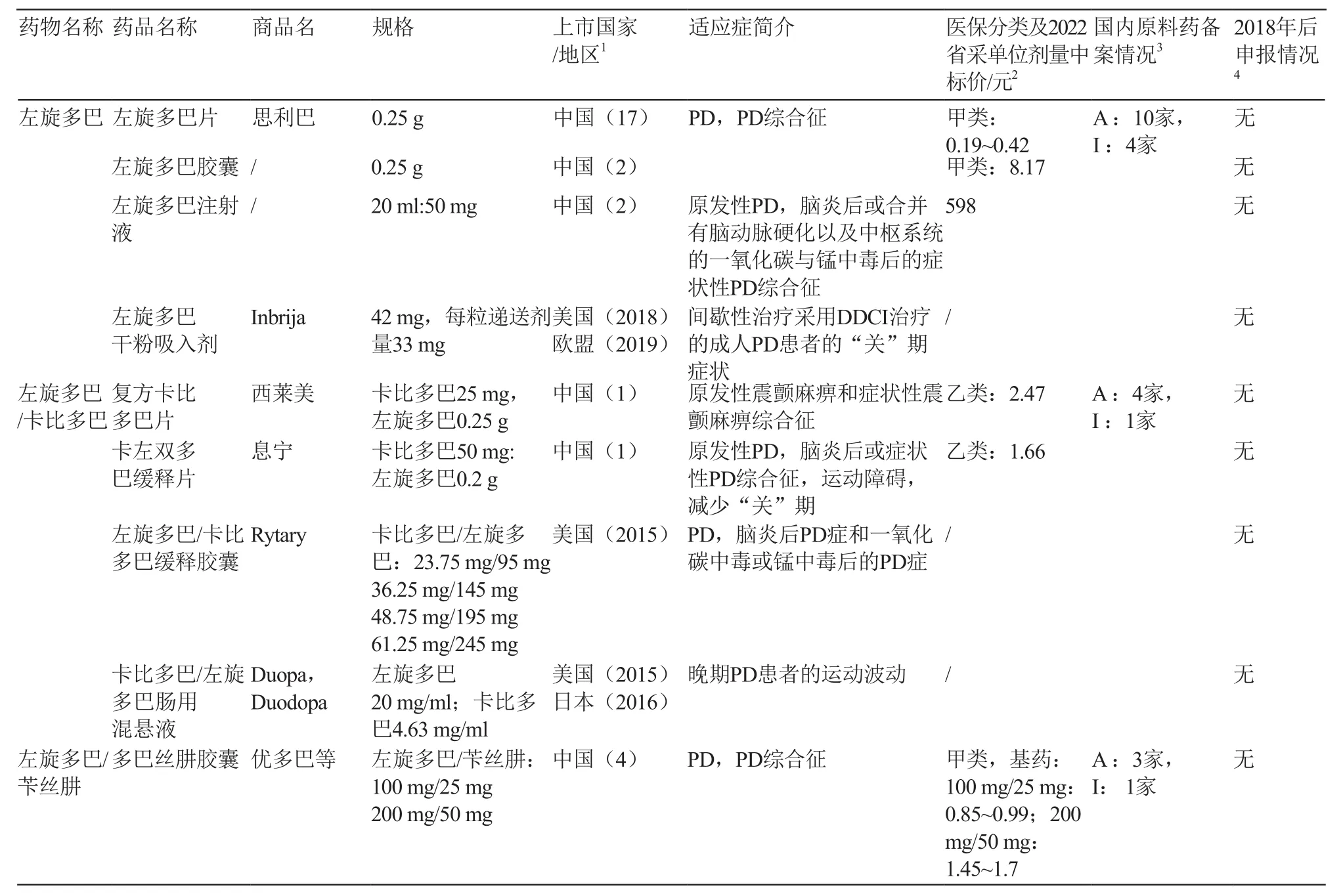
表1 国内外在市PD运动症状常用治疗药品信息汇总
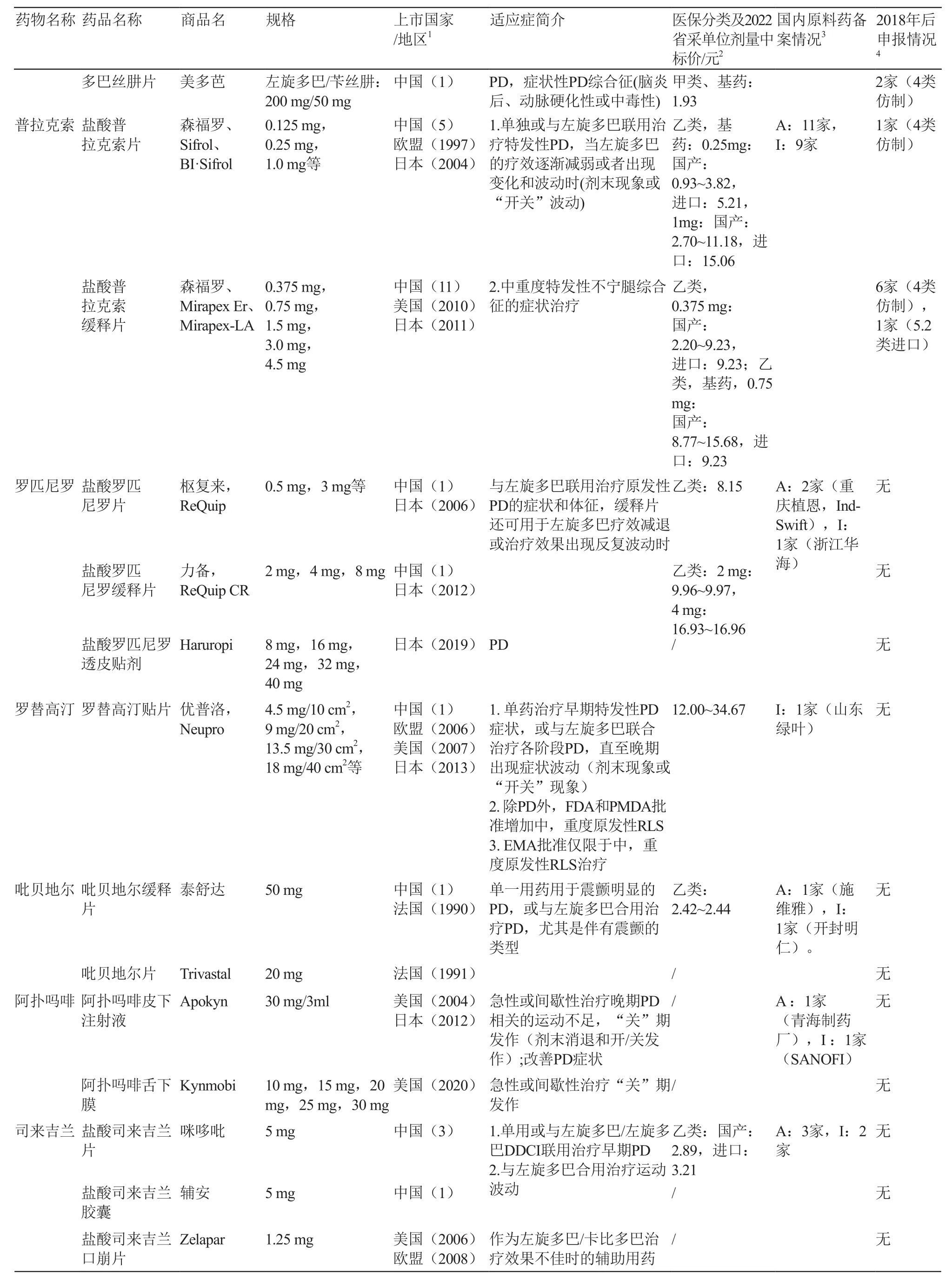
表1(续)

表1(续)
PD有病程长、运动并发症复杂等特点,针对不同疾病阶段、不同症状表现、经济承受能力等因素,临床医生往往采取不同的用药组合和治疗策略,按需治疗和个体化治疗已成为PD治疗的共识[1],越来越多各具特点的药品上市使得这一趋势成为可能。Inbrija®、Kynmobi®、Zelapar®是PD患者按需治疗的代表药品,Duopa®、Apokyn®是针对中、晚期PD患者的特殊给药方式,Rytary®明显缩短了“关”期,Neupro®、Stalevo®提高了用药顺应性,Gocovri®针对异动症等,上述品种在国内均有原料供应,但目前并无企业申报。
对于缓控释、透皮、吸入制剂等有技术壁垒的复杂或特殊剂型,国内药企仿制时往往避而远之,偏好普通剂型以尽快获取开发红利。技术升级某些时候与商业回报并不成正比,如Osmolex ER®2021年的销售收入远低于同公司的Gocovri®[21]。但技术升级若是以满足临床需求、改善患者用药体验则是必要的,这也是促使制药企业不断进行技术升级的动力,最终会随着患者用药需求和要求提高,反馈到品种的销售回报上。高技术壁垒的构建虽然周期长、风险高,但一旦构建成功将是企业的核心竞争力,是产品的护城河,也是开拓海外市场的利器,更可将技术推广到新药开发上,形成产品差异化和规模化优势,如绿叶制药和齐鲁制药借助自有的缓控释微球和口溶膜技术平台已成功开发出系列新药。
目前国内PD领域还未有化药创新药上市,随着我国创新药市场的蓬勃发展,在政策、资本和人才的三方助力下,终会出现国内药企自主研发的1类新药,为PD患者带来福音。总体来说,我国PD药物市场无论仿制药和创新药均有可开发空间,企业在品种选择上既要考虑产品预期回报、技术可行性、专利时限,也要结合公司战略、已有技术平台,更重要的是所开发品种能满足现有药品未能满足的临床需求,为临床医生提供新的治疗手段。

