防己诺林碱药理作用研究进展
王斐然,张会敏,林永强,张秋红
(1.山东中医药大学,山东 济南 250355;2.山东省中医药研究院,山东 济南 250014;3.山东省食品药品检验研究院,国家药监局胶类产品质量评价重点实验室,山东省中药标准创新与质量评价工程实验室,中药配方颗粒共性技术山东省工程研究中心,山东 济南 250101;4.济南市食品药品检验检测中心,山东 济南 250102)
防己是防己科植物粉防己(Stephania tetrandra S.Moore)的干燥根[1]。防己始载于《神农本草经》,具有祛风止痛,利水消肿的功效,用于风湿痹痛、水肿脚气、小便不利、湿疹疮毒、癣疥疮肿、高血压等病症[2-3]。目前由防己分离的化学成分主要包括生物碱类、黄酮类、多糖、挥发油、甾体类等[4-6],其中生物碱中的防己诺林碱是多种药理作用的重要活性物质之一。
防己诺林碱(fangchinoline,Fan)是从防己中分离得到的一种单体化合物(结构见图1),别名粉防己乙素、汉防己乙素、去甲基粉防己碱。现代药理学研究表明Fan有广泛的生物活性,如:抗氧化应激、抑制主动脉血管平滑肌细胞增殖、降血压、抑制组胺释放和抗肿瘤等活性[7-10]。本文通过查阅国内外文献,对Fan的药理作用进行综述。
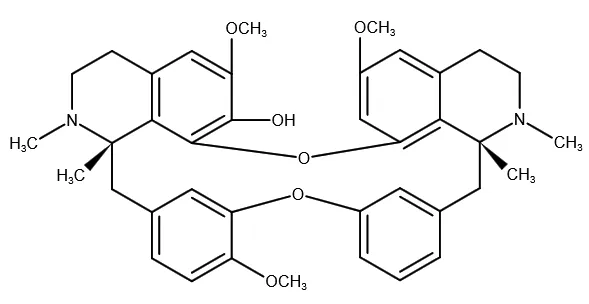
图1 防己诺林碱的结构式
1 抗肿瘤作用
恶性肿瘤细胞具有分化和增殖异常、生长失去控制、浸润性和转移性等生物学特征[11]。研究表明,Fan具有广谱抗肿瘤作用,主要通过抑制同源重组(HR)、AMP依赖的蛋白激酶/哺乳动物雷帕霉素靶蛋白/ UNC-51样激酶1通路(AMPK/mTOR/ULK1)、缺氧诱导因子1α/血管内皮生长因子/蛋白激酶B(HIF-1α/VEGF/Akt)、磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)、核转录因子κB(NF-κB)、激活蛋白1(AP-1)和丝裂原活化蛋白激酶(MAPK)等通路发挥抑制肿瘤细胞的细胞周期、减少肿瘤细胞增殖和促进肿瘤细胞凋亡等作用。防己诺林碱抗肿瘤作用机制见表1。

表1 防己诺林碱抗肿瘤作用机制
1.1 抗结膜黑色素瘤的作用
Bao等[12]使用免疫缺陷的NCG小鼠皮下注射CM-AS16细胞,通过灌胃不同浓度Fan作为治疗组发现,Fan成剂量依赖性减小实体瘤的体积,且Fan治疗组小鼠血清中丙氨酸转氨酶、天冬氨酸氨基转移酶、肌酐和尿素水平与空白组无显著性差异,表明Fan对小鼠肝肾功能无损害;蛋白质印迹法(WB)和逆转录多聚酶链式反应(RT-PCR)实验结果表明,Fan可抑制肿瘤细胞中BRCA1、BRCA2、RAD50和RAD51基因的表达,并直接与FUBP2蛋白结合,抑制HR通路,抑制肿瘤细胞的生长和增殖。
1.2 抗大肠癌的作用
Xiang等[13]采用体内外实验发现Fan可激活大肠癌细胞系HT26和HTC116中AMPK/mTOR/ULK1通路,自噬标志物 LC3-II和细胞自噬受体蛋白p62降解水平增加,促进自噬小体和点状结构形成,诱导细胞自噬,增加细胞凋亡;裸鼠皮下移植实体瘤进行体内验证发现,Fan可缩小大肠癌实体瘤的体积。望永鼎等[14]用Fan处理结肠癌细胞HT-29,48 h后发现克隆形成率显著降低,上皮细胞钙黏蛋白表达量上调,神经钙黏蛋白等表达显著下调,并经Fan治疗移植瘤后肿瘤体积缩小,且HIF-1α、VEGF和Akt的表达量下降,进一步验证了Fan通过抑制HIF-1α/VEGF/Akt信号通路对结肠癌产生治疗作用。Jiang等[15]发现Fan可阻断表皮生长因子受体(EGFR)的表达,通过抑制PI3K/Akt信号通路预防结肠癌,对人结肠腺癌DLD-1和LoVo细胞的细胞毒、细胞活性和增殖能力的作用呈剂量依赖性增长;用流式细胞仪发现Fan可诱导结肠腺癌Coad细胞凋亡和G1细胞周期阻滞,同时建立裸鼠异种移植瘤模型进行体内验证,结果表明,Fan有效抑制结肠腺癌细胞增殖、迁移、干化、侵袭和血管生成,诱导细胞凋亡。
1.3 抗白血病的作用
Xu等[16]发现粉防己碱和Fan的化学2D结构相似度可达到0.88,3D结构相似度可达到0.98,Fan对柔红霉素耐药的MOLT-4人急性T淋巴母细胞白血病细胞的P-糖蛋白具有显著抑制作用。Jung等[17]发现Fan可抑制人慢性髓原白血病细胞系KBM5和人多发性骨髓瘤细胞系U266的增殖生长;WB实验表明,Fan抑制IκB和p65的磷酸化,进而抑制NF-κB和AP-1两条通路的活化,阻滞KBM5和U266细胞生长,酶联免疫和DNA缺口末端标记法表明,Fan还能显著增强肿瘤坏死因子-α(TNF-α)活性,抑制细胞增殖,裂解DNA修复酶,诱导细胞凋亡。
1.4 抗非小细胞肺癌的作用
陈澜涛等[18]通过检测含半胱氨酸的天冬氨酸蛋白水解酶3(Caspase 3)、Caspase 8和Caspase 9等表达发现,Fan随浓度升高可逐渐提高肺癌H1299和A549细胞中细胞DNA内切酶活性,且降低细胞中凋亡相关蛋白(MCL-1、Bax和p53)和转移相关蛋白[基质金属蛋白酶2(MMP-2)、MMP-9、增殖细胞核抗原、细胞周期蛋白D1(Cyclin D1)]的表达,RT-PCR检测表明,细胞中MAPK信号通路的p-Akt、PI3K、mTOR表达被抑制,进而阻滞H1299和A549细胞停留在G0/G1期,促进细胞凋亡。
Luo等[19]采用吉姆萨染色和流式细胞术技术发现,Fan使人肺癌SPC-A-1细胞活性减弱;WB和PCR结果表明,Fan阻滞Cyclin D1表达,下调肿瘤细胞内细胞周期蛋白依赖性激酶4(CDK4)、CDK6和Cyclin D1蛋白的水平,显著降低细胞周期关键基因(Cyclin D1、CDK4和CDK6)的mRNA表达水平,抑制E2F转录因子-1活性,明显阻滞SPC-A-1肺癌细胞的增殖。
1.5 抗乳腺癌的作用
Wang等[20]发现Fan呈剂量依赖性抑制三阴性乳腺癌MDA-MB-231细胞增殖,经Fan治疗细胞内MMP-2和MMP-9含量下降。WB检测结果表明 Fan使MDA-MB-231内NF-κβ蛋白表达降低,Iκβ蛋白表达水平升高,同时下调PI3K/AKT/mTOR信号转导通路,诱导细胞凋亡。张艳辉等[21]发现Fan可有效减小三阴乳腺癌实体瘤的体积,并利用噻唑蓝比色法计算出Fan对三阴性乳腺癌细胞BT549的IC50为8.99 μmol/L,BT549细胞的Smo、Gli1蛋白表达水平明显降低,通过抑制Hedgehog通路促进肿瘤细胞凋亡,且细胞的凋亡程度与Fan的浓度呈正相关。
1.6 抗其他肿瘤的作用
研究表明,Fan还可治疗其他肿瘤疾病。Fan作用于膀胱癌细胞株T24和5637后可降低细胞内ATP水平;细胞中增殖细胞核抗原表达下调,LC3-II/LC3-I比值上调,p62水平下调,通过抑制肿瘤细胞的mTOR通路,促进膀胱癌细胞株的凋亡,诱导膀胱癌细胞发生自噬[22]。此外,Fan对于胰腺癌也有治疗作用,Lee等[23]发现Fan可通过清除细胞内的活性氧(ROS)抑制胰腺癌细胞MiaPaCa-2和PANC-1的增殖;且Fan是一种天然的孤儿核受体核受体亚家族4组A成员1 (NR4A1)抗剂,可通过抑制MiaPaCa-2和PANC-1细胞中Sp1蛋白依赖的反式应激拮抗NR4A1的表达,促进胰腺癌细胞凋亡。Li等[24]发现Fan可以明显降低骨肉瘤MG63和U20S细胞中Aktp-Thr308表达,细胞周期阻滞;此外,还可下调MG63细胞PI3K通路及下游的Cyclin D1和MMP-2和MMP-9表达,上调caspase-3和caspase-8蛋白表达,呈剂量依赖性抑制MG63和U20S细胞增殖,降低MG63细胞的迁移和侵袭能力,促进人骨肉瘤细胞的凋亡。王迅等[25]使用不同浓度的Fan处理人胶质母细胞瘤U251 细胞,通过划痕实验检测发现Fan 呈剂量依赖性抑制 U251 细胞的迁移能力,且12,24及48 h后Fan均可有效抑制细胞活力;在分子机制研究中,Fan处理后U251 细胞中 Akt 蛋白质磷酸化水平降低,抑制Akt通路,阻滞细胞生长,促进U251的凋亡。
2 抗骨质疏松作用
周琳等[26]利用Fan治疗去除卵巢诱导的骨质疏松小鼠模型,结果表明,抗酒石酸酸性磷酸酶、I型胶原羧基末端肽及I型胶原氨基末端肽表达显著下降,通过Micro-CT评估实验组小鼠骨组织微结构相关指标(骨小梁百分比、骨小梁数量和骨小梁厚度)显著升高,骨小梁分离度显著降低,检测发现Fan治疗小鼠骨质疏松骨吸收相关基因(抗酒石酸酸性磷酸酶、组织蛋白酶K、活化T细胞核因子1和降钙素受体)表达显著下降,表明Fan对去卵巢小鼠骨质疏松有保护作用。Zhou等[27]利用新鲜分离的C57BL/6小鼠骨髓巨噬细胞发现Fan可减弱骨髓巨噬细胞NF-κB受体诱导的信号转导,下调骨质疏松小鼠T细胞核因子1的活性和表达而不影响IκBα降解和丝裂原活化蛋白激酶通路,Micro-CT分析发现股骨的骨小梁百分比、骨小梁数量和骨小梁厚度呈剂量依赖性增加,骨小梁分离度降低,表明Fan对骨质疏松的骨组织有保护作用。徐志平等[28]对大鼠骨质疏松模型腹腔注射不同剂量浓度Fan 1个月,检测发现Fan呈剂量依赖性提升自噬相关基因(ATG)的表达,例如显著增强了ATG-5、转录因子2、Beclin-1和骨形态蛋白2的表达,并显著降低股骨组织中NF-κB受体活化因子配体表达,表明Fan是通过增加自噬实现预防骨质疏松大鼠骨质流失。
3 抗炎作用
炎症反应是人体对外界刺激的一种防御反应,表现为红肿热痛,大多数炎症反应对人体有益,但失调的炎症反应会对机体产生损伤,如糖尿病肾病、风湿性关节炎和神经细胞炎症等。
Chen等[29]实验表明,Fan能显著减少急性心功能不全大鼠模型的单核细胞趋化蛋白-1、TNF-α、白细胞介素(IL-1β)、IL-18和IL-6等炎性细胞因子释放;此外,Fan处理后提高了超氧化物歧化酶(SOD)的活性,降低丙二醛的含量,同时显著抑制p65、细胞外调节蛋白激酶1/2和NF-κB的磷酸化,进而抑制内毒素应激大鼠心肌细胞的凋亡,减轻心肌损伤。
Jiang等[30]用高脂饲料喂养大鼠4周,单次腹腔注射链脲霉素(30 mg/kg)诱导糖尿病肾病,实验组每日1次口服Fan进行治疗,大鼠血清中IL-6和TNF-α水平明显降低,Fan可抑制MMP-9、环氧化酶2和TNF-α表达,降低异常表达的p38-MAPK;对大鼠肾脏进行组织切片染色发现Fan可减轻氧化应激和炎症造成的肾脏损伤,发挥肾脏保护作用。
Villa等[31]用不同浓度的Fan处理人成纤维样滑膜细胞(FLS)1 h后给予IL-1β(10 ng/ml)刺激,Fan处理后细胞活性无变化,但ROS测定和WB分析表明,Fan可减少产生人FLS细胞炎性细胞因子和ROS,减少人FLS细胞MAPK通路和NF-κB通路磷酸化;角叉菜胶/高岭土关节炎大鼠模型用组织病理学技术和苏木精-伊红染色对大鼠左膝关节进行处理,与未经治疗的关节炎组相比,治疗组大鼠的炎症评分均明显降低,在组织学照片中表现得尤为明显,表明Fan可改善炎症关节红肿热痛的症状,改善炎症体征,抑制关节炎小鼠膝关节软骨降解。Shan等[32]使用Fan连续治疗类风湿性关节炎模型大鼠21 d后,血清中异常表达的脂质过氧化物、谷胱甘肽、SOD和谷胱甘肽过氧化物酶恢复到接近正常水平;Fan组TNF-α、IL-6、MMP-3和前列腺素E2水平下降,NO、尿酸、铜蓝蛋白和铜的含量降低,但锌含量增加,风湿性关节炎的炎症反应降低。
Bao等[33]利用谷氨酸诱导神经元HT22细胞氧化性损伤,向其中加入核因子E2相关因子2(Nrf2)抑制剂Brusatol(80 nmol/L)2 h后加入Fan,噻唑蓝比色法法检测表明,Fan成剂量依赖性阻止HT22细胞死亡,显著减轻细胞内ROS过量产生,逆转谷氨酸引起的SOD活性下降,RT-PCR发现Fan有效上调HT22细胞中异常下降的Nrf2和血红素加氧酶的水平,siRNA瞬时转染表明Fan可在mRNA水平和蛋白质水平下调Kelch样环氧氯丙烷相关蛋白1的表达,抑制谷氨酸氧化产生的神经毒性。
Han等[34]对新生大鼠右侧颈总动脉结扎建造脑缺血模型,连续3 d腹腔注射Fan进行治疗后发现,Fan可降低缺血动物模型后脑组织异常升高的IL-1β和TNF-α;组织病理学研究表明,与缺血空白模型相比,Fan组大鼠脑组织髓鞘碱性蛋白含量明显升高,脑损伤百分率明显降低;此外,Fan治疗组大鼠脑组织中诱导型一氧化氮合酶、VEGF、p53和Nrf2的表达减弱,改善新生大鼠脑缺血后神经元变性中血管生成分子的表达,以此善新生大鼠脑缺血诱导的神经元损伤。
4 药物的其他药理作用
4.1 抗病毒的作用
Kim等[35]利用HCoV-OC43病毒感染MRC-5人肺细胞后给予Fan进行治疗,Fan在感染的MRC-5人胚肺细胞早期可抑制病毒S和N蛋白的表达,并降低感染细胞中IL-1β、IL-6和IL-8的表达,阻滞HCoV-OC43病毒的复制,使MRC-5细胞存活率显著上升,且治疗作用呈剂量和时间依赖性。Wan等[36]利用HIV-1cDNA转染人胚肾细胞系HEK293T后给予Fan进行治疗,Fan能抑制HIV包膜蛋白HIV-1糖蛋白160的加工,导致包膜糖蛋白进入新生病毒粒子减少,进而抑制感染性病毒粒子产生,主要作用于HIV感染晚期阶段。
4.2 抗糖尿病视网膜病变的作用
Wu等[37]通过腹腔注射链脲佐菌诱导大鼠产生糖尿病视网膜病变模型,研究发现Fan可使异常表达的晚期糖基化终产物、血浆糖化血红蛋白和血糖浓度明显下降,减轻视网膜组织匀浆中氧化应激指标及炎症细胞因子(VEGF、TNF-α、IL-1b、IL-6)的表达,抑制晚期糖基化终产物基因表达,视网膜组织中NF-κB表达下降,细胞凋亡指数有效降低,减轻糖尿病后期诱发的视网膜形态改变。
4.3 抑制瘢痕生长的作用
宋英莉等[38]利用原代瘢痕组织成纤维细胞进行实验发现,Fan可呈剂量依赖性地抑制瘢痕组织成纤维细胞的增殖能力,抑制Cyclin D1和B淋巴细胞瘤-2基因在瘢痕组织成纤维细胞中的表达,对正常成纤维细胞的增殖无影响,表明Fan只对增生性瘢痕有抑制作用。
4.4 与肿瘤靶向药物的协同作用
Fan与3-甲基腺嘌呤联合用药时,大肠癌HT29和HCT116细胞的存活率均显著降低,同时对正常细胞无伤害,表明在Fan诱导细胞凋亡时3-甲基腺嘌呤可对正常细胞产生保护作用[13]。Kong等[39]研究表明,Fan-黄连碱/小檗碱对乙酰胆碱酯酶有协同抑制作用。何丽等[40]对耐药卵巢癌细胞株SKOV3/ADM进行了Fan与紫杉醇的联合用药实验,结果表明,Fan可促进紫杉醇的摄取率,逆转癌细胞对紫杉醇长期用药产生的耐药性。Fan也可显著提高吉西他滨对黑色素瘤细胞A375细胞株的促凋亡作用,还可提高结膜黑色素瘤CM-AS16细胞对顺铂、阿霉素的敏感性[12]。
5 总结与展望
Fan是从防己中提取分离得到的一种天然活性成分,对肿瘤、骨质疏松、炎症、病毒感染、糖尿病诱导的视网膜病变等多种疾病均有治疗作用。近年对于Fan的药理研究已深入到细胞分子水平,可更加准确地阐述Fan的药理作用机制。随着研究深入,Fan针对不同疾病作用机制逐渐明确,通常是多种通路交互作用,可为未来的深入研究和疾病治疗提供参考,但由于Fan属于难溶性物质,口服生物利用度较低,限制了其临床应用。随着未来基因工程、代谢工程及分子生物学等现代科学技术发展,Fan类药物极有可能开发出应用于临床的成药。

