PML/RARα 亚型与急性早幼粒细胞白血病患者临床特点及预后分析
陈伟伟,潘玉,孙福金,夏天,程相山
菏泽市立医院血液科,山东菏泽 274000
急性早幼粒细胞白血病(acute promyelocytic leukemia, APL)是急性髓细胞白血病(acute myeloid leukemia, AML)的特殊类型,APL 有独特的遗传学和形态学特征,患者可出现严重的凝血功能障碍,导致患者严重出血而引发死亡[1-2]。APL 患者特征性遗传学改变为t(15;17)(15q22;17q11-12),即位于15q22 染色体的PML 基因易位至17 号染色体,同时与17q11-12 的维甲酸受体α(retinoic acid receptorα, RARα)基因形成一个新的融合基因,即PML/RARα,并根据其转录本长度的不同又分为3 种不同的基因亚型,即长链型(L 型)、短链型(S 型)及突变型(V 型)[3-4]。本研究选取 2014 年 3 月—2019 年3 月菏泽市立医院收治的APL 初诊117 例患者为研究对象,观察分析PML/RARα 亚型与APL 患者的临床特点及预后,现报道如下。
1 资料与方法
1.1 一般资料
选择本院收治的APL 初诊患者117 例为研究对象。男 68 例,女 49 例;年龄 15~65 岁,平均(34.59±10.21)岁。以上患者均经遗传学、形态学及多重逆转录- 聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)检测确诊,且PML/RARα 基因分型明确并进行规范治疗。其中L型患者 63 例、V 型患者 15 例、S 型患者 39 例。L 型患者中男38 例,女25 例;平均年龄(35.10±9.38)岁;V 型患者男 8 例,女 7 例;平均年龄(33.27±10.42)岁;S 型患者男 22 例,女 17 例;平均年龄(33.98±11.02)岁。3 组患者性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。根据Sanz 评分,分为低危组(WBC<10×109/L 且 PLT≥40×109/L)、中危组(WBC≤10×109/L 且 PLT<40×109/L) 和 高 危 组(WBC>10×109/L),其中低危组患者42 例、中危组患者58 例、高危组患者17 例。患者均签署知情同意书,研究经本院伦理委员会批准。
1.2 纳入与排除标准
纳入标准:①均经遗传学、形态学及多重RTPCR 检测确诊;②均为初诊患者;③年龄15~65 岁;④PML/RARα 基因分型明确并进行规范治疗;⑤患者自愿签署知情同意书。排除标准:①合并其他血液系统疾病患者;②合并其他恶性肿瘤患者。
1.3 方法
低、中危患者诱导治疗方案为柔红霉素(daunorubicinDNR)(国药准字H20074216)和(或)高三尖杉 酯 碱(homcharring-tonine, HHT)(国 药 准 字H20031010)+全反式维甲酸(ATRA)(国药准字H20010126)。高危患者诱导方案为DNR+ATRA+亚砷酸(国药准字H19990191)。维持治疗使用ATRA 治疗 14 d 后间歇 14 d,再使用亚砷酸 14 d 后间歇 14 d×2 轮,共完成 5~8 个循环。参照国际协作组AML 临床疗效评定标准对患者疗效进行评定。
①患者骨髓标本采用流式细胞技术进行免疫表型分析,骨髓涂片采用瑞特染色后进行细胞形态学检查;②采用real-time PCR 法对患者骨髓标本进行PML/RARα 亚型确定;通过测序检测患者FMS 样酪氨酸激酶3 结构域点突变情况(FLT3/TKD)及FMS 样酪氨酸激酶3 内部串联重复(FLT3/ITD)。
1.4 观察指标
①对比PML/RARα 不同亚型患者临床特征,包括白细胞计数(white blood cell count,WBC)、血红蛋白(hemoglobin,Hb)、血小板计数(platelet count,Plt)、凝血酶原时间(prothrombin time, PT)、活化部分凝血酶原时间(activated partial prothrombin time,APTT)、纤维蛋白原(fibrinogen, Fib)、乳酸脱氢酶(lactate dehydrogenase, LDH)。②比较PML/RARα不同亚型患者免疫表型。③比较PML/RARα 不同亚型患者危险度分层。④比较PML/RARα 不同亚型患者治疗反应。⑤比较PML/RARα 不同亚型患者无进展生存情况。
1.5 随访
随访截止日期为2021 年4 月1 日,以患者疾病进展作为随访终点时间,记录患者无进展生存情况。
1.6 统计方法
采用SPSS 22.0 统计学软件分析数据,符合正态分布计量资料用()表示,比较使用方差分析和t检验;计数资料采用[n(%)]表示,3 组比较Kruskal-Wallis 秩和检验,两组比较采用χ2检验,若期望计数<5 则采取连续性修正卡方检验;生存分析绘制Kaptan-Meier 生存曲线,生存情况比较采用Logrank 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 PML/RARα 不同亚型患者临床特征比较
PML/RARα 不同亚型患者 WBC、Fib 水平比较,差异有统计学意义(P<0.05),见表1。免疫表型分析结果显示,S 型患者CD34 阳性表达率显著高于L型和 V 型,差异有统计学意义(P<0.05),见表 2。PML/RARα 不同亚型患者危险度封层结果显示,S型患者高危比例较L 型患者高,差异有统计学意义(P<0.05),见表3。
表1 PML/RARα 不同亚型患者临床指标比较()

表1 PML/RARα 不同亚型患者临床指标比较()
注:与S 型比较,*P<0.05;与V 型比较,#P<0.05
临床指标WBC(×109/L)Hb(g/L)Plt(×109/L)PT(s)APTT(s)Fib(g/L)LDH(U/L)P 值<0.001 0.766 0.185 0.139 0.810<0.001 0.886 L 型(n=63)(6.28±2.10)*#78.36±15.63 23.28±5.65 16.70±2.15 38.94±5.50(1.98±0.42)*#489.93±121.58 V 型(n=15)(28.39±8.30)*80.29±21.55 20.38±6.02 16.29±3.11 40.22±7.86(1.60±0.37)*473.02±130.33 S 型(n=39)15.40±4.32 81.21±24.10 22.93±4.98 15.64±3.02 39.16±8.33 0.97±0.22 501.28±156.39 F 值191.423 0.267 1.712 2.007 0.211 7.735 0.121

表2 PML/RARα 不同亚型患者免疫表型检查结果比较
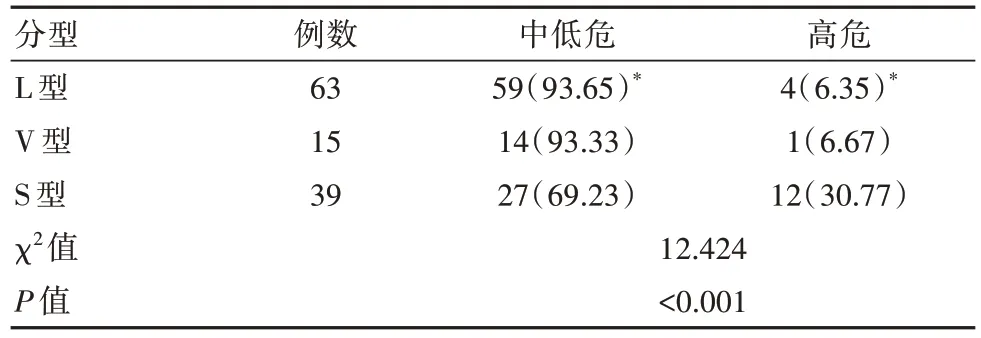
表3 PML/RARα 不同亚型患者危险度分层比较[n(%)]
2.2 PML/RARα 不同亚型患者治疗反应比较
PML/RARα 不同亚型患者治疗完全缓解率比较,差异无统计学意义(P>0.05),而S 型患者RAS 发生率明显高于L 型和V 型,差异有统计学意义(P<0.05),见表4。
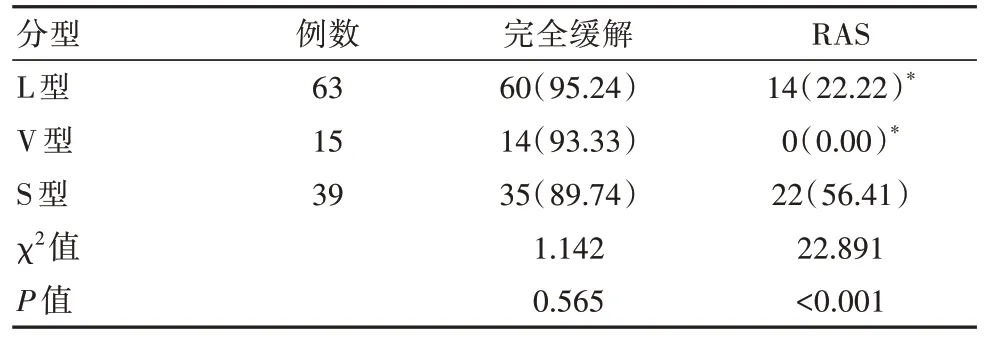
表4 PML/RARα 不同亚型患者治疗反应比较[n(%)]
2.3 PML/RARα 不同亚型患者无进展生存情况比较
L 型、V 型患者无进展生存情况显著优于S 型,差异有统计学意义(χ2=11.959,P=0.003),见图1。
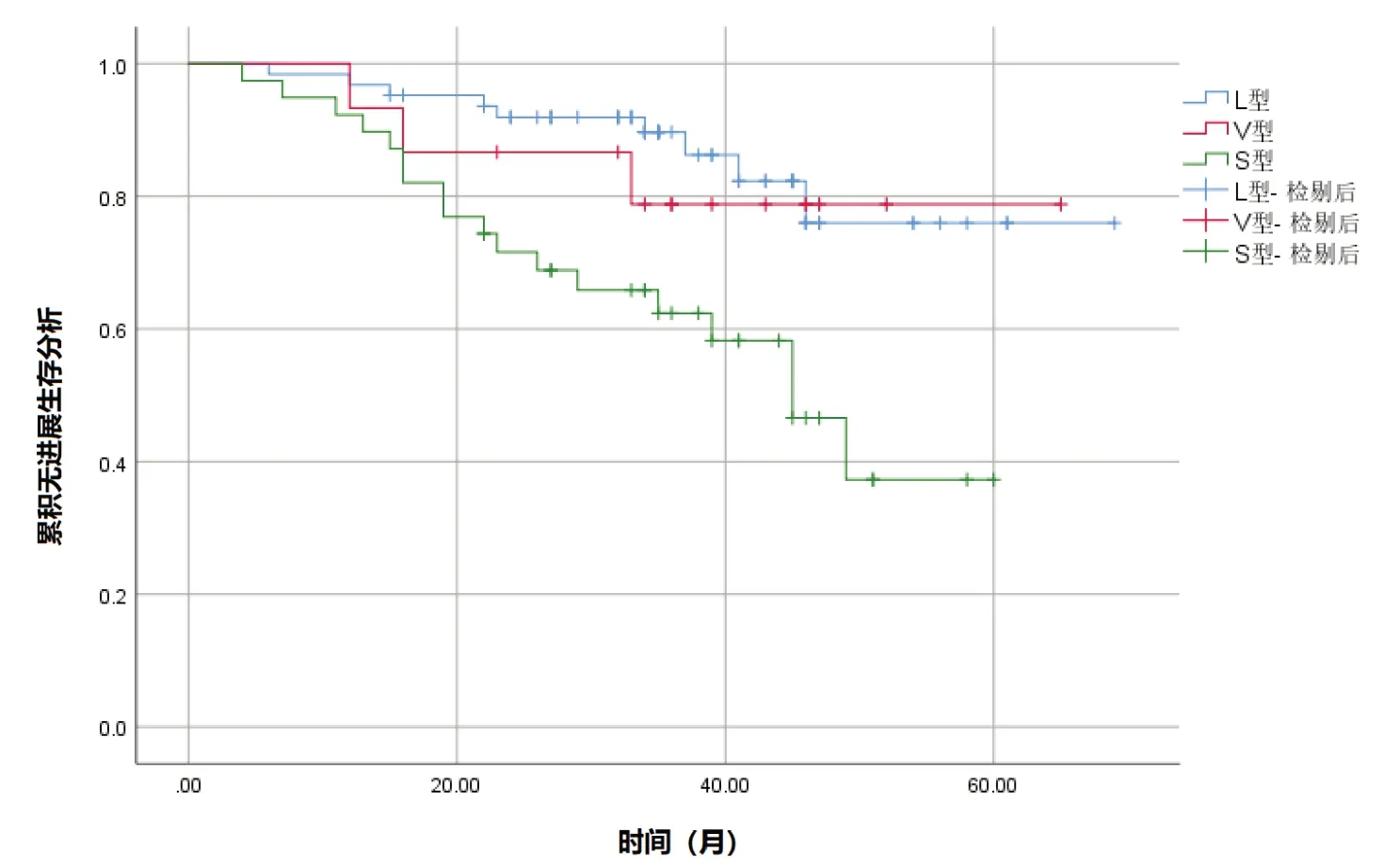
图1 PML/RARα不同亚型患者无进展生存情况比较
3 讨论
APL 患者存在特异性的染色体核型改变及融合基因,根据PML 基因的断裂部位不同,出现PML/RARα 的不同亚型[5-8]。本研究 117 例 APL 初诊患者中 ,L 型 患 者 63 例(53.85%)、V 型 患 者 15 例(12.82%)、S 型患者39 例(33.33%),与学者相关调查报道发生率相似,L 型、V 型、S 型发生率分别为48.7%、5.1%、46.2%[9-10]。且目前学者观点认为,APL 患者中PML 基因断裂的部位与环境因素及种族遗传因素有关,不同致病因素所引发的APL 基因断裂情况有所不同[8]。本研究针对本院117 例APL患者进行分析,探讨ML/RARα 亚型与APL 患者临床特点及预后,发现不同ML/RARα 不同亚型患者实验室检查结果及临床特征之间不完全一致。研究显示,PML/RARα 不同亚型患者 WBC、Fib 水平比较,差异有统计学意义(P<0.05),其中S 型患者Fib水平更低,而低纤维蛋白原血症是目前认为导致APL 患者严重出血进而引发患者早期死亡的重要原因,与学者相关研究报道结果相似[11-12]。
大量学者研究显示,在APL 患者免疫表型中,CD34 阳性及CD56 阳性均是导致APL 患者不良预后的重要因素[13-15]。本研究免疫表型分析结果显示,S 型患者CD34 阳性表达率显著高于L 型和V型,这可能也进一步提示可能S 型患者预后欠佳。无进展生存分析结果显示,L 型、V 型患者无进展生存情况显著优于S 型患者。提示S 型患者临床预后更差,其机制可能与患者低纤维蛋白原血症而引发的出血风险增加、危险度分层高危患者比例更高及免疫表型CD34 阳性表达率更高等有关[16-17]。
综上所述,PML/RARα 不同亚型患者临床特征有所不同,其中S 型患者纤维蛋白原水平低、CD34阳性表达率高、危险度分层高危患者比例高,S 型患者临床预后更差。

