新型吡唑肟衍生物的设计、合成与杀虫活性
张紫婵, 郑丹丹, 石玉军, 丁 颖, 李建华, 严瑞健, 张 敏, 王 杨, 戴 红
(南通大学 化学化工学院,江苏 南通 226019)
吡唑衍生物在农药和医药领域有着广泛的应用,一直是药物创制的研究热点之一[1-9]。吡唑肟在吡唑类化合物中占据重要地位,具有广谱杀虫、杀菌、抗肿瘤等生物活性[10-13]。其中典型性代表有日本农药公司推出的杀螨剂唑螨酯(Fenpyroximate),该化合物对多种螨虫有优异的防效[14]。近年来,药物化学工作者在杀螨剂唑螨酯结构基础上,衍生合成出许多具备优良生物活性的吡唑肟化合物,如杨亚喆等[15]通过引入噻唑环,合成的含噻唑基团的吡唑肟衍生物对螨虫和蚊虫呈现出良好的杀灭效果。周钱等[16]在唑螨酯分子中引入噁唑环,得到的化合物对粘虫和蚜虫具有优异的杀虫作用。Ling等[17]通过引入香豆素杂环单元,得到的化合物表现出较好的抗肿瘤活性。另外,N-吡啶基吡唑衍生物亦为吡唑杂环化合物中的重要一员,具有高效杀虫、杀菌等方面的生物活性[18-21],在农业生产上扮演着重要的角色,如杜邦公司研制开发的杀虫剂氯虫酰胺(Chlorantraniliprole)对粘虫、小菜蛾及蚜虫等害虫有突出的杀虫效果[22],沈阳化工研究院自主研发的杀虫剂四氯虫酰胺(Tetrachlorantraniliprole)对粘虫、二化螟、小菜蛾、甜菜夜蛾等害虫展现出显著的防效[23]。该类型杀虫剂具有优异的杀虫活性及与市场上商品化的其它农药无交互抗性,有关N-吡啶基吡唑化合物的结构修饰与生物活性研究近年来受到人们的广泛关注。为进一步从吡唑肟类衍生物中寻找与发现具有潜在生物活性的化合物,本研究拟以唑螨酯为先导结构,利用活性片段拼接原理,将N-吡啶基吡唑结构片段引入到唑螨酯母核中,设计合成出一系列新型吡唑肟化合物(Scheme 1),所得目标产物的结构通过1H NMR、13C NMR和元素分析等手段表征。以唑螨酯、啶虫丙醚及吡虫啉作为对照,评价了所合成的目标化合物的杀虫活性。
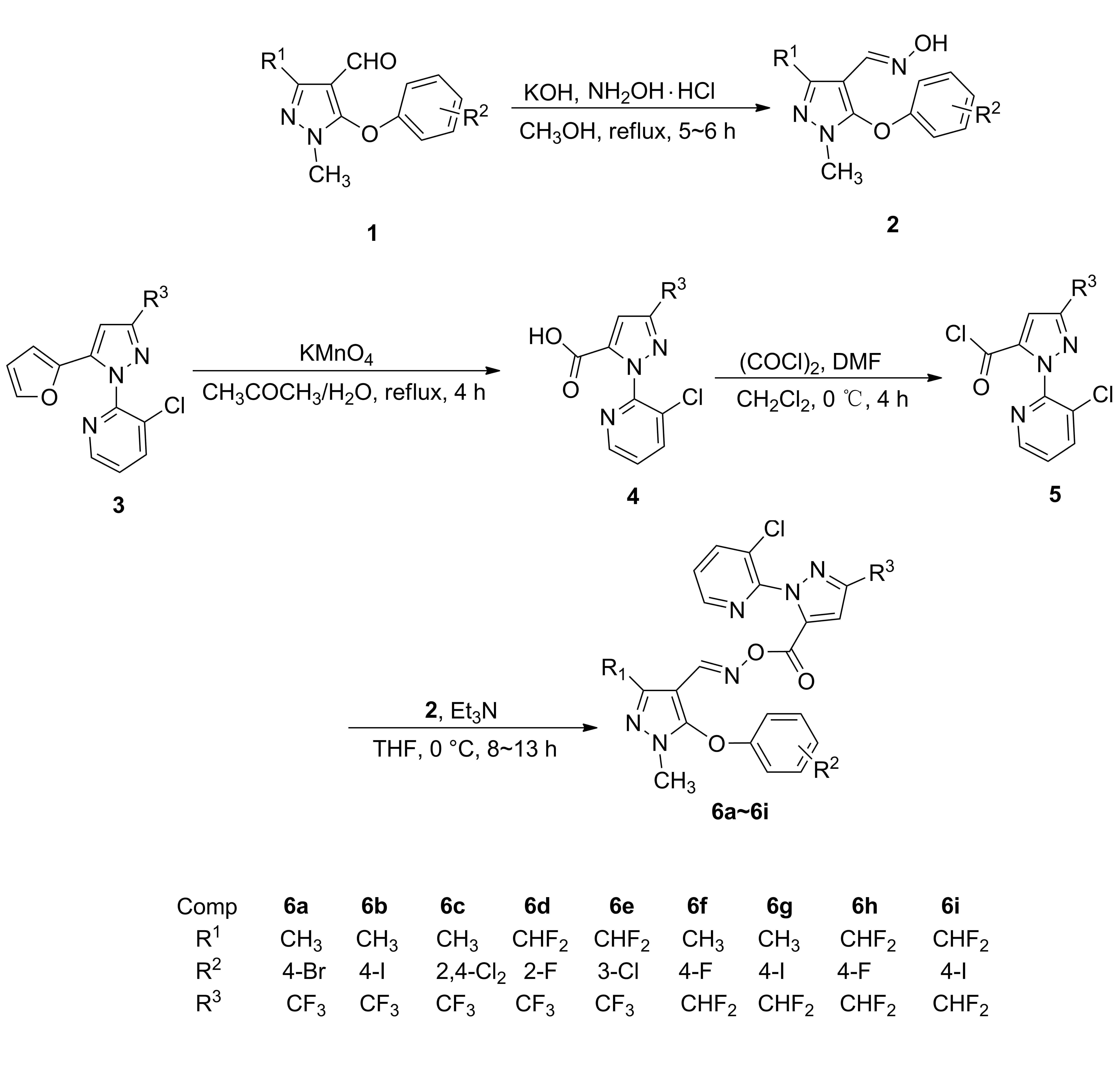
Scheme 1
1 实验部分
1.1 仪器与试剂
X-4型显微熔点仪;ZF-I 型三用紫外分析仪;Bruker 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Yanaco-CHN CORDER MT-3型元素分析仪。
化合物1~5按照文献[24-25]方法合成;其余所用试剂为分析纯。
1.2 化合物6a~6i的合成通法
向50 mL反应瓶中加入1 mmol化合物2和20 mL无水四氢呋喃,冰浴条件下向其中加入1 mL三乙胺,搅拌10 min后向其中缓慢滴加2 mmol化合物5的无水四氢呋喃(10 mL)溶液,滴加好后,冰浴条件下继续搅拌8~13 h。停止反应,抽滤,母液经减压浓缩,所得残余物用甲醇重结晶得目标化合物6a~6i。
6a:白色固体,收率56%, m.p. 173~174 ℃;1H NMR(400 MHz, CDCl3)δ: 8.48~8.50(m, 1H), 7.98(s, 1H), 7.89~7.92(m, 1H), 7.47(d,J=8.8 Hz, 2H), 7.43~7.46(m, 1H), 7.27(s, 1H), 6.82(d,J=8.8 Hz, 2H), 3.61(s, 3H), 2.44(s, 3H);13C NMR(100 MHz, CDCl3)δ: 155.68, 155.15, 149.33, 149.02, 148.49, 148.20, 147.07, 144.02, 143.62, 139.18, 134.12, 133.25, 129.37, 126.45, 121.74(q,J=268.1 Hz), 117.08, 116.88, 109.28, 98.32, 34.52, 15.25; Anal. Calcd for C22H15BrClF3N6O3: C 45.27, H 2.59, N 14.40, found C 45.10, H 2.45, N 14.52。
6b:白色固体,收率55%, m.p. 159~161 ℃;1H NMR(400 MHz, CDCl3)δ: 8.48~8.50(m, 1H), 7.98(s, 1H), 7.89~7.92(m, 1H), 7.65~7.67(m, 2H), 7.44~7.46(m, 1H), 7.27(s, 1H), 6.70(d,J=9.2 Hz, 2H), 3.61(s, 3H), 2.43(s, 3H);13C NMR(100 MHz, CDCl3)δ: 156.49, 155.12, 149.23, 148.95, 148.46, 148.18, 147.05, 139.73, 139.20, 134.08, 129.36, 127.01, 126.45, 121.72(q,J=268.1 Hz), 117.49, 109.26, 98.37, 87.23, 34.49, 15.20; Anal. Calcd for C22H15ClF3IN6O3: C 41.89, H 2.40, N 13.32, found C 41.75, H 2.55, N 13.20。
6c:白色固体,收率52%, m.p. 178~180 ℃;1H NMR(400 MHz, CDCl3)δ: 8.49~8.51(m, 1H), 7.96(s, 1H), 7.90~7.93(m, 1H), 7.51(d,J=2.4 Hz, 1H), 7.44~7.48(m, 1H), 7.28(s, 1H), 7.16~7.19(m, 1H), 6.65(d,J=9.2 Hz, 1H), 3.63(s, 3H), 2.43(s, 3H);13C NMR(100 MHz, CDCl3)δ: 155.05, 150.83, 148.94, 148.74, 148.47, 148.25, 147.06, 144.02, 139.18, 134.06, 131.03, 129.98, 129.36, 128.31, 126.46, 121.72(q,J=267.8 Hz), 116.40, 109.30, 98.28, 34.53, 15.21; Anal. Calcd for C22H14Cl3F3N6O3: C 46.05, H 2.46, N 14.65, found C 45.92, H 2.30, N 14.56。
6d:淡黄色固体,收率57%, m.p. 159~161 ℃;1H NMR(400 MHz, CDCl3)δ: 8.50~8.52(m, 1H), 8.02(s, 1H), 7.92~7.94(m, 1H), 7.47~7.50(m, 1H), 7.26(s, 1H), 7.04~7.20(m, 3H), 6.68~6.99(m, 2H), 3.81(s, 3H);13C NMR(100 MHz, CDCl3)δ: 154.39, 152.34(d,J=247.0 Hz), 149.80, 148.44, 147.07, 143.72, 139.21, 134.01, 129.31, 126.54, 125.83(d,J=7.0 Hz), 124.80(d,J=3.8 Hz), 121.70(q,J=267.8 Hz), 118.60, 117.40, 110.70(t,J=234.3 Hz), 108.36, 97.24, 35.26; Anal. Calcd for C22H13ClF6N6O3: C 47.28, H 2.34, N 15.04, found C 47.40, H 2.19, N 15.18。
6e:白色固体, 收率56%, m.p. 132~134 ℃;1H NMR(400 MHz, CDCl3)δ: 8.50~8.52(m, 1H), 8.10(s, 1H), 7.92~7.94(m, 1H), 7.46~7.49(m, 1H), 7.28(s, 1H), 7.25(d,J=9.2 Hz, 1H), 7.13~7.15(m, 1H), 6.69~6.96(m, 3H), 3.75(s, 3H);13C NMR(100 MHz, CDCl3)δ: 156.14, 154.45, 148.85, 148.43, 147.09, 144.06, 143.93, 139.22, 135.72, 133.91, 130.94, 129.33, 126.51, 124.96, 121.71(q,J=267.9 Hz), 116.59, 113.88, 110.68(t,J=234.6 Hz), 109.51, 98.15, 35.33; Anal. Calcd for C22H13Cl2F5N6O3: C 45.93, H 2.28, N 14.61, found C 46.09, H 2.41, N 14.47。
6f:棕色固体,收率62%, m.p. 149~150 ℃;1H NMR(400 MHz, CDCl3)δ: 8.48~8.50(m, 1H), 8.00(s, 1H), 7.88~7.91(m, 1H), 7.41~7.45(m, 1H), 7.24(s, 1H), 7.03~7.07(m, 2H), 6.64~6.92(m, 3H), 3.62(s, 3H), 2.43(s, 3H);13C NMR(100 MHz, CDCl3)δ: 159.05(d,J=241.9 Hz), 155.53, 152.53, 149.89, 149.01, 148.72, 148.12, 147.04, 139.12, 134.06, 129.33, 126.21, 116.80(d,J=23.9 Hz), 110.36(t,J=234.1 Hz), 108.61, 98.20, 34.47, 15.26; Anal. Calcd for C22H16ClF3N6O3: C 52.34, H 3.19, N 16.65, found C 52.25, H 3.33, N 16.78。
6g:白色固体, 收率58%, m.p. 164~166 ℃;1H NMR(400 MHz, CDCl3)δ: 8.48~8.50(m, 1H), 7.99(s, 1H), 7.88~7.91(m, 1H), 7.66(d,J=8.8 Hz, 2H), 7.41~7.44(m, 1H), 7.25(s, 1H), 6.64~6.91(m, 3H), 3.60(s, 3H), 2.44(s, 3H);13C NMR(100 MHz, CDCl3)δ: 156.55, 155.51, 149.19, 148.89, 148.74, 148.19, 148.01, 147.06, 139.20, 134.06, 129.35, 126.22, 117.50, 110.37(t,J=234.0 Hz), 108.70, 98.46, 87.20, 34.51, 15.26; Anal. Cacd for C22H16ClF2IN6O3: C 43.12, H 2.63, N 13.72, found C 43.29, H 2.50, N 13.88。
6h:白色固体,收率59%, m.p. 165~167 ℃;1H NMR(400 MHz, CDCl3)δ: 8.50~8.52(m, 1H), 8.08(s, 1H), 7.91~7.93(m, 1H), 7.45~7.48(m, 1H), 7.25(s, 1H), 6.64~7.04(m, 6H), 3.76(s, 3H);13C NMR(100 MHz, CDCl3)δ: 159.26(d,J=242.1 Hz), 154.88, 151.66, 149.68, 148.64, 148.34, 148.03, 147.73, 147.18, 143.85, 139.16, 133.86, 129.25, 126.27, 117.38, 116.80(d,J=23.8 Hz), 110.67(t,J=234.4 Hz), 110.31(t,J=234.1 Hz), 108.89, 97.82, 35.25; Anal. Cacd for C22H14ClF5N6O3: C 48.86, H 2.61, N 15.54, found C 48.73, H 2.76, N 15.71。
6i:白色固体,收率59%, m.p. 157~159 ℃;1H NMR(400 MHz, CDCl3)δ: 8.51~8.52(m, 1H), 8.10(s, 1H), 7.92~7.94(m, 1H), 7.62(d,J=8.8 Hz, 2H), 7.45~7.48(m, 1H), 7.26(s, 1H), 6.64~6.96(m, 4H), 3.74(s, 3H);13C NMR(100 MHz, CDCl3)δ: 155.69, 154.84, 148.95, 148.63, 148.03, 147.72, 147.08, 143.87, 139.17, 139.06, 133.82, 129.26, 126.27, 117.97, 110.63(t,J=234.5 Hz), 110.31(t,J=234.1 Hz), 108.28, 98.17, 87.68, 35.26; Anal. Calcd for C22H14ClF4IN6O3: C 40.73, H 2.18, N 12.95, found C 40.86, H 2.34, N 12.87。
1.3 杀虫活性测试方法
参照文献[26]方法测试了目标物6a~6i对朱砂叶螨(Tetranychuscinnabarinus)、粘虫(Orientalarmyworm)及蚜虫(Aphismedicaginis)初步杀虫效果,选择唑螨酯(Fenpyroximate)、啶虫丙醚(Pyridalyl)及吡虫啉(Imidacloprid)分别作为对照药。
2 结果与讨论
2.1 合成
目标物6a~6i按照Scheme 1所示的反应步骤合成,通过酰氯中间体5与化合物2发生亲核取代反应而得到。以化合物6f的合成为例,主要研究了不同缚酸剂(三乙胺、吡啶)、投料比、溶剂(二氯甲烷、四氢呋喃、乙腈、丙酮)等合成条件对6f收率的影响。从表1可看出,当化合物2f与酰氯中间体5b的物质的量之比为1∶1.5时,以三乙胺作缚酸剂,四氢呋喃作溶剂,化合物6f的转化率相对较好,达59%(Table 1,Entry 2),随着酰氯中间体5b用量的增加,化合物6f的收率有一定的提高,均为62%(Table 1,Entry 9和Entry 10)。最终,选以三乙胺作缚酸剂,四氢呋喃作溶剂,化合物2与酰氯中间体5的投料摩尔比为1∶2,在冰浴条件下反应,顺利地制备出目标物6a~6i。
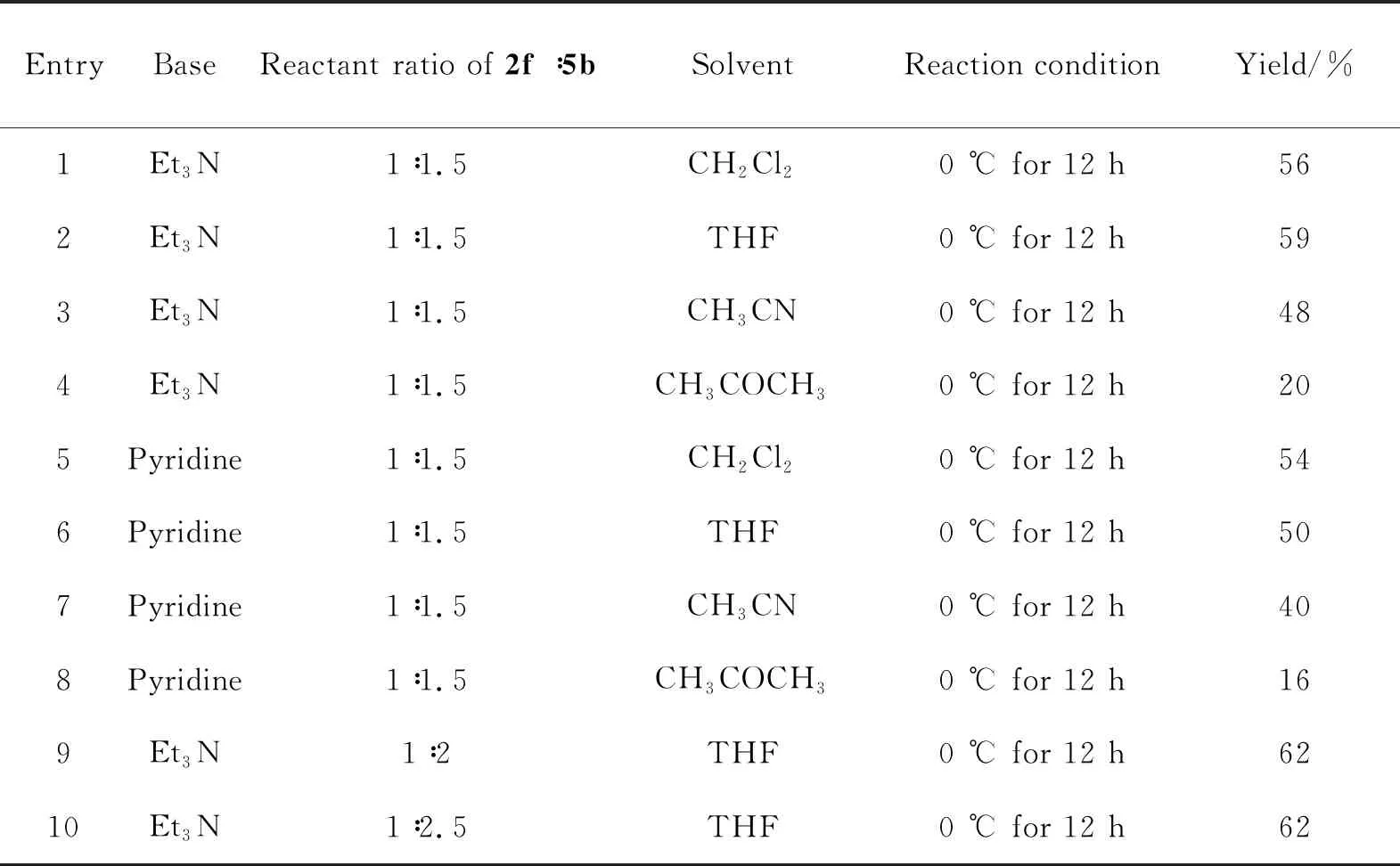
表1 反应条件对化合物6f收率的影响
2.2 杀虫活性
目标化合物6a~6i对朱砂叶螨(Tetranychuscinnabarinus)、粘虫(Orientalarmyworm)及蚜虫(Aphismedicaginis)的初步杀虫效果如表2所示。由表2可以看出,目标物6a~6i在500 μg/mL浓度下,对粘虫都有优异的防治效果,其杀死率均为100%,与对照药啶虫丙醚的杀虫效果(100%)相当;当浓度降至100 μg/mL时,6a~6i均未表现出杀粘虫活性。此外,化合物6a~6i在500 μg/mL浓度下对蚜虫和朱砂叶螨均未呈现出杀虫作用。这些初步杀虫试验数据表明,引入N-吡啶基吡唑基团后,化合物6a~6i具有较好的杀粘虫效果,可作为针对粘虫的农药先导骨架进一步衍生合成与生物活性研究。
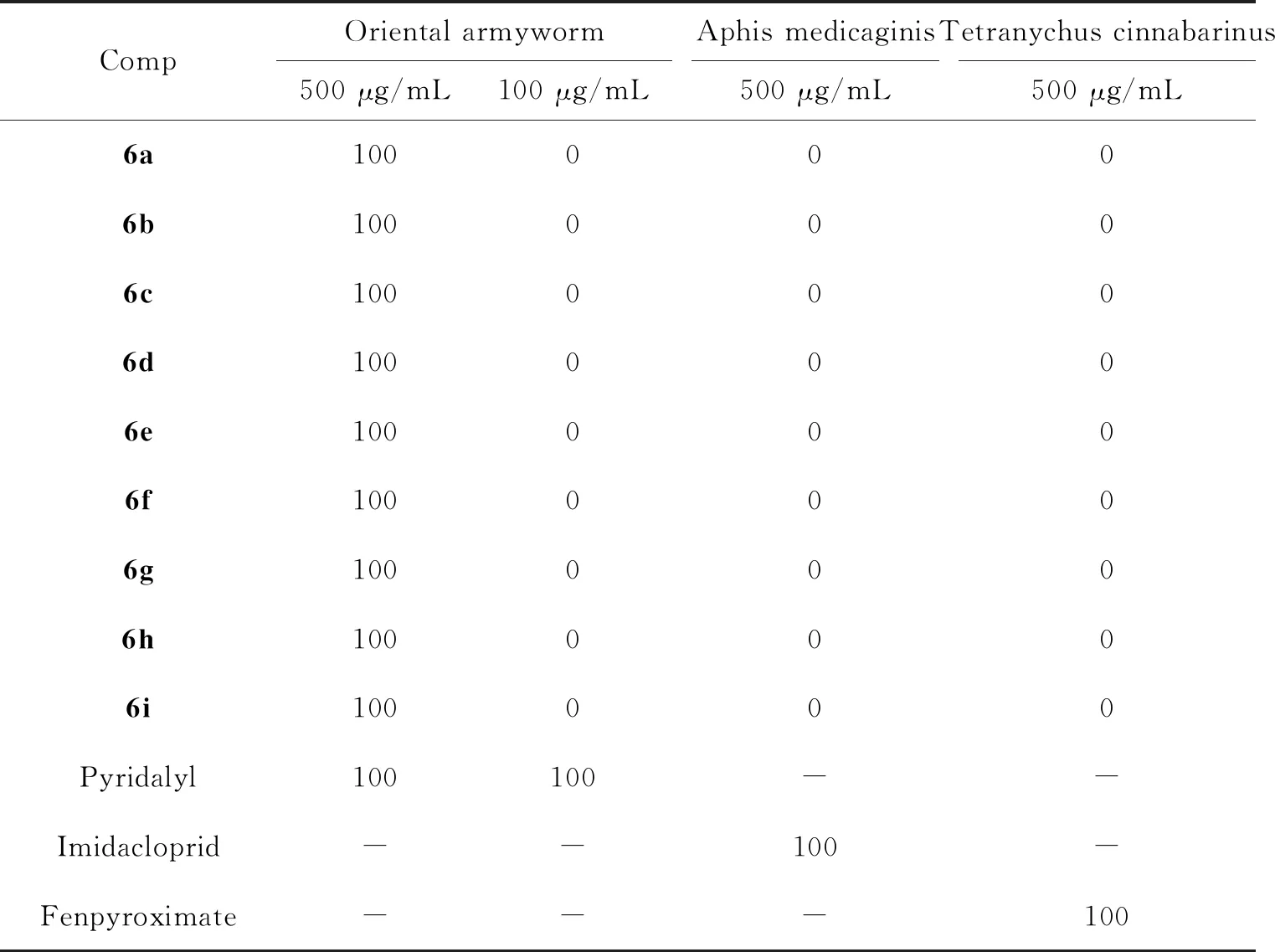
表2 化合物6a~6i的杀虫活性(死亡率,%) a
合成了9个新型含N-吡啶基吡唑骨架单元的吡唑肟衍生物(6a~6i),目标物6a~6i的结构采用1H NMR、13C NMR和元素分析进行了表征。初步的杀虫活性数据表明,在浓度为500 μg/mL时,6a~6i对粘虫均显示出100%的防效,为今后进一步进行吡唑肟类化合物分子合成及杀虫活性研究提供了参考。

