宫颈癌前病变组织中Galectin-3 和P27kip1 蛋白的表达与临床预后的关系
蒲 丹
(宜宾市第二人民医院/四川大学华西医院宜宾医院病理科,四川 宜宾 644000)
宫颈癌(cervical cancer)系女性生殖系统常见的恶性肿瘤,位居全球女性癌症死因第2 位。近年来,随着生活方式的改变及社会观念的更新,宫颈癌检出率相对增高,且患病年龄呈年轻化趋势[1]。肿瘤生物学特性研究发现,宫颈上皮内瘤样变(CIN)是宫颈癌发生的重要癌前病变,多数呈渐进式发展,如若为进行治疗或干预经过数年可进展为宫颈癌[2]。因此,宫颈上皮内瘤样变的组织特性与宫颈癌的发生密切相关。高危型人乳头瘤病毒(HPV)感染和多种致病基因表达异常在宫颈癌前病变中发挥重要作用[3]。半乳糖凝集素-3(Galectin-3)是凝集素家族成员,调控细胞间黏附、转移、血管生成、凋亡与免疫耐受等行为[4]。血管新生是原位肿瘤细胞和转移部位生长的必要条件,也是靶器官定位和循环血液转移的重要因素[5]。研究证实[6],Galectin-3 可激活N-乙酰氨基葡萄糖转移酶Ⅴ,继而导致血管内皮生长因子(VEGF)-2 磷酸化,促进血管新生。有学者认为,Galectin-3 高表达在宫颈癌的发生和发展中发挥重要作用[7]。但也有学者持反对意见,认为Galectin-3在正常宫颈及慢性宫颈炎组织中呈强阳性表达,而在宫颈癌前病变及浸润性癌中呈递减趋势[8]。因此,Galectin-3 表达水平与宫颈癌的发生关系还需要深入分析。此外,肿瘤的细胞周期改变在疾病的发生中同样起重要作用。P27 kip1 蛋白是多功能周期素依赖激酶抑制剂,通过抑制cyclinD-CDK 4 和cyclinE-CDK 2 等复合物活性,使细胞停滞在G1期,减少G1/S 期转换[9],影响细胞分化和凋亡,抑制细胞增殖[10]。另有研究认为[11],P27 kip1 蛋白表达下调可能成为早期诊断宫颈癌和预后评估的敏感性指标。基于此,该研究重点分析宫颈癌前病变组织中Galectin-3 和P27 kip1 蛋白的表达与临床预后的关系。
1 资料与方法
1.1 一般资料 选择2017 年1 月-2018 年1 月宜宾市第二人民医院/四川大学华西医院宜宾医院诊断CIN 患者共74 例,均经宫腔镜活检,病理确诊。其中CINⅠ20 例,CINⅡ24 例,CINⅢ30 例,分别设为CINⅠ组,CINⅡ组,CINⅢ组;CINⅠ组年龄45~66 岁,平均年龄(51.20±8.60)岁,高危HPV 感染8例(40.00%);CINⅡ组年龄44~68 岁,平均年龄(53.20±7.90)岁,高危HPV 感染12 例(50.00%);CINⅢ组年龄46~52 岁,平均年龄(52.60±6.80)岁,高危HPV 感染17 例(56.67%);三组患者年龄以及高危HPV 感染率比较,差异无统计学意义(P>0.05),研究可比。该研究取得患者知情同意,并获得宜宾市第二人民医院/四川大学华西医院宜宾医院伦理协会审批,采用宫颈锥切或根治术治疗,未行放化疗。
1.2 方法 采用免疫组化染色法检测组织中Galectin-3 和P27 kip1 蛋白的阳性表达,PCR 和Western blot 法检测Galectin-3 和P27 kip1、VEGF-2和cyclinD 的mRNA 和蛋白的定量表达水平。常规制作组织切片,厚度5 μm,-80 ℃保存。随访时间10~23 个月,中位时间16.5 个月,比较复发率。
1.2.1 免疫组化染色法 ①将石蜡切片脱蜡至水,PBS 浸泡5 min,滴加3% H2O2溶液,于室温下孵育10 min,以灭活内源性H2O2酶;②PBS 进行洗涤3×3 min,滴加正常山羊血清工作液封闭抗体,室温下孵育10 min;③倒去血清,不要清洗,滴加鼠抗人Galectin-3 和P27 kip1 单克隆抗体及内参β-actin一抗(美国Sigma 公司,1∶2000),于湿盒内4 ℃孵育过夜;④PBS 洗涤3×3 min,滴加生物素标记的兔抗鼠IgG 二抗(美国Sigma 公司,1∶500),37 ℃孵育20 min;⑤PBS 洗涤3×3 min,滴加适量SABC 液(江苏碧云天科技有限公司),37 ℃孵育20 min;⑥PBS 洗涤3×3 min,DAB 显色,显微镜下控制显色程度,3~10 min,蒸馏水充分冲洗、复染、封固。结果根据染色强度和阳性细胞百分比,采用半定量法表示,即胞浆或胞核黄染至深棕色为染色阳性,阴性计0 分、+计1 分、++计2 分、+++计3 分,阳性细胞百分比≤5%计0 分、6%~25%计1 分、26%~50%计2 分、51%~75%计3 分、>75%计4 分;两项乘积0~3 为阴性,4~12 为阳性。
1.2.2 RT-PCR 法 ①在液氮中研碎组织,予每50~100 mg 组织加入1 ml Trizol 试剂,匀浆组织;吸去培养液,PBS 洗涤,在培养板上加入Trizol 裂解细胞,于6 孔板上每孔加入1 ml,移液器吹打;②室温放置5 min,以Trizol 和氯仿比例1∶0.2 混匀,室温放置3 min;4 ℃5000 r/min 离心15 min,样品分3层,取上层无色水相RNA 混合液;③吸取400~600 μl 液体至EP 管,以Trizol 和异丙醇比例1∶0.5沉淀RNA,混匀室温放置10 min;再次离心取沉淀,加入75%乙醇洗涤RNA 沉淀,再次离心弃上清;室温干燥RNA 沉淀,加入25~100 μl 无RNase水促溶,紫外分光光度计测定浓度后,-20 ℃保存;④根据反转录试剂盒提示合成cDNA,上海生工有限公司根据Gene Bank 序列合成引物序列,表1 所示反应体系为cDNA 2 μl+正逆向引物各1 μl+Taq聚合酶0.5 μl+dNTPs 0.5 μl+MgCl21 μl+10×Buffer 2.5 μl,加水至25 μl。反应条件为94 ℃2 min、94 ℃30 s、55 ℃30 s、72 ℃30 s,共30 个循环,72 ℃7 min,4 ℃保温;⑤根据产物长度选择对应浓度的琼脂糖凝胶,取适量PCR 产物与上样缓冲液混合,电泳参数为电压120 V,电流60 mA,时间45~60 min,凝胶成像分析系统成像,数码照相行灰度值分析。
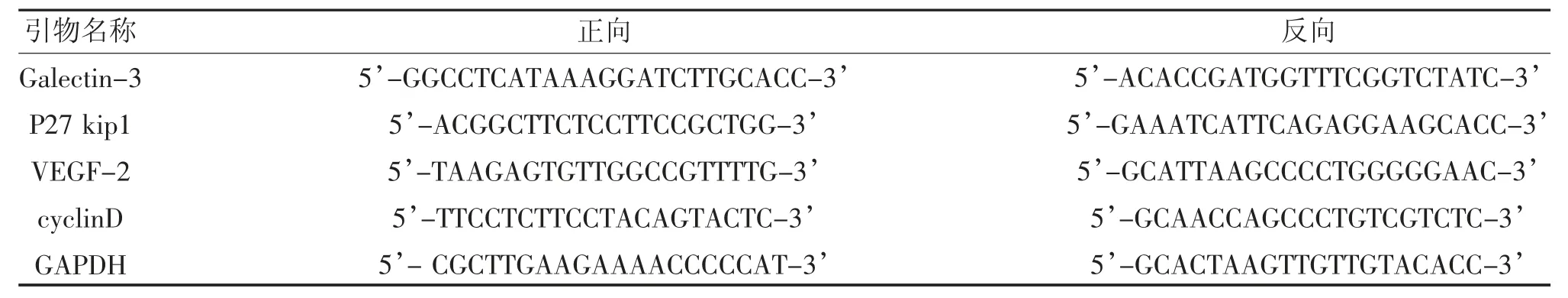
表1 各引物序列
1.2.3 Western blot 法 病灶组织匀浆后加RIPA 裂解液(北京中杉金桥生物有限公司)提取细胞总蛋白,BCA 蛋白定量试剂盒(美国Sigma 公司)测定蛋白浓度,经内参β-actin 抗体剂量标准化。取30 μg总蛋白,8%SDS-PAGE 电泳分离,转移至PVDF膜;然后加鼠抗人Galectin-3 和P27 kip1、VEGF-2和cyclinD 一抗(1∶2000,美国Sigma 公司)静置过夜,PBS 洗涤后加兔抗鼠二抗(1∶500,美国Sigma 公司)室温孵育4 h;PBS 洗涤,ECL 显色。结果扫描保存,Lab Works4.5 凝胶成像软件行半定量分析。
1.3 统计学方法 采用SPSS 20.0 统计软件,计量资料以()表示,行单因素ANOVA 分析,进一步比较采用LSD-t法检验;计数资料采用[n(%)]表示,行χ2检验;P<0.05 表示差异有统计学意义。
2 结果
2.1 免疫组化染色结果 CINⅢ组患者Galectin-3 阳性表达率高于CINⅠ组和Ⅱ组,而P27 kip1 则相反,差异有统计学意义(P<0.05),见图1、表2。

表2 免疫组化染色Galectin-3 和P27kip1 蛋白的阳性表达率[n(%)]

图1 免疫组化染色CIN 组织(×400)
2.2 PCR 结果 CINⅢ组患者Galectin-3、VEGF-2和cyclinD 的mRNA 定量表达水平高于其他两组,P27 kip1 低于其他两组,差异有统计学意义(P<0.05),见表3。
表3 PCR 结果()

表3 PCR 结果()
2.3 Galectin-3、P27 kip1、VEGF-2 和cyclinDmRNA水平的相关分析 对Galectin-3、P27 kip1、VEGF-2和cyclinD 的mRNA 定量表达水平进行Pearson 相关分析发现,Galectin-3 与VEGF-2 和cyclinD 呈正相关,P27 kip1 与VEGF-2 和cyclinD 呈负相关,Galectin-3 与P27 kip1 呈负相关(P<0.05),见表4。

表4 Galectin-3、P27 kip1、VEGF-2 和cyclinDmRNA 水平的相关分析
2.4 Western blot 结果 CIN Ⅲ组患者Galectin-3、VEGF-2 和cyclinD 的蛋白定量表达水平高于其他两组,P27 kip1 低于其他两组,差异有统计学意义(P<0.05),见表5。
表5 Western blot 结果()

表5 Western blot 结果()
2.5 Galectin-3、P27 kip1、VEGF-2 和cyclinD 蛋白水平的相关分析 对Galectin-3、P27 kip1、VEGF-2和cyclinD 的蛋白定量表达水平进行Pearson 相关分析发现,Galectin-3 与VEGF-2 和cyclinD 呈正相关,P27 kip1 与VEGF-2 和cyclinD 呈负相关,Galectin-3 与P27 kip1 呈负相关(P<0.05),见表6。

表6 Galectin-3、P27 kip1、VEGF-2 和cyclinD 蛋白水平的相关分析
2.6 随访复发率 随访CINⅠ组复发1 例(5.00%),CINⅡ组复发3 例(12.50%),CINⅢ组复发11 例(36.67%),以复发为终点事件绘制生存曲线,见图2。CINⅢ组复发率高于CINⅠ组和CINⅡ组,差异有统计学意义(χ2=4.055、5.123,P<0.05);随访共复发15 例,其中Galectin-3 阳性11 例,阴性4 例,Galectin-3 阳性表达患者复发率高于阴性表达患者[32.35%(11/34)vs10.00%(4/40),χ2=5.682,P=0.017];P27 kip1 阳性3 例,阴性12 例,P27 kip1 阴性表达患者复发率高于阳性表达患者,差异有统计学意义[35.29%(12/34)vs7.50%(3/40),χ2=8.785,P=0.003]。

图2 三组复发为终点的生存曲线
3 讨论
恶性肿瘤细胞的增殖和转移是影响肿瘤细胞治疗和预后的重要因素。因此,了解影响和调节恶性肿瘤增殖和转移的因素及其机制,对于肿瘤的早期诊断和预后具有重要意义。Galectin-3 广泛表达于正常组织和肿瘤组织中,参与细胞生长与分化、凋亡、粘附、血管新生、浸润和转移等[12]。以往研究表明[13,14],Galectin-3 表达上调与胃癌、结直肠癌、肝癌、胰腺癌和食管癌的发生和发展密切相关,同时,Wang L 等[6]研究也证实,Galectin-3 上调与宫颈癌转化和转移有关。细胞周期改变在肿瘤形成过程中也发挥重要作用,P27kip1 蛋白是多功能周期素依赖激酶抑制剂,可抑制cyclinD、CDK 4 等活性,使细胞停滞在G1期,减少G1/S 期转换,抑制细胞增值[9]。
本研究结果显示,CINⅢ组患者Galectin-3 阳性表达率高于CINⅠ和Ⅱ组,而P27 kip1 则相反,差异有统计学意义(P<0.05),表明CIN 分期越高,Galectin-3 阳性率越高,P27 kip1 越低,临床上80%以上宫颈癌是由CIN 进展而来。因此,研究CIN 的组织特性对分析宫颈癌的发生发展具有重要意义。Galectin-3 基因定位于人染色体14q21~22,含有1个特殊嵌合体结构,可导致肿瘤表面黏蛋白1 构象改变,暴露黏附分子CD44 和配体位,在体内外均可诱导T 细胞凋亡,发生免疫逃逸,促使肿瘤细胞的黏附和转移[15,16]。此外,Galectin-3 能够抑制肿瘤坏死因子如CD95 诱导的肿瘤细胞凋亡,对放化疗产生耐受性[17]。研究显示[18],Galectin-3 阳性表达与宫颈癌患者的盆腔淋巴结转移与较差的预后相关。CIN Ⅲ组患者Galectin-3、VEGF-2 和cyclinD 的mRNA 和蛋白的定量表达水平高于其他两组,P27 kip1 低于其他两组,差异有统计学意义(P<0.05)。Galectin-3 主要表达于细胞质,也可表达于细胞核及细胞膜上。VEGF 与其受体结合后,激活信号转导通路,促进血管及淋巴管生成,为肿瘤的生长和转移提供物质基础[19]。唐瑶等[20]研究发现,宫颈鳞癌患者血清VEGF 及其受体水平明显高于健康对照组,证实VEGF 在宫颈癌患者体内表达水平升高。经Pearson 相关分析发现,Galectin-3 与VEGF-2 和cyclinD mRNA 和蛋白表达呈正相关,P27 kip1 与VEGF-2 和cyclinD 呈负相关,Galectin-3 与P27 kip1呈负相关(P<0.05)。P27 kip1 蛋白有抑制细胞增生分裂及促进分化成熟的功能,其通常在中层和表层上皮细胞的细胞核中表达,而在增生活跃的基底层细胞中表达较少,甚至无表达。HPV 的基因产物在G1期释放大量的转录因子,激活S 期所需的基因表达,产生多种细胞周期运行所需要的蛋白质如cyclinE等,cyclinE 与P27 kip1 结合可诱导HPV 基因产物降解[21]。因此,P27 kip1 蛋白表达下调既可能与HPV感染有关,也可能是细胞周期调控紊乱的结果[22]。由此分析,上述指标间可能存在协同作用,如Galectin-3 与VEGF-2 和cyclinD 可协同促进宫颈癌的发生,而P27 kip1 则起拮抗作用。影响宫颈癌发生的分子可能较多,如何筛选具有高效表达的活性分子对宫颈癌的机制研究和临床靶向干预有极为重要的意义。
进一步随访发现,CINⅢ组复发率高于其他两组,并且Galectin-3 阳性表达患者复发率高于阴性表达患者,P27 kip1 阴性表达患者复发率高于阳性表达患者(P<0.05),表明Galectin-3 高表达可能是宫颈癌发生、发展和预后不良的危险因素,而P27 kip1则发挥保护作用。因此推断CIN 组织Galectin-3 表达上调和P27 kip1 表达下调与肿瘤进展的联系,涉及血管新生、细胞黏附、凋亡抑制、免疫逃逸、HPV 感染及细胞周期调控等多种机制,这一结论为宫颈癌的早期诊断及预后评估提供了重要参考指标,其临床应用价值还需要进一步验证。

