PD患者血清AngⅡ、OPN、Ang(1-7)表达与其抑郁、焦虑症状的关系
姜文菊,王莉莉,张美颖,马 静
首都医科大学附属北京世纪坛医院:1.神经内科;2.神经与精神科,北京 100038
帕金森病(PD)是现阶段临床中较为常见的神经变性疾病,主要以进行性黑质致密体内多巴胺能神经元脱失、变性为主要病理特征,神经元内多伴随出现Lewy小体[1]。有研究结果显示,PD病变并非单独局限于黑质,患者嗅球、自主神经、皮质等也可出现类似病理性改变,并与患者非运动症状等密切相关[2]。目前PD神经元变性发生和发展的致病性因素尚未完全揭示,线粒体功能障碍、氧化应激、炎性反应等可能起到十分重要的作用[3]。近年来,有研究结果显示体内肾素-血管紧张素系统具有促炎性反应和促氧化应激作用,血管紧张素(Ang)Ⅱ和Ang(1-7)是该系统的重要组成活性物质,可启动或加剧多巴胺能细胞死亡,在PD发生和发展过程中扮演重要角色[4]。骨桥蛋白(OPN)是体内中枢神经系统免疫炎性反应中重要的炎性蛋白质,在多种神经炎症性疾病发生过程中具有重要作用[5]。但AngⅡ、Ang(1-7)、OPN与PD患者临床症状的相关性仍鲜有报道,故本研究选择本院收治的PD患者作为研究对象,分析AngⅡ、Ang(1-7)、OPN与患者抑郁、焦虑症状的关系。
1 资料与方法
1.1一般资料 选择本院2020年1月至2021年12月收治的80例PD患者作为观察组,其中男48例、女32例,平均年龄(66.29±4.58)岁,平均受教育年限(6.84±2.39)年,平均体质量指数(BMI)为(24.31±1.32)kg/m2,平均统一帕金森病评分量表(UPDRS)Ⅲ评分为(35.43±8.44)分。纳入标准:(1)患者符合PD诊断标准[6];(2)无恶性肿瘤;(3)无免疫性疾病;(4)无酒精药物滥用史或精神疾病。排除标准:(1)合并心脑血管疾病、内分泌疾病;(2)合并骨关节病、阿尔兹海默病等疾病;(3)因脑炎、脑出血等导致的继发性PD;(4)纹状质变性病、进行性核上性麻痹等;(5)主动申请退出本研究。选择同期50例体检健康者作为对照组,其中男28例、女22例,平均年龄(67.64±5.16)岁,平均受教育年限(6.72±2.16)年,平均BMI(24.27±1.24)kg/m2,两组受试者一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经本院伦理委员会审议并批准,所有受试者对本研究知情并签署知情同意书。
1.2方法 在患者入组后采集空腹静脉血,离心收集血清,采用酶联免疫吸附试验(ELISA)检测血清中AngⅡ(JL12229,江莱生物)、OPN(EK0482,Sciencell)、Ang(1-7)(YJ403348,上海一基)水平,并严格遵照试剂盒说明书进行操作和质控。入组后采用汉密尔顿焦虑量表(HAMA)和17 项汉密尔顿抑郁量表(HAMD-17)评估患者焦虑及抑郁情况,得分越高患者焦虑及抑郁症状越严重,其中HAMA评分≥14分则判定为焦虑,HAMD-17评分≥17分则判定为抑郁,所有患者均独立完成相关量表,在患者出现疑问后由专业医护人员向其详细解释。

2 结 果
2.1两组受试者AngⅡ、Ang(1-7)和OPN水平比较 观察组血清AngⅡ、Ang(1-7)和OPN水平均低于对照组,差异有统计学意义(P<0.05),见表1。

表1 两组AngⅡ、Ang(1-7)和OPN水平比较
2.2不同HAMA、HAMD-17评分PD患者血清AngⅡ、Ang(1-7)和OPN水平比较 伴随焦虑症状和抑郁症状的PD患者血清Ang Ⅱ、OPN、Ang(1-7)水平低于无焦虑症状和抑郁症状的PD患者,差异有统计学意义(P<0.05),见表2。

表2 不同HAMA、HAMD-17评分PD患者血清AngⅡ、Ang(1-7)和OPN水平比较
2.3AngⅡ、Ang(1-7)、OPN与PD患者抑郁和焦虑的关系 PD患者血清低水平AngⅡ、OPN、Ang(1-7)是影响PD患者焦虑和抑郁症状的独立危险因素(P<0.05),见表3。
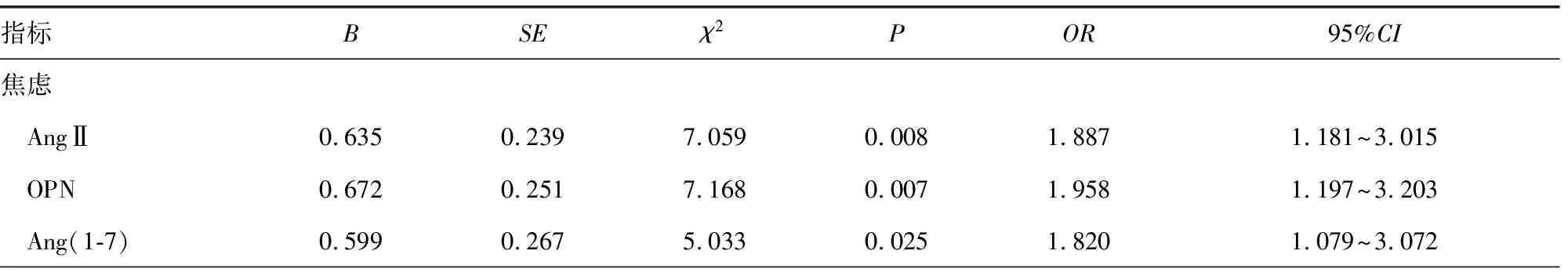
表3 AngⅡ、Ang(1-7)、OPN与PD患者抑郁和焦虑的关系
3 讨 论
环境因素、线粒体功能障碍、基因、氧化应激、炎症和细胞凋亡均可能导致PD的发生和发展[7]。有研究结果显示,一般情况下免疫反应和炎性反应在PD患者体内多巴胺能神经元凋亡过程中扮演着十分重要的角色[8]。目前研究指出,PD属于进展性和慢性疾病,且目前临床中尚缺乏有效的治疗方案,PD的致残率较高,会直接影响患者的正常生活和工作,同时伴随出现的运动功能障碍可能给患者造成巨大的心理负担[9]。有学者发现,PD患者多伴随一定的抑郁和焦虑症状,可能与自理能力下降、药物治疗效果不佳、缺少社会支持等因素密切相关[10]。因此临床中有效且有针对性地分析导致抑郁和焦虑的危险因素,并给予针对性干预有助于减轻患者身心负担,改善患者生活质量,具有十分重要的意义[11]。
肾素血管紧张素系统是体内重要的调节水盐平衡和血压的系统之一[12]。肾小球细胞可合成并释放无活性前体血管紧张素原,后被血管紧张素转化酶(ACE)水解后形成有活性的AngⅡ,且ACE2还可参与调控肾素血管紧张素系统旁路代谢,通过Ang(1-7)代谢产物参与G蛋白偶联受体的多种代谢网络,起到协同激活血管紧张素受体的作用[13]。肾素血管紧张素系统也是体内重要的触发脑内细胞凋亡的重要因素,动物模型结果显示,肾素血管紧张素系统可有效调节纹状体的多巴胺释放,且PD模型采用血管紧张素受体拮抗剂干预可起到减少神经元坏死和升高纹状体多巴胺水平的作用,可与多巴胺系统交互作用,起到抗氧化和抗炎的作用[14]。OPN在神经退行性疾病的发生和发展过程中起到十分重要的作用,在大脑黑质中可参与控制胶质细胞介导的神经炎性反应。研究结果证实,OPN还可参与体内线粒体损伤、细胞凋亡、氧化应激、细胞因子趋化和调控等,PD与OPN多巴胺能神经元丢失密切相关[15]。注入脂多糖后大鼠脑黑质多巴胺能神经元水平明显降低,且黑质内OPN表达水平与巨噬细胞和小胶质细胞活化呈时间依赖性。
本研究结果显示,观察组血清AngⅡ、Ang(1-7)和OPN水平均低于对照组,伴随焦虑和抑郁症状的PD患者血清AngⅡ、OPN、Ang(1-7)水平低于无焦虑和抑郁症状的PD患者,差异均有统计学意义(P<0.05),提示AngⅡ、OPN、Ang(1-7)水平降低可进一步加重PD患者病情,导致患者抑郁和焦虑症状的出现。此外,多因素Logistic回归分析结果显示,PD患者血清低水平AngⅡ、OPN、Ang(1-7)是PD患者焦虑和抑郁症状的独立危险因素。分析认为,AngⅡ、Ang(1-7)水平降低而激发体液中肾素-血管紧张素系统的正反馈作用,促进促炎基因扩增,参与炎性反应,同时OPN水平降低,其抗炎、抗凋亡以及诱导活化细胞增殖的能力减弱,因此三者在患者体内发挥的促炎作用增强,抗炎和神经保护作用减弱,增强小胶质细胞炎性反应,加剧体内氧化应激,导致脑内神经元受损程度加重,中枢神经系统受损程度加重,病情恶化导致患者出现抑郁和焦虑等症状。
综上所述,PD患者血清AngⅡ、OPN、Ang(1-7)呈明显低表达状态,也是影响PD患者抑郁、焦虑症状的独立危险因素。但本研究并未对患者进行长期随访,也未对患者治疗前后各指标的变化水平进行检测,有待后续深入分析探讨。

