过敏性紫癜患儿TLR4、LTB4、SOCS5表达与Th1和Th2的关系*
黄翠影,李 军,张 菂,蔡 花,幺 鑫,王彩芳△
1.河北省唐山市妇幼保健院儿内科,河北唐山 063000;2.开滦总医院麻醉科,河北唐山 063000;3.开滦总医院儿科,河北唐山 063000
过敏性紫癜(HSP)属于系统性血管炎的一种,主要是由免疫复合物介导的出血性疾病[1]。大多数学者认为HSP是由免疫蛋白A介导的免疫复合物沉积在血管壁所诱发的免疫损伤,扩增血管壁的通透性,血液与淋巴液从其中渗出,最终导致体内多部位发生病变[2]。同时,HSP也会受细胞免疫功能紊乱、细胞因子等影响[3]。HSP发病的关键就是感染,而Toll样受体(TLR)则能够对病原相关分子模式进行识别,且在辅助型T细胞1(Th1)/辅助型T细胞2(Th2)免疫应答失衡期间,TLR也会参与其中[4]。而在过敏性炎症迟发阶段,白三烯B4(LTB4)为具有大量表达的炎症介质参与炎性反应过程[5],细胞因子信号传导抑制蛋白(SOCS)是一类由多种细胞因子诱导产生,对细胞因子信号转导具有抑制作用的负调节因子,SOCS5正向调控Th1分化,负向调控Th2分化[6],但其与Th1和Th2关系的研究较少,因此本研究通过对HSP患儿的TLR4、LTB4、SOCS5和Th1/Th2表达及关系进行分析,旨在为临床HSP患儿的诊断和治疗提供依据,现报道如下。
1 资料与方法
1.1一般资料 本研究选取2018年6月至2021年6月河北省唐山市妇幼保健院和开滦总医院接诊的86例HSP患儿作为研究组,选取同期河北省唐山市妇幼保健院和开滦总医院体检健康儿童90例作为对照组,回顾性收集病历资料和实验室检查资料。研究组男46例,女40例;年龄3~12岁,平均(8.57±1.65)岁;分型:单纯型20例,混合型66例,根据是否伴有肾损害将混合型HSP患儿分为伴有肾损害组(23例)和未伴有肾损害组(43例)。对照组男51例,女39例;年龄3~12岁,平均(8.51±1.71)岁。两组患儿性别、年龄等一般资料差异均无统计学意义(P>0.05),具有可比性。纳入标准:(1)根据《诸福棠实用儿科学(第7版)》[7]儿童HSP诊疗规范,符合HSP的诊断标准且需具备HSP诊疗依据;(2)入组前1个月内未接受相关糖皮质激素治疗;(3)HSP和健康儿童临床资料均齐全。排除标准:(1)临床病历资料不完整;(2)入组前1个月内存在感染史或过敏性疾病史;(3)患儿入组前1个月内接受糖皮质激素或其他免疫制剂的治疗;(4)患儿合并先天性遗传性疾病;(5)患儿合并免疫性疾病、恶性肿瘤或其他慢性疾病;(6)患儿凝血功能异常。本研究经医院伦理委员会审核批准。均与儿童家属取得联系,获得家属知情同意。
1.2方法
1.2.1资料收集 研究组:(1)入院前已经确诊,需要对患儿的病例资料完整收集,并进行核对和检查;(2)入院前未经确诊,于入院时抽取静脉血2 mL,采集血液标本后,将血液在3 h内分离血清,以3 500 r/min离心15 min后取其上清液,并将其置于-20 ℃的环境中保存备检。对照组:收集所有健康儿童体检时临床资料和实验室检查资料。
1.2.2酶联免疫吸附试验(ELISA) 送检测定LTB4和Th1、Th2水平[选取两个代表性指标白细胞介素(IL)-4和γ干扰素(IFN-γ)]采用ELISA测定,试剂盒购自上海邦景实业有限公司,根据说明书进行严格操作。
1.2.3外周血检测 外周血单核细胞:使用肝素钠抗凝管收集所有纳入研究儿童外周静脉血5 mL,将其外周血单核细胞进行分离,应用RNA提取并悬浮,完成后将其置于-80 ℃冰箱,待测TLR4和SOCS5 mRNA水平。采用TLR4和SOCS5分离试剂盒(上海瑞番生物科技)提取所需总RNA,详细步骤按照说明书进行,再使用逆转录试剂盒将cDNA合成PCR引物,以GAPDH作为内参基因,引物序列见表1。
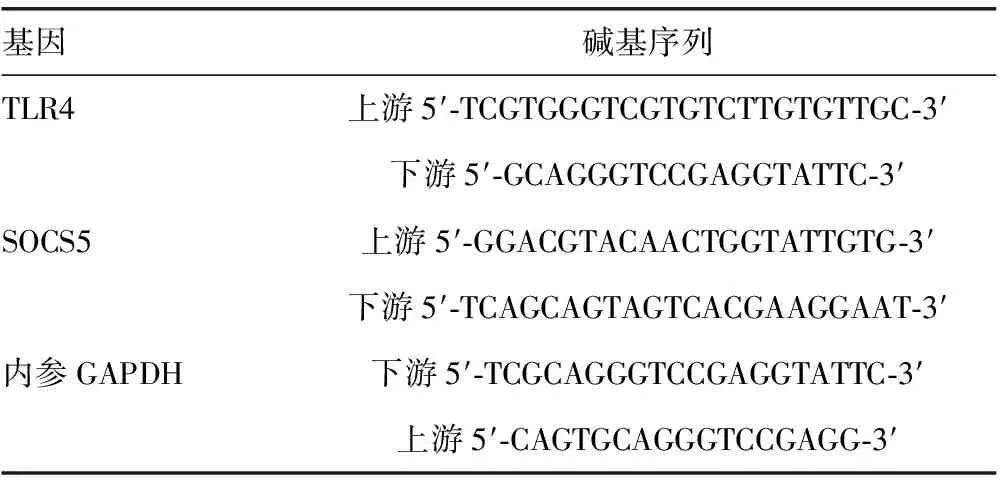
表1 PCR引物序列
1.2.4基因检测 SOCS5基因表达:反应体系为每个样品设3个重复,循环条件为95 ℃。反应条件为95 ℃和60 ℃下分别循环30 s、95 ℃下预变性3 min,并将60 ℃的温度下时间延长至30 s退火,并将72 ℃延伸至60 s,共计39个循环。TLR4基因表达检测:反应体系为每个样品设3个重复,循环条件为95 ℃ 5 min,95 ℃和60 ℃下分别循环30 s、72 ℃下循环30 s,共对其进行循环40次,并将60 ℃的温度下时间延长至5 min。
2 结 果
2.1研究组和对照组TLR4、SOCS5 mRNA表达水平比较 研究组TLR4 mRNA和SOCS5 mRNA表达水平均高于对照组,差异有统计学意义(P<0.05),见表2。

表2 研究组和对照组TLR4和SOCS5 mRNA表达水平比较
2.2研究组和对照组LTB4、Th1和Th2表达水平比较 研究组LTB4和IL-4表达水平均高于对照组,IFN-γ表达水平低于对照组,差异均有统计学意义(P<0.05),见表3。

表3 研究组和对照组LTB4、Th1和Th2表达水平比较
2.3不同分型HSP患儿TLR4、SOCS5 mRNA表达水平比较 混合型HSP患儿TLR4 mRNA和SOCS5 mRNA表达水平均高于单纯型HSP患儿,差异有统计学意义(P<0.05),见表4。

表4 不同分型HSP患儿TLR4、SOCS5 mRNA表达水平比较
2.4不同分型HSP患儿LTB4、Th1和Th2表达水平比较 混合型HSP患儿LTB4和IL-4表达水平均高于单纯型HSP患儿,IFN-γ表达水平低于单纯型HSP患儿,差异均有统计学意义(P<0.05),见表5。

表5 不同分型HSP患儿LTB4、Th1和Th2表达水平比较
2.5是否伴有肾损害HSP患儿TLR4、SOCS5 mRNA表达水平比较 HSP混合型组中伴有肾损害患儿TLR4 mRNA和SOCS5 mRNA表达水平均高于未伴有肾损害患儿,差异有统计学意义(P<0.05),见表6。

表6 是否伴有肾损害HSP患儿TLR4和SOCS5 mRNA表达水平比较
2.6是否伴有肾损害HSP患儿LTB4、Th1和Th2表达水平比较 HSP混合型组中伴有肾损害患儿LTB4和IL-4表达水平均高于未伴有肾损害患儿,IFN-γ表达水平低于未伴有肾损害患儿,差异均有统计学意义(P<0.05),见表7。

表7 是否伴有肾损害HSP患儿LTB4、Th1和Th2表达水平比较
2.7TLR4、LTB4和SOCS5表达水平与IFN-γ和IL-4表达水平的相关性 TLR4、LTB4和SOCS5表达水平与IFN-γ均呈负相关(r=-0.920、-0.935、-0.970,P<0.05);TLR4、LTB4和SOCS5表达水平与IL-4均呈正相关(r=0.991、0.975、0.973,P<0.05)。
2.8TLR4、LTB4、SOCS5、IFN-γ和IL-4对HSP的诊断价值 TLR4、LTB4、SOCS5、IFN-γ和IL-4诊断HSP的ROC曲线下面积(AUC)均在0.750以上,均具有较高的特异度和灵敏度,其中联合检测的AUC为0.977,显著高于各项单独检测,见表8、图1。
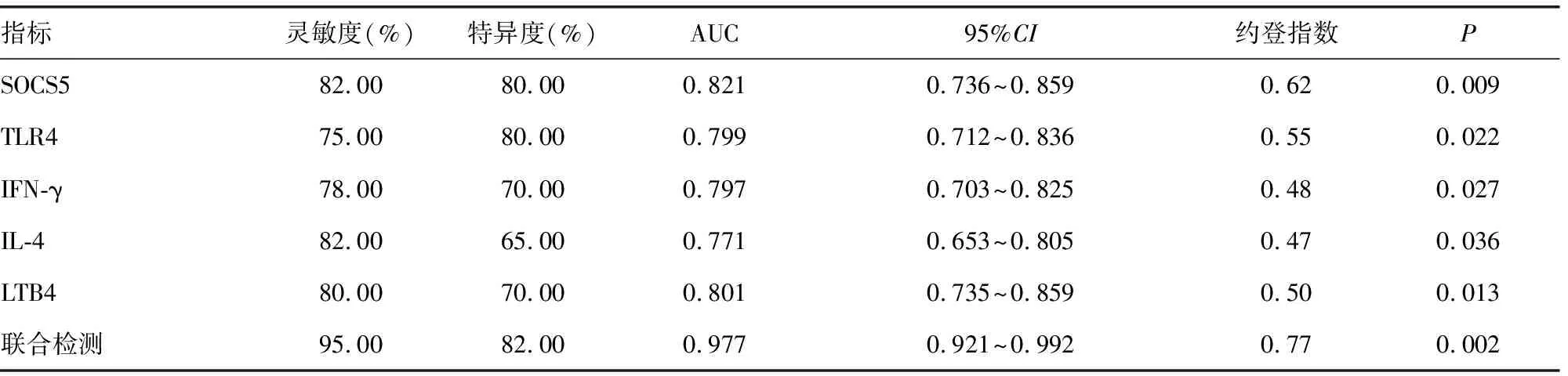
表8 TLR4、LTB4、SOCS5、IFN-γ和IL-4对HSP的诊断价值

图1 TLR4、LTB4、SOCS5、IFN-γ和IL-4诊断HSP的ROC曲线
3 讨 论
儿童HSP属于儿科常见疾病,其发病率呈逐年升高趋势,目前临床认为该疾病是由多种因素所作用,并非单一因素所致[8],发病机制可能为:(1)受环境因素影响,可刺激T淋巴细胞,导致免疫功能发生紊乱,并促使T淋巴细胞不断扩增,最终使得免疫球蛋白A介导广泛白细胞碎裂,形成小血管炎;(2)机体内炎症细胞因子水平的提高;(3)凝血因素也会产生影响,可见机体内小血管存在局部血栓[9]。近几年有学者针对T淋巴细胞亚群展开研究,研究结果却并不统一,但其中关于HSP患儿存在辅助型T细胞(Th)免疫功能紊乱的观点却比较一致[10]。在疾病急性发作期,患儿体内还存在Th1/Th2失衡的情况,在机体免疫反应中,Th是重要的调控/效应细胞,若Th1/Th2失衡,则会导致机体内免疫功能出现失衡的情况,同时在其他因子协同作用下发生免疫性疾病[11]。
IFN-γ是机体Th1分泌的主要细胞因子,在细胞免疫应答反应过程中参与介导,IL-4是由机体Th2分泌的细胞因子,主要在机体体液免疫过程中参与介导[12]。有学者指出,在HSP的发病过程中,机体体液免疫应答过程逐渐增强,通过Th2对抗原的识别功能可以促进B细胞的克隆活化,从而为机体提供抗原和刺激信号,促进机体循环[13]。在本研究中,研究组IL-4表达水平高于对照组,IFN-γ表达水平低于对照组,差异均有统计学意义(P<0.05),提示HSP患儿体内Th1/Th2紊乱,Th2活化程度过强,体液免疫功能增强。
TLR不仅表达于人体单核巨噬细胞、淋巴细胞及树突细胞等细胞表面,同时也在纤维细胞中有表达,目前已有相关研究指出TLR参与机体的免疫应答过程,与机体炎性反应存在密切关系,并可介导机体炎症和免疫功能紊乱,进而导致机体免疫性疾病的发生[14]。TLR4是机体中最重要的TLR分子之一,本研究发现HSP患儿体内TLR4分子呈高表达,且随着患儿病情的加重和混合病型的出现,TLR4逐渐升高,分析其原因主要为当机体外周血中TLR4高表达时,外源性配体对其产生一定刺激,从而参与疾病的发生,同时该分子可以在机体内识别相关配体后对下游信号通路给予激活,从而调节机体多种细胞因子的合成[15]。此外,本研究发现TLR4与IL-4呈正相关,与IFN-γ呈负相关,推测在Th1和Th2生成过程中,TLR4在机体内的高表达可能参与其调节机制,从而实现对Th1和Th2免疫应答的调控。
而当机体发生免疫反应时,花生四烯酸经酶会产生一定的促炎性反应作用,从而促进LTB4的产生,LTB4在机体的多种疾病和反应过程中均有参与,是对细胞产生强烈效应的一种细胞催化剂[16]。在本研究中,研究组LTB4表达水平高于对照组(P<0.05),分析原因主要为LTB4可以将机体内参与免疫和炎性反应的细胞进行收集并激活,而该类细胞被激活后会反作用于LTB4的释放,使其在机体内形成放大效应,进而导致机体内发生多种炎性疾病[17]。此外,本研究发现LTB4与IL-4呈正相关,与IFN-γ呈负相关,分析其机制主要为机体内LTB4呈高表达时,体内嗜酸性粒细胞等被激活,将细胞因子的颗粒致敏反应给予提升,同时促进血管内炎性反应,增强患儿局部血管通透性,而IFN-γ表达的降低会在一定程度上对患儿免疫调控功能进行抑制,从而造成Th1/Th2平衡紊乱,进而抑制机体免疫功能和T淋巴细胞的杀伤效用[18]。
SOCS5主要由细胞因子诱导而产生,对细胞因子信号转导具有一定的抑制和调节作用,临床研究以SOCS1、SOCS3更为深入,对于SOCS5的研究较少,但有文献指出SOCS5正向调控Th1分化,负向调控Th2分化,且其主要表达在Th1[19]。在本研究中,研究组SOCS5 mRNA表达水平高于对照组,SOCS5表达水平与IL-4呈正相关,与IFN-γ呈负相关,分析其原因主要为SOCS5参与机体内免疫调节过程,是机体内具有生理调节作用的固有免疫因子,通过对巨噬细胞或树突细胞激活进行负向调控,参与机体调控T细胞分化、成熟和凋亡的过程,主要作用是维持Thl和Th2的稳定,在机体免疫调控中发挥重要作用,其中IL-4可以激活机体内STAT3信号通路,上调SOCS5表达,而干扰IFN-γ信号转导,主要参与调节T淋巴细胞的分化,使其共同参与HSP的发病[20]。此外,本研究还发现TLR4、LTB4、SOCS5、IFN-γ和IL-4诊断HSP的AUC均在0.750以上,均具有较高的特异度和灵敏度,其中联合检测诊断HSP的AUC为0.977,显著高于各项单独检测,推测上述因子均参与患儿的发病过程,且临床进行联合检测的应用价值较高,但具体机制尚未明确,在今后的研究中,可以通过进一步扩大样本量和进行基础研究,分析TLR4 mRNA、LTB4、SOCS5 mRNA、IL-4和IFN-γ在伴有肾损害HSP患儿中的作用机制。
综上所述,HSP患儿TLR4 mRNA、LTB4、SOCS5 mRNA及IL-4均呈高表达,IFN-γ呈低表达,TLR4、LTB4和SOCS5表达水平与IL-4呈正相关,与IFN-γ呈负相关,可以将其作为HSP患儿的诊断和治疗参考依据,值得在临床推广应用。

