土壤施用TM35对甜菜幼苗生长的影响
赵银,练雪萌,耿贵,於丽华,王宇光
(黑龙江大学现代农业与生态环境学院,哈尔滨 150080)
0 引言
甜菜(Beta vulgarisL.)是我国北方制糖产业的重要原料[1],是黎科甜菜属二年生草本植物,在我国主要分布在新疆、黑龙江、内蒙古等地,具有喜温、抗旱和强耐盐碱特性,种植甜菜对北方尤其对黑龙江大面积盐碱土的修复及开发利用具有较强的发展潜力[2]。
近年来,干旱、高盐度、极端天气(风、高温、寒冷)、重金属、光、农药等多种环境因素阻碍了植物的生长,导致农作物遭受重大损失[3]。甜菜在风的作用下发育缓慢,疾病严重程度增加,光合作用减弱[4],甜菜种株倒伏也是影响甜菜产量、质量的因素之一。因此,抵御甜菜环境胁迫,提高甜菜产量对甜菜发展具有重要意义。
TM35 是生产缩节胺的废渣,经测定其主要成分70%以上为石灰(碳酸钙),其余成分为氧化钙、氢氧化钙、缩节胺及季胺盐等物质。缩节胺为植物生长调节剂,又名助壮素[Mepiquat chloricie(MC)],商用名称为Pix,通用名为甲哌嗡[5],在调节植物生长生理方面起重要作用。潘香玉[6]研究发现土壤施用石灰可提高土壤pH,使水稻增产。陈鑫等[7]研究发现施用一定量的熟石灰可提高土壤pH,促进附子的生长发育、提高产量。缩节胺通过抑制赤霉素的生物合成减少棉花细胞伸长和降低细胞分裂速率,进而缩短植株节间长度,使株形紧凑,防止植物旺长[8-10]。柳延涛等[11]研究发现缩节胺可以提高向日葵叶片的叶绿素、可溶性蛋白含量,降低丙二醛的产生。钟瑞春等[12]研究发现喷施缩节胺可提高花生叶片的叶绿素含量和光合速率。王汝娟等[13]研究发现缩节胺喷施甘薯可显著提高块根中可溶性糖、淀粉、蛋白质含量,明显改善甘薯食用品质。
目前,缩节胺在植物生理生长抗环境胁迫方面被广泛研究,但是在甜菜上相关研究还有所缺失。因此,本研究以TM35 为试验材料,研究不同施用浓度TM35 对甜菜形态和生理生化指标的影响,以期探索出最适合甜菜生长的施用浓度,用以指导甜菜的生产实践。
1 材料与方法
1.1 试验材料及培养条件
本试验选用抗性较强的甜菜品种‘KWS1176’为试验材料,于2021 年11 月22 日在黑龙江大学现代农业与生态环境学院甜菜耕作与栽培实验室进行土培试验。土壤为哈尔滨市黑龙江大学呼兰校区黑土,土壤养分情况:土壤无机氮含量39.85 mg/kg、有效磷含量47.71 mg/kg、速效钾含量196.31 mg/kg、土壤有机质含量2.48%、土壤pH 7.25。使用圆形花盆,上直径11.5 cm,下直径8.5 cm,高10 cm。播种时每盆下部土壤混施不同浓度TM35 共600 g,后均匀放置20 粒甜菜种子,再在种子上部覆土100 g,播种后,浇灌100 mL 1/2 Hoagland营养液。在播种后12 d再次浇灌100 mL 1/2 Hoagland营养液。试验共设有5个处理,TM35浓度分别为0%、1%、2%、3%和4%,9 个重复,光周期为14 h/10 h(光/暗),温度为25 ℃/20 ℃(昼/夜),相对湿度65%~70%。2021 年12 月14 日对甜菜幼苗进行光合参数和生物量的测定,将除去叶柄和叶脉的叶片剪碎立即放置于液氮中进行速冻,之后保存于-80℃的冰箱中待测。
1.2 测定项目及方法
2021 年12月14日试验结束后用相机对甜菜幼苗植株表型进行拍照;用直尺测定甜菜幼苗株高、叶长和叶宽;用面积仪扫描第一、第二和第三对真叶叶面积;用万分之一电子天平秤出叶片、植株、根的鲜重,然后放入烘箱105 ℃杀青30 min,75 ℃烘干至恒重即干重,叶片厚度=植株鲜重/叶面积,根冠比=地上部鲜重/地下部鲜重;参照王堽等[14]的方法测量叶片相对含水量。
利用便携式光合系统在收获日上午9:00 对第二对完全展开的幼苗叶片测量光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间二氧化碳浓度(Ci)等光合参数;采用乙醇提取比色法进行叶绿素含量的测定[15]。
参考侯占山[16]的方法采用蒽酮比色法测定可溶性糖含量和考马斯亮蓝G-250 法测定可溶性蛋白的含量;采用酸性茚三酮法测定脯氨酸含量[17]。采用钼锑抗比色法测量土壤有效磷含量[18];采用乙酸铵提取法测定土壤速效钾含量[19];采用pH计测定土壤pH。
1.3 数据分析
使用SPSS26.0进行统计分析,GraphPad Prism8.0.2软件绘制图表。
2 结果与分析
2.1 土壤施用TM35对土壤pH、土壤养分的影响
土壤pH 随TM35 施用浓度的升高而升高,在浓度为4%达到最高值,与施用浓度0%相比,4%处理中土壤pH在第1 d和第22 d分别提高了25.38%、10.91%。土壤钾含量随施用浓度的升高而降低,变化趋势稳定,与施用浓度0%相比,4%处理中土壤速效钾含量降低了16.94%。土壤磷含量随施用浓度的升高而升高,变化趋势稳定,与施用浓度0%相比,4%处理中土壤有效磷含量提高了30.43%(见表1)。

表1 土壤施用TM35 对土壤pH 和土壤养分的影响Table 1 Effects of soil mixed with TM35 on soil pH and soil nutrients
2.2 土壤施用TM35对甜菜幼苗生物量的影响
土壤混施不同浓度的TM35 以后播甜菜种子培养22 d,随着施用浓度从0%到4%的增加,甜菜幼苗地上部和地下部的生长状况均有显著变化。图1 为土壤施用TM35对甜菜幼苗长势的影响,土壤施用TM35 对甜菜幼苗生长有促进作用,随着施用浓度的升高甜菜幼苗的生长势逐渐变强,植株矮壮,株形紧凑,叶色深厚。在施用浓度为0%时生长势弱,在施用浓度为4%时生长势强。表明施用浓度4%最适宜甜菜生长。

图1 甜菜幼苗表型图Fig.1 Phenotype of sugar beet seedlings
图2为土壤混施不同浓度的TM35 对甜菜幼苗地上部生物量的影响,甜菜幼苗的叶片长度(图2A)和株高(图2J)均随施用浓度的升高而降低,在施用浓度为4%时达到最低值,与施用浓度0%相比,4%处理中甜菜株高和叶片长度分别下降了25.74%、25.37%。植株鲜重(图2I)、叶片宽度(图2B)、叶片鲜重(图2D)、叶片干重(图2E)、叶面积(图2H)和叶片相对含水量(图2G)均随施用浓度的升高呈先上升后下降的趋势,但变化趋势有不同,在施用浓度为2%达到最高值,与施用浓度0%相比,2%处理中甜菜地上部鲜重、叶片鲜重和叶片相对含水量分别提高了25.00%、35.68%、11.25%。叶片数(图2F)、叶片厚度(图2C)、根鲜重(图3A)、根干重(图3B)和根冠比(图3C)随施用浓度的升高而逐渐升高,在施用浓度为4%时达到最高值,与施用浓度0%相比,4%处理中甜菜根鲜重和根干重分别上升了202.46%、123.62%。研究数据表明,本试验5 个处理中,甜菜幼苗在施用浓度为2%时地上部植株生长最好;在施用浓度为4%时地下部根系生长最好。
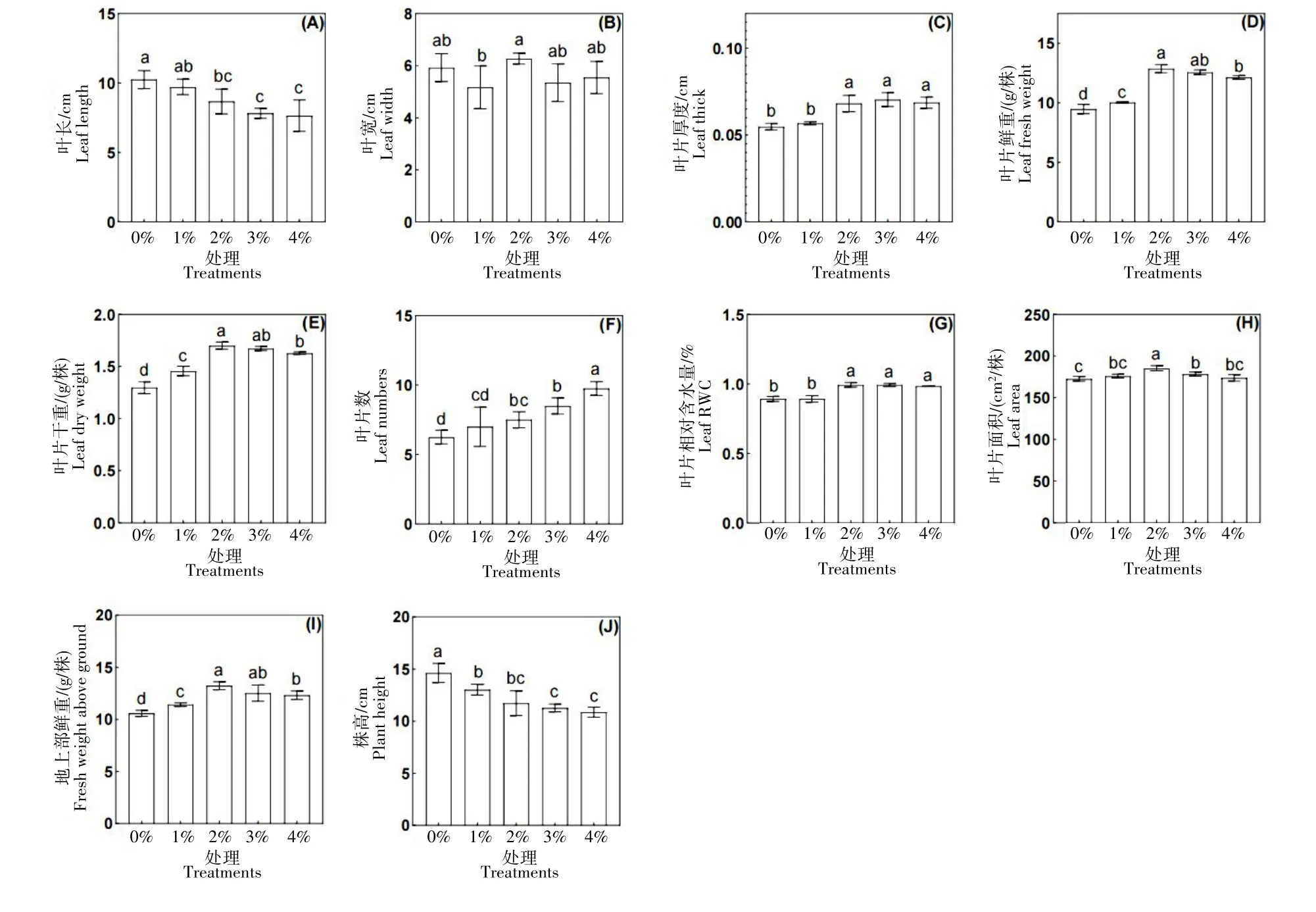
图2 土壤施用TM35对甜菜幼苗地上部的影响Fig.2 Effect of soil mixed with TM35 on the aboveground of sugar beet seedlings

图3 土壤施用TM35对甜菜幼苗地下部的影响Fig.3 Effects of soil mixed with TM35 on the underground of sugar beet seedlings
2.3 土壤施用TM35对甜菜幼苗光合作用和叶绿素含量的影响
为了分析土壤混施不同浓度的TM35 对植物光合作用的影响,统计了反映光合指标的相关参数(见图4)。净光合速率(Pn)(图4A)、蒸腾速率(Tr)(图4B)和气孔导度(Gs)(图4C)随施用浓度的升高而逐渐升高,在施用浓度为4%时达到最高值,与施用浓度0%相比,4%处理中甜菜Pn、Tr、Gs 分别上升了573.56%、417.65%、522.81%。Ci(图4D)随浓度的升高呈降低趋势,但变化趋势有不同,在施用浓度为1%时降到最低值,然后升高又逐渐降低。Chla(图4E)、Chlb(图4F)和Chl(图4H)随施用浓度的升高而逐渐升高,在施用浓度为4%时达到最高值,与施用浓度0%相比,4%处理中甜菜Chla、Chlb 和Chl 含量分别上升了21.54%、19.19%、19.96%。Chla/Chlb(图4G)各处理变化不明显。数据表明,施用浓度越高对甜菜幼苗的光合参数、叶绿素含量越有积极影响,施用浓度高会促进幼苗的光合参数、叶绿素含量增长。

图4 土壤施用TM35对甜菜幼苗光合作用和叶绿素含量的影响Fig.4 Effects of soil mixed with TM35 on photosynthesis and chlorophyll content of sugar beet seedlings
2.4 土壤施用TM35对甜菜幼苗渗透调节物质的影响
可溶性糖(图5A)、脯氨酸(图5B)和可溶性蛋白(图5C)含量均随施用浓度的升高而呈降低趋势,但变化趋势有所不同。可溶性糖在施用浓度为3%时达到最低值,然后缓慢上升,与施用浓度0%相比降低了25.18%;可溶性蛋白含量随施用浓度的升高呈下降趋势,但下降趋势不稳定,在浓度为2%时呈上升的趋势,与施用浓度为0%相比,施用浓度为4%时下降了29.01%;脯氨酸含量随浓度升高逐渐降低,在施用浓度4%时达到最低值,与施用浓度0%相比降低了46.82%。
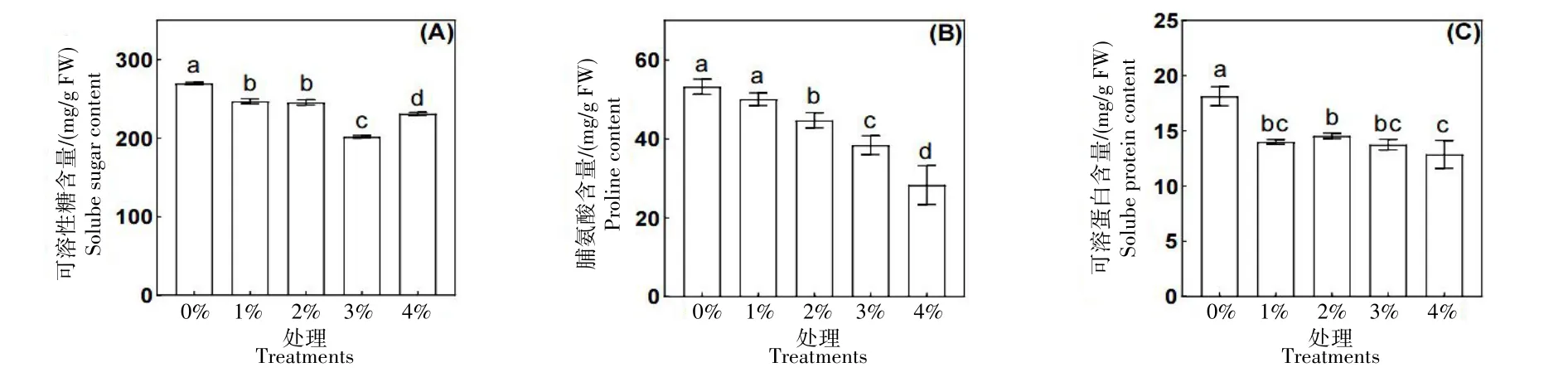
图5 土壤施用TM35对甜菜幼苗渗透调节物质的影响Fig.5 Effects of soil mixed with TM35 on osmotic regulation of sugar beet seedlings
3 讨论与结论
本试验发现,施用浓度4%TM35 可使土壤pH 值高达9.09,比施用石灰之前增长了25.43%,此结果与饶孝沛等[20]土壤施用石灰可提高马铃薯pH和产量研究结果一致。土壤pH 值是制约作物生长和生产的主要因素,但较高pH 值可以促进甜菜植株和根系生长[21]。但在高水平的碱性胁迫下,甜菜出苗率会降低[22].本试验为了保证种子出苗率,覆土时土壤没有施用TM35,很好地解决了出苗率降低这一问题。
缩节胺可降低植株体内赤霉素的活性,从而抑制细胞伸长使植株节间缩短,叶色深厚。通过比较甜菜在施用浓度为0%~4%的TM35生长状况,在施用浓度为2%时,植株生长最好;施用浓度为4%时,根系生长最好。本试验发现高浓度显著降低了株高和叶长,李林等[23-25]认为施用缩节胺可抑制棉花细胞伸长,缩短节间,降低株高,提高棉花叶片二氧化碳交换率,施用缩节胺的棉花茎秆降低了50%。与本研究结果相似。此外,根系通过提供地上机械支持和控制水分与养分的获取,对植物生长起着至关重要的作用[26],本研究中施用TM35 显著提高了甜菜根鲜重、根干重和根面积,促进了甜菜光合作用的增加。此结果与大豆中改良的根系可以促进大豆光合作用的研究结果一致[27]。
净光合速率和叶绿素含量是植物重要生理指标,光合作用是决定产量的基本因素。本试验结果表明,随着TM35 施用浓度从0%~4%的增加,光合速率和叶绿素含量逐渐上升,施用TM35 可提高植物光合作用能力和叶绿素含量与此前玉米中研究结果一致[28]。生理数据还表明,施用浓度为4%时,渗透调节物质含量降低,这与此前在棉花研究的结果相反[5,29],具体原因还需要深入研究。
本研究土壤混施TM35可提高土壤pH值和土壤有效磷含量,促进甜菜根部生长;可提高甜菜叶片的Pn、Tr、Gs和叶绿素含量,降低Ci,从而提高甜菜光合作用,其中在施用浓度为4%时效果最佳;在施用浓度为4%时甜菜幼苗渗透调节物质达到最低值。综上所述,高浓度的TM35(4%)可促进甜菜幼苗地上部和根系生物量增加,对甜菜幼苗生长有促进作用。

