新疆南疆骏枣缩果病病原鉴定
刘振亚,张 萍,訾丽丽,朱天生*
(1.塔里木大学 农学院,新疆 阿拉尔 843300; 2.塔里木大学 园艺与林学学院,新疆 阿拉尔 843300)
新疆光热资源丰富,适合于枣树的生长,同时枣树对气候、土壤的适应能力很强,耐土壤干旱、盐碱和贫瘠,因此,近年来枣树的种植面积增长很快,截止2019年底,红枣的种植面积达到4.670×105hm2,产量达到3.728×106t[1],但自2010年以来,骏枣缩果病的发生越来越严重,给农户造成了严重的经济损失。枣缩果病菌可在花期侵入和幼果期从果洼处侵入[2],发病枣果从外向内逐渐出现褐色坏死现象,病组织呈海绵状,在成熟之前脱落[3],造成减产。目前,对造成南疆地区缩果病的病原还存在争议,报道的病原有细交链孢菌(Alternaria alternata)、实腐茎点霉[Phoma desturctiva Plowr] Fusicoccum sp.、Coniothyrium sp.、细极链格孢菌(Alternaria tenuissima)、青霉菌(Penicillium expansum)、芽枝孢菌(Cladosporium tenuissimum)、聚生小穴壳菌(Dothiorella gregaria Sacc)[4-12]。由于不同学者对枣缩果病的病原看法不一,这导致了枣缩果病的防治困难。因此,本研究对引起新疆南疆骏枣缩果病的链格孢属真菌进行形态特征和培养性状等形态学研究,并结合18 S rDNA-ITS、EF-1α、β-tubulin、ATPase基 因 进 行测序和序列分析,对其病原菌进行鉴定,以期明确新疆南疆骏枣缩果病的病原种类,为缩果病的防治奠定一定基础。
1 材料与方法
1.1 材料
从和田、喀什、阿克苏采集具有典型症状的缩果病的病样,带回实验室进行分离培养。
1.2 方法
1.2.1 病原菌的分离与培养 病原菌的分离与纯化采用常规组织分离法[13]。将分离物置于25 ℃恒温培养箱中培养,在菌落边缘挑取形态比较单一的菌丝块转接到新的PDA上培养,进行2~3次纯化后,最后的单孢纯化保存备用。
1.2.2 致病性测定 将单孢分离所得到的纯菌株接种在PDA培养基中,25 ℃培养5 d后,用无菌水制成孢子悬浮液,置于10×40倍显微镜下镜检,每个视野的悬浮液中孢子量为20~40个分生孢子,将采集的健康无伤的枣果实用75%酒精进行表面消毒,再用无菌水将枣果实清洗干净,用无菌牙签刺孔,在超净工作台中将孢子悬浮液喷雾接种到有伤的枣果实上,无菌水作为对照,然后放入事先铺有湿润滤纸的搪瓷盆中,每个代表菌株接种3个果实,28 ℃条件下,12 h光照与12 h黑暗交替培养,每日观察病斑生长情况,5 d后测量病斑直径,并对发病果实进行再分离[4]。
1.2.3 病原菌的鉴定
1.2.3.1 形态学鉴定 将病原菌接种到PCA培养基上,置于25 ℃培养箱中按12 h光照和12 h黑暗交替培养,培养5 d后,制成玻片在显微镜下观察分生孢子的形态[14]。
产孢表型观察的具体方法:将比载玻片略小的滤纸中心裁剪出1 cm×3 cm的长方形小孔,用透明胶带将其紧贴在载玻片上并放在有2层滤纸的培养皿中一起灭菌,灭菌后,挑取在PCA培养基中培养的菌落边缘并涂抹在载玻片上的滤纸一侧,然后放在有近紫外灯和日光灯的培养箱中,25 ℃、12 h光照与12 h黑暗交替培养5 d后,在徕卡荧光数码显微镜下观察代表该菌株总体特征的产孢表型[15]。根据分生孢子、分生孢子梗和产孢表型等特征,参考张天宇[16]的研究,初步确定其属种。
1.2.3.2 分子生物学鉴定 将菌种接种到PDA培养基上,28 ℃培养5 d,用打孔器打取菌饼转接到含有100 mL PDA的锥形瓶中,放在28 ℃转速为180 r/min的摇床中,培养2~3 d后,用无菌水冲洗,再用4层灭菌的纱布进行过滤[17],40 ℃烘干后放入灭菌EP管中备用。采用CTAB的方法提取基因组DNA[18]。
病原菌rDNA-ITS的扩增采用通用的引物ITS1和ITS4,EF-1α基因的扩增采用引物EF1-728F和EF1-986R,β-tubulin基因的扩增采用Beta-F和Beta-R,ATPase基因的扩增采用引物ATPDF1和ATPDR1[19-20]。

表1 PCR所需引物及其序列
通 用 引 物ITS1与ITS4、EF-1α、β-tubulin,以及ATPase基因扩增体系和扩增条件分别参考唐淬[21]和臧睿[22]的实验方法。将引物扩增的PCR产物送到生工生物工程(上海)股份有限公司进行测序。获得序列后,登陆GenBank数据库,下载链格孢属真菌序列,应用MEGA 6.06软件中的邻接法(neighbor-joining,NJ)构建聚类分析树状图[23]。
2 结果与分析
2.1 病原菌分离结果
采用常规组织分离法,共分离纯化获得15个分离物,根据分离物、菌落形态、产孢结构和分生孢子基本形态的相似性进行合并,并分类编号,初步确定为4种真菌分离物,编号分别为NJZZ-1、NJZZ-2、NJAA-3、NJZZ-4。
2.2 致病性测定结果
将NJZZ-1、NJZZ-2、NJAA-3、NJZZ-4接种到枣果实上,其中NJZZ-2刺伤接种后的枣果,6 d后可观察到接种部位出现红褐色的椭圆形病斑,在6~10 d病斑逐渐扩大,并且接种部位呈黑褐色,后期凹陷和软烂。而NJZZ-1、NJAA-3和NJZZ-4刺伤接种后,没有出现缩果病的症状,说明NJZZ-1、NJAA-3和NJZZ-4不是枣缩果病的病原。将NJZZ-2接种到健康的枣果实上,将发病的枣果再分离接种到其纯培养基上,性状与NJZZ-2相同,根据柯赫氏法则,确定NJZZ-2为菌株的病原菌。对照处理不发病。
2.3 病原菌的鉴定结果
2.3.1 形态学鉴定结果 将NJZZ-2接种在PCA平板上,在25 ℃近紫外灯和日光灯下12 h光照与12 h黑暗交替培养,培养5 d后,菌落直径5.5 cm,菌落为致密绒毛状,生长初期为白色,菌落边缘较整齐,菌落背面青绿色,中心深褐色;在PCA+滤纸上,培养5 d后,形成较短且多分枝的分生孢子梗,分生孢子梗上长3~7个分生孢子,分生孢子呈倒梨形或棒形,淡褐色,表面光滑,具有横纵隔膜1~6个,分隔处不缢缩,孢身(15.6~40.43) μm×(6.8~13.27) μm,喙 有长、有短,呈淡褐色,大小为(0~20.5) μm×(2.35~4.53) μm(图2);根据菌株的培养特性和形态特征,参照张天宇《中国真菌志·链格孢属》[16]一文研究的标准,将其初步鉴定为链格孢属的链格孢菌[Alternaria alternata (Fr.) Keissler]。
2.3.2 分子生物学鉴定结果 登陆NCBI网站将获得的序列进行BLAST比对分析,下载相似序列,用MEGA 6.06软件中的Neighbour-joining方法构建聚类分析树状图。通过BLAST比对发现,样品菌株ITS序列与GenBank数据库中链格孢属ITS序列的相似度均达到100%,选择一些序列进行下载,构建发育树(图3)显示,NJZZ-2与下载的序列聚在一个大的分枝下,因此,仅通过ITS基因序列无法鉴定出样品菌株的具体种类。

图3 基于ITS序列构建的系统发育树
将样品序列在GenBank数据库中进行BLAST比对发现,样品菌株EF-1α序列与链格孢属的几株真菌序列相似度在99%以上,通过下载这些序列与样品菌株序列共同构建EF-1α系统发育树(图4)显示,NJZZ-2与不同登录号的A. alternata、A. tenuissima、A. longipes聚为一分枝,这说明不同登录号链格孢属菌株与NJZZ-2之间的同源性高,利用DANMAN软件将NJZZ-2与链格孢属17种真菌的核苷酸的一致性进行比对发现,NJZZ-2与A. alternata(MN473125、KY094928、KU145274、MK248718、MW848791)的一致性最高,与不同登录号A. tenuissima的一致性大部分达到82%以上(表2),说明采用EF-1α基因序列进行比对分析,无法有效区分A. alternata和A. tenuissima这2个种。
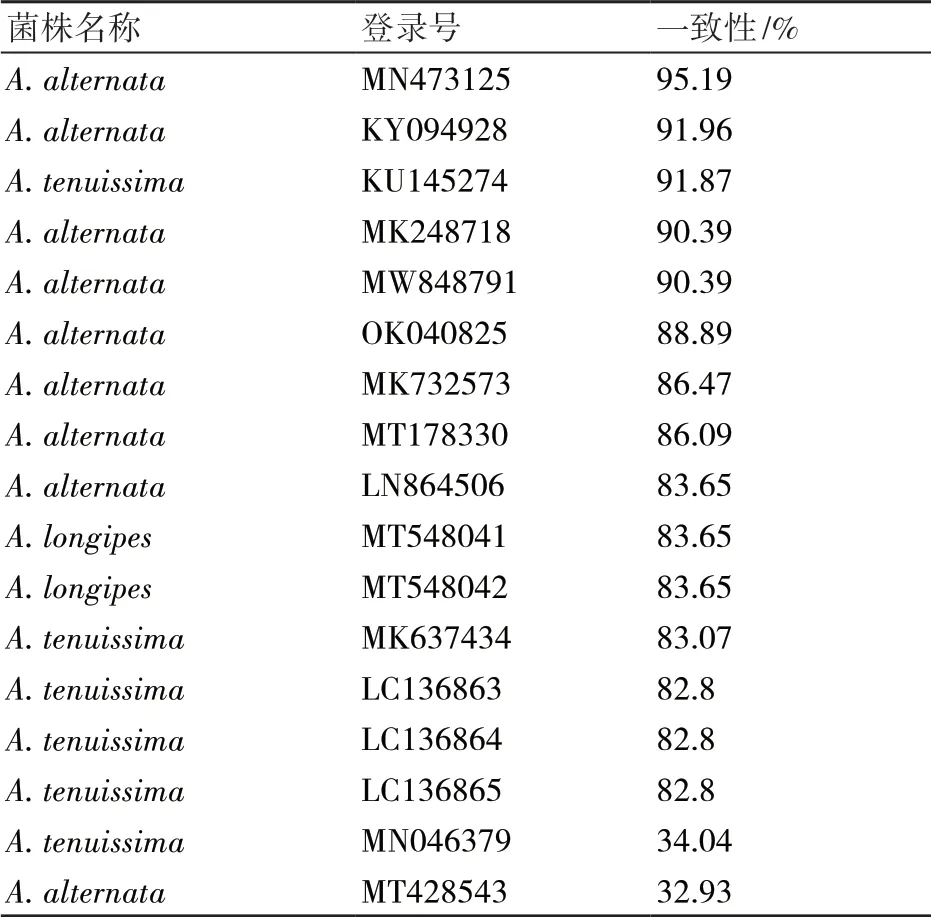
表2 NJZZ-2样品菌株与链格孢属17种EF-1α真菌序列一致性比较

图4 基于EF-1α序列构建的系统发育树
下载与样品β-tubulin序列相似度在96%以上的链格孢属真菌序列,构建β-tubulin系统发育树(图5)显示,NJZZ-2与A. alternata、A. tenuissima、A. arborescens的同源性最高,聚为一个分支,利用DANMAN软件将NJZZ-2与链格孢属15种真菌的核苷酸的一致性进行比对发现,NJZZ-2与A.alternata (MG558003、MG925327)的一致性最高,达到95%以上(表3),因此,将NJZZ-2鉴定为A.alternata。
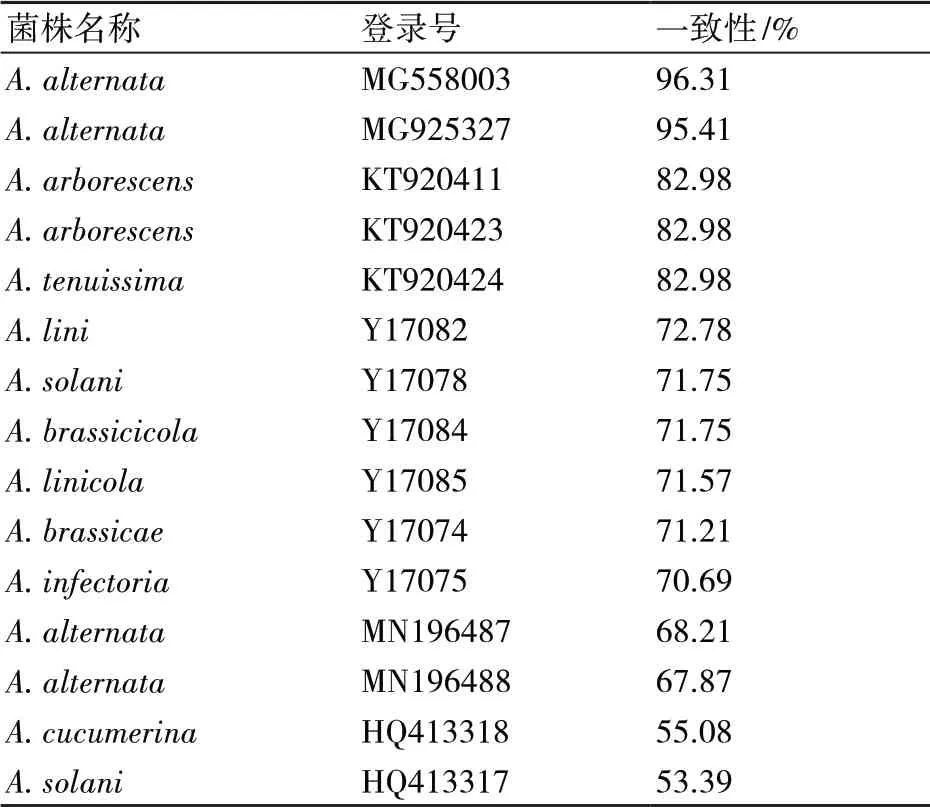
表3 NJZZ-2样品菌株与链格孢属15种β-tubulin真菌序列一致性比较
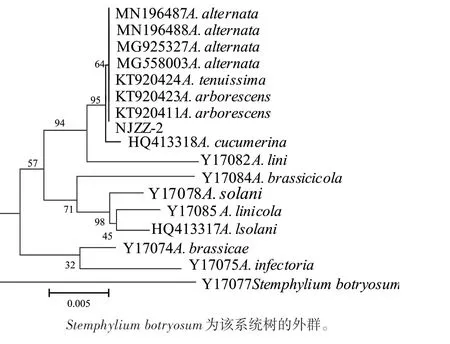
图5 基于β-tubulin序列构建的系统发育树
下载与样品ATPase序列相似度在98%以上的链格孢属真菌序列,通过构建ATPase序列的系统发育树(图6)显示,NJZZ-2与A. alternata (MH492 683、MF741789、MH492682、MN175530)和A. interrupta(MH092840)聚为一个分支。利用DANMAN软件将NJZZ-2与链格孢属12种真菌的核苷酸的一致性进行比对(表4)发现,NJZZ-2与A. alternata和A.tenuissima的一致性无差异,说明ATPase序列无法有效区分链格孢属的不同种。
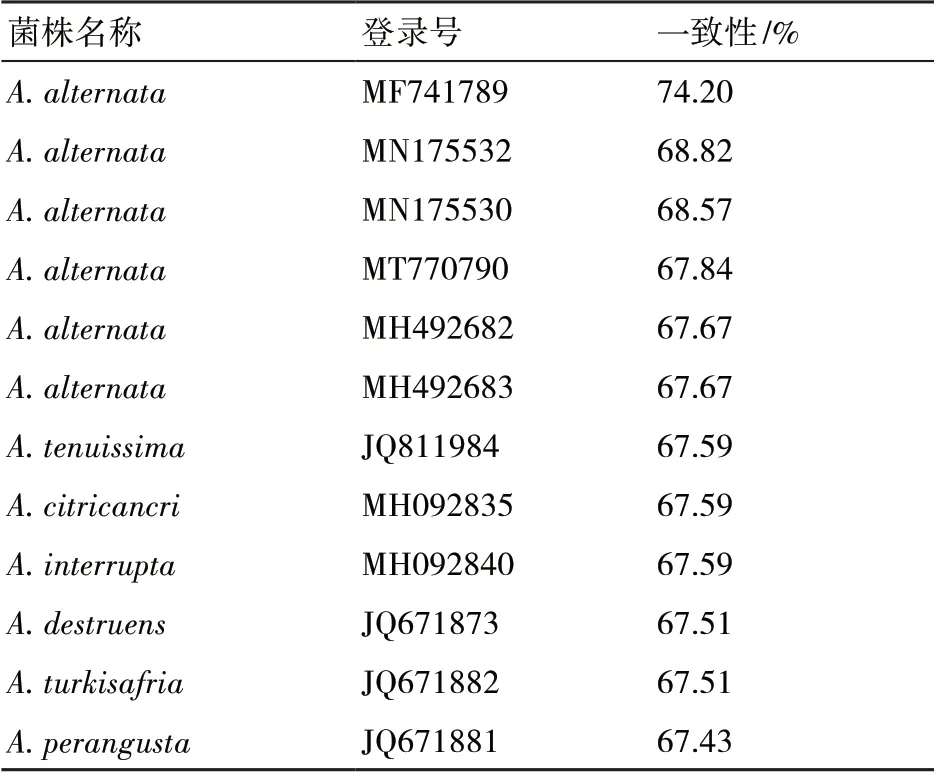
表4 NJZZ-2样品菌株与链格孢属12种ATPase真菌序列一致性比较

图6 基于ATPase序列构建的系统发育树
3 结论与讨论
链格孢属病原菌的寄主范围很广泛,可引起多种植物和作物病害[24]。马连杰[25-26]等研究结果表明,A. alternata是引起重庆地区蚕豆叶部病害和北京、山西葡萄叶斑病的病原之一;宜昌的核桃黑斑病[27]、 河北省张北县及内蒙古乌兰察布市莴笋叶斑病[28]、贵州省贵阳市树莓叶斑病[29]、青海省青贮玉米叶枯病[30]、湖南牡丹黑斑病[31]等都是链格孢属真菌引起的。而对链格孢属的病原,特别是小孢子种的鉴定又很困难,原因在于链格孢属的小孢子种的形态特征不一致,同一种分生孢子具有不同的形态特征,其变化幅度较大,不同的小孢子种在相同的人工培养条件下,分生孢子具有趋同现象,这给从传统形态学鉴定小孢子种带来了很大困难[14],因此,需要结合分子生物学手段确定其分类。研究发现,仅通过ITS序列无法区分链格孢属的不同种,这与段丽君等[32]的研究结论一致。准确鉴定链格孢属的不同种,还需要结合其他基因序列,如王志霞等[19]通过培养性状、形态特征和18 S rDNA-ITS、EF-1α、β-tubulin基因序列进行比对分析,将新疆矮化密植枣园红枣叶斑病的病原菌鉴定为A. alternata。许阳[33]利用链格孢菌的特异性引物对河北和河南地区的枣缩果病鉴定为A.alternata。祖艳青[34]利用ITS、Gpd、RPB2、OPA2-1、ACT基因区段将新的未知种与其他种区分开。但本研究结果显示,采用ITS、EF-1α序列和ATPase基因序列无法将枣缩果病鉴定到具体种类,由此可以看出,鉴定链格孢属小孢子种的困难程度。
本研究采用β-tubulin基因序列及DANMAN软件分析了病原核苷酸的一致性,并结合形态学鉴定,将新疆南疆骏枣缩果病的病原鉴定为A.alternata (Fr.) Keissler。

