磁共振扩散峰度成像技术在帕金森病早期诊断中的价值
戴凯峰,陈向荣,许淑惠,林钱森,蔡雅丽,陈杰云
帕金森病(Parkinson's disease, PD)是中老年人常见的中枢神经系统退行性疾病,其发病隐匿,病程缓慢,60岁以上人群发病率可达1%[1],随着社会老年化的加剧,其发病呈现上升趋势[2],严重影响老年人的生活质量。研究[3]发现其病理改变为黑质多巴胺能神经元的进行性变性、丢失导致的运动功能损伤,因此本研究希望通过磁共振扩散峰度成像(diffusion kurtosis imaging, DKI)技术在PD 中的应用,找出对PD 诊断具有特异性和敏感性均较佳的影像学诊断方法,给临床提供客观有效的影像学指标,达到早期诊断、早期治疗PD 的目的,减少患者的失能时间,降低伤残率,提高患者预期寿命。
目前,PD诊断的金标准是黑质神经病理学改变,临床尚未有公认的神经病理学诊断标准,其主要依赖临床病史、特征性的运动障碍症状体征及试验性治疗,缺乏客观有效的影像学指标[2]。因此,利用DKI技术在测量PD患者脑部核团的微结构时提供的扩散张量度量[平均扩散率(mean diffusivity, MD)、各向异性分数(fractional anisotropy, FA)等]、峰度度量[轴向扩散峰度(axial kurtosis, Ka)、径向扩散峰度(radial kurtosis, Kr)和平均扩散峰度(mean kurtosis, MK)]等参数,能准确、定量地检测脑部神经核和神经纤维束的机构完整性[4]和检测各向异性[5],从而检测脑部组织的微结构变化。这些参数可以辅助诊断PD,并作为病情评估的一个重要手段。随着MRI 技术的创新及发展,DKI技术为PD诊断提供的分子生物学数据,以及从微观角度发现神经元、胶质细胞等[6]细微解剖结构的改变及其病理变化,极大提高了PD诊断的准确率。
当前国内外对采用DKI 技术在PD 中的应用研究较少,且文献报道多以DKI技术对PD的诊断效能为主,未全面分析DKI技术在PD 患者脑部核团中的诊断特征,为了弥补此方面研究,获得PD 脑部核团改变情况的系统全面的影像学资料,本研究采用简单随机抽样的方法,利用常规MRI结合DKI技术分析PD 患者脑部核团的微结构变化,为临床提供早期发现、早期诊断PD 的客观有效的影像学指标,使患者及时得到早期治疗,延缓病情发展。
1 材料与方法
1.1 一般资料
本研究为前瞻性研究,采取简单随机抽样法随机纳入2018 年1 月至2021 年6 月于我院PD 专科确诊的PD 患者50 例作为PD组,同时纳入来我院进行健康体检的健康志愿者50例作为健康对照(healthy control, HC)组。PD 组的纳入标准:(1)所有患者依据国际运动障碍协会2015年公布的PD诊断标准,均为原发性PD;(2)既往无其他神经系统疾病者;(3)患者简易智力状态检查(Mini-mental State Examination, MMSE)量表评分≤27分;(4)患者均知情同意。HC组纳入标准:(1)与PD患者同期的健康体检人群;(2)无神经系统疾病者;(3)均知情同意。排除标准:(1)继发性帕金森综合征和帕金森叠加综合征者;(2)颅脑炎症、肿瘤、手术史、长期酗酒、毒品或药物依赖者;(3)精神疾病及依从性差者。本研究经泉州市第一医院伦理委员会批准,全体受试者均签署了知情同意书,批准文号:泉—伦【2018】216号。
1.2 扫描方法
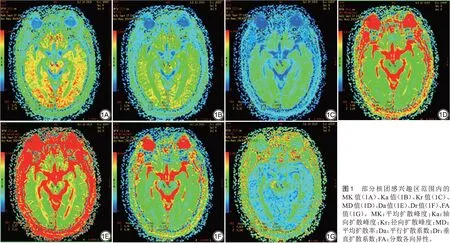
所有受试者采用美国GE公司生产的3.0 T磁共振扫描仪(HDXT)进行检查。所有受试者取仰卧位,用8通道头颅线圈固定头颅,并佩戴耳塞以降低噪声,同时用橡胶软塞固定头部以避免运动产生伪影,告知受试者保持放松状态。对受试者进行常规头颅MRI序列、DKI序列扫描,扫描野包括中脑和基底节区层面,扫描时间约20 min。扫描完成后,分别测量所有受试者双侧的红核、黑质、丘脑、壳核、苍白球、尾状核共6个部位的MK值、Ka值、Kr值、MD值、平行扩散系数(axial diffusivity, Da)值、垂直扩散系数(radial diffusivity, Dr)值、FA 值。所有核团参数情况见图1。
1.2.1 常规颅脑MRI序列
3D T1WI 序列扫描参数如下:TR 6.8 ms,TE 3.5 ms,层厚 1.2 mm,层间距0 mm,FOV 240 mm×240 mm,矩阵 256×256。磁敏感加权成像(susceptibility weighted imaging,SWI)序列扫描参数如下:TR 24.2 ms,TE 24.2 ms,层厚3.6 mm,层间距0 mm,FOV 240 mm×240 mm,矩阵384×320。
1.2.2 DKI序列参数
三维平面回波成像(3D echo planar imaging, 3D-EPI)序列扫描参数如下:TR 5000 ms,TE 87 ms,层厚3 mm,层间距0 mm,FOV 240 mm×240 mm,矩阵128×128,30个扩散梯度方向,3个b值(0、1000、2000 s/mm2),空间分辨率为2 mm×2 mm×2 mm。
1.3 图像处理
DKI 序列扫描完成后,原始数据传输至GE 3.0 T MR 后处理工作站,利用DKI 专用后处理软件,分别得出所有受试者双侧的红核、黑质、丘脑、壳核、苍白球、尾状核共6 个部位的MK图、Ka 图、Kr 图、MD 图、Da 图、Dr 图、FA 图,将扫描所得的DKI原始图像以DICOM 格式导出,将图像进行预处理和分类,利用DKE 软件进行后处理,手动画出感兴趣区(region of interest, ROI),分别测量ROI范围内的MK值、Ka值、Kr值、MD值、Da值、Dr值、FA值,取平均值。
1.4 观察指标
比较PD 组与HC 组脑部核团DKI 参数(MK 值、Ka 值、Kr 值、MD值、Da值、Dr值、FA值)及其与MMSE量表评分的相关性。
1.5 统计学方法
采用SPSS 25.0统计软件进行分析,计量资料以均数±标准差(xˉ±s)表示,两独立样本t检验法检验PD组、HC组组间的各核团DKI 参数值的差异性;计数资料用百分比表示,采用χ2检验;通过受试者工作特征(receiver operating characteristic,ROC)曲线分析各DKI参数对PD的诊断效能;采用Spearman相关分析分析DKI 参数变化与MMSE 量表评分的相关性。检验水准α=0.05,P<0.05表示差异有统计学意义。
2 结果
2.1 两组研究对象的基本情况
PD 组男25 例、女25 例,年龄50~70 岁;HC 组男25 例、女25例,HC组研究对象均是与PD组匹配的健康志愿者。两组患者的性别、年龄、病程等一般资料比较,差异无统计学意义(P>0.05)。
2.2 两组研究对象的各核团参数比较
两组观察对象DKI 参数中,除红核的Ka 值、丘脑的Kr 值、壳核的Kr 值、苍白球的Kr 值外,红核、黑质、丘脑、壳核、苍白球、尾状核的其他DKI 参数组间比较差异具有统计学意义(P<0.05)。两组患者各核团DKI参数比较见表1。
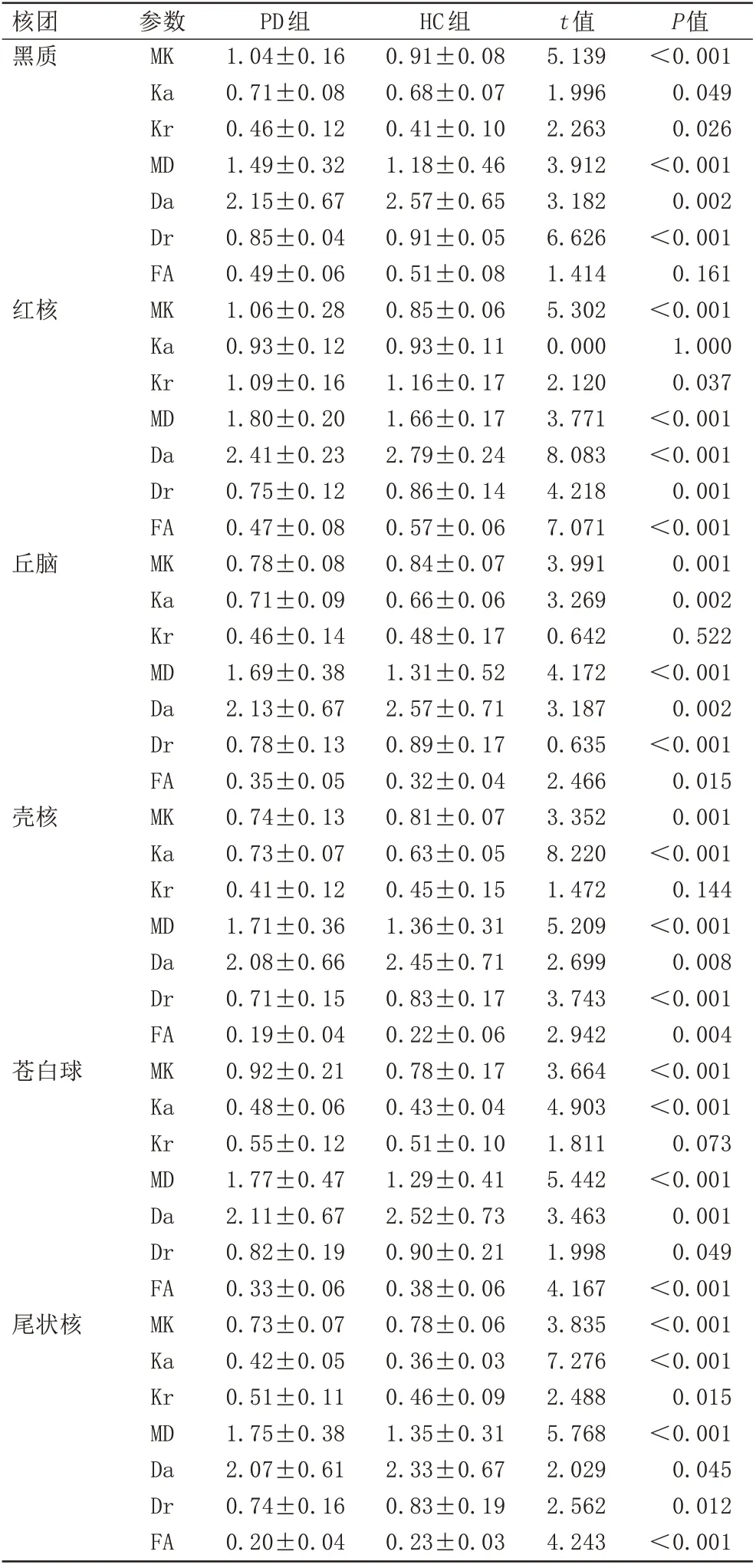
表1 两组患者各核团DKI参数比较
2.3 各DKI参数对PD的诊断效能
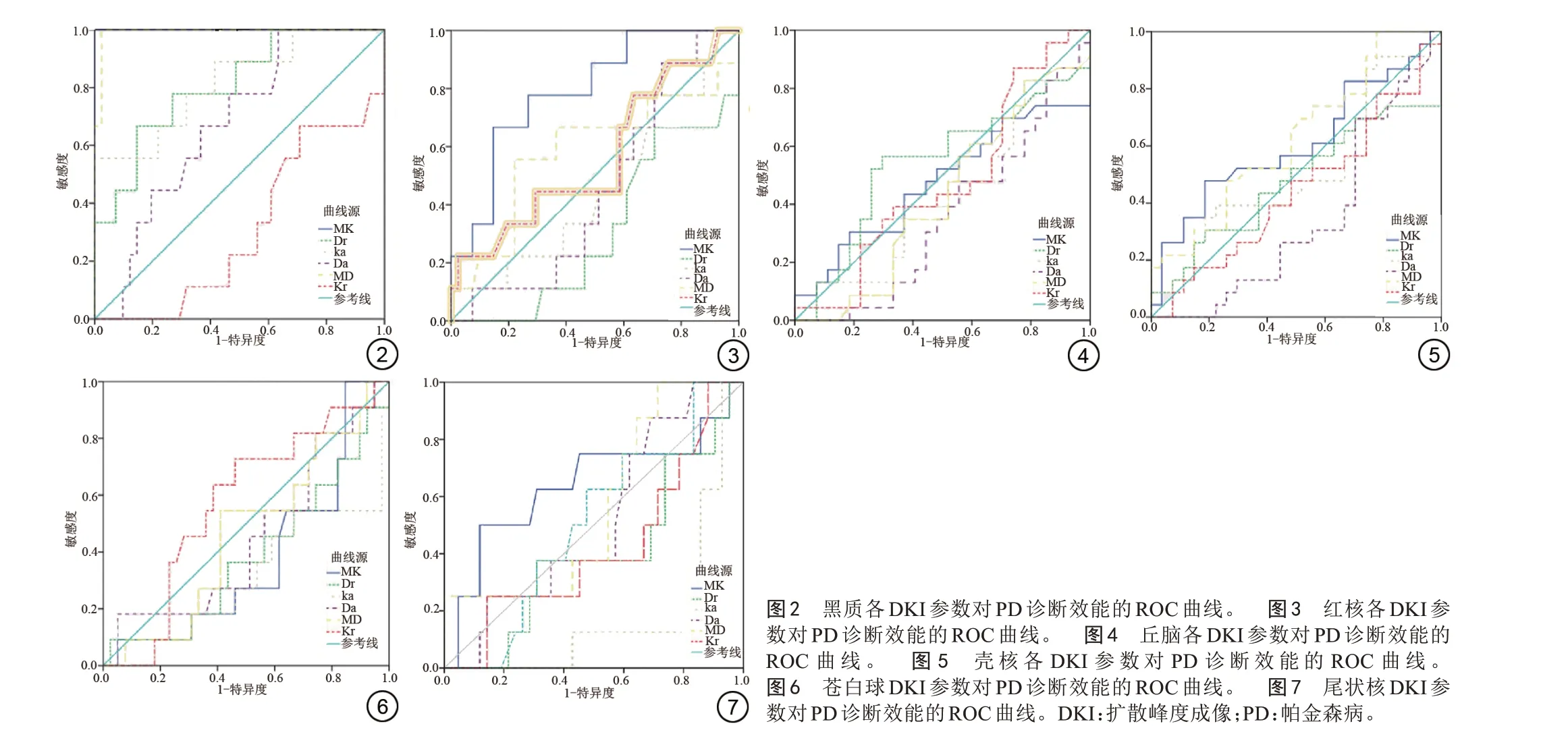
通过ROC 曲线下面积(area under the curve, AUC)分析得出:黑质MK 值鉴别诊断PD 组和HC 组的AUC 最大,其次为黑质MD 值、黑质Ka 值、黑质Dr 值、红核MK 值,其AUC 分别为1.000、0.992、0.818、0.808和0.791。各核团对应的DKI参数对PD的诊断效能见表2、图2~7。

表2 各DKI参数对PD的诊断效能
2.4 各核团DKI参数与MMSE量表评分的相关性
黑质MK 值(r=0.572,P=0.043)和MD 值(r=0.827,P=0.039)、红核MK值(r=0.738,P=0.042)和MD值(r=0.899,P=0.031)与MMSE量表评分具有正相关性,其他DKI参数值与MMSE量表评分之间无显著的相关性。各DKI参数与MMSE量表评分的相关性见表2。
3 讨论
本文利用3.0 T高场强常规MRI结合先进的DKI技术观察了PD患者脑部核团的变化情况,在国内首次对PD患者采用DKI技术分析脑部核团,全面地对PD组及HC组的脑灰质核团进行测量及分析,发现了PD患者灰质核团微结构的变化关系。
3.1 PD患者在脑部核团区微观结构的变化
本研究发现PD 患者黑质、红核、丘脑、壳核、苍白球和尾状核的DKI 参数与健康志愿者的差异,提示PD 患者在脑部核团区较健康志愿者存在微观结构的变化。研究[7]显示PD患者基底节各主要深部核团(壳核、苍白球、尾状核)以及黑质中MK值明显增高。MK 值大小与ROI 内组织结构的复杂程度成正比,结构越复杂,非正态分布水分子扩散受限越显著,MK 值越高[8],每个体素内的正常扩散跟水扩散的因素密切相关,因此当不同因素有变化时可引起其变化,即当机体病理性的蛋白质积累或铁沉积时,MK 降低可能是神经元丢失的迹象[9]。文献[10]显示PD患者会发生多巴胺能神经元的丢失以及髓鞘的完整性受损,苍白球及丘脑的FA值低于正常人。
本文也显示PD患者的黑质红核、丘脑、壳核、苍白球和尾状核的Da和Dr值、红核Kr值、红核和苍白球的FA值、丘脑和尾状核的MK值、壳核、苍白球和尾状核的FA值低于健康志愿者,其他核团DKI参数高于健康志愿者。这与研究[11-12]结果一致,主要是与PD患者的黑质纹状体、苍白球等核团组织的多巴胺能神经元较健康志愿者损耗程度高有关[13],尤其是黑质、红核、苍白球和尾状核的MK值、FA值高于健康人[14],这主要是因为脑组织结构越复杂,水分子扩散越偏离高斯分布,因此多巴胺能神经元丢失越多、胶质细胞增生越多而导致黑质发生显著的微结构改变[15-16]。同时可能因PD患者核团中铁含量增加,使信噪比降低而使MK值增加。另外MD值在PD患者脑部核团中升高,这与既往研究[17]一致,主要因PD患者大部分脑部核团可出现髓鞘脱失,或者完整性被破坏导致水分子扩散受限,降低脑部结构复杂性。
3.2 各DKI参数对PD的诊断效能
本文通过ROC 曲线分析发现黑质MK 值鉴别诊断PD 组和HC 组的AUC 最大,其次为黑质MD 值、黑质Da 值、黑质Dr 值、红核MK 值,因此可通过MR DKI 黑质参数情况作为诊断PD 的指标。本研究也发现黑质MK 值对PD 患者诊断的敏感度可达100%,说明黑质MK值诊断PD较为敏感。MK是测量水分子扩散运动受阻程度的指标,反映了组织结构的复杂性,不依赖于组织的空间方位,忽略了扩散运动的方向性[18-19],当MK 值增加时,提示早期炎症导致大量的胶质细胞和细胞因子激活程度大于多巴胺能神经元的丢失,使局部组织的复杂程度增加。这与研究[20]显示黑质MK 值升高程度与病情严重程度相关一致,临床研究[21]也显示额叶、顶叶、枕叶等纤维的MK 降低与PD患者皮质-皮质下多巴胺能神经元缺失导致组织结构复杂性降低相关;也有研究[22]显示PD 患者基底神经节各主要区域的MK 值均高于健康志愿者,这可能是基底神经节区神经元丢失后导致该区域继发性神经胶质增生使组织微结构变复杂程度增高所致,或与黑质中铁含量增加有关[23],因此可推荐临床采用黑质MK值增加的幅度进行PD的鉴别诊断。
PD 患者的初步筛查中,帕金森病综合评分量表(Unified Parkinson's Disease Rating Scale, UPDRS)评分较MMSE 量表评分对PD筛查的针对性、专业性更强[24],但其评估过程较为复杂,需要专业人员参与,但MMSE 量表评分能全面、准确、迅速地反映被试智力状态及认知功能缺损程度,也可反映脑部各核团的变化,且较为简单可自行评估,因此本文分析了PD患者脑部各核团DKI参数与MMSE量表评分的相关性。
3.3 PD患者脑部各核团与MMSE量表评分具有正相关性
本文结果发现PD 患者脑部各核团中仅黑质MK 值和MD值、红核MK 值和MD 值与MMSE 量表评分具有正相关性。这与研究[25]显示的PD患者的临床表现与不同核团变化的相关性类似,提示PD 患者的病情主要与其脑组织黑质和红核的微结构变化相关。但也有研究[26]显示PD患者脑部核团的DKI参数与MMSE量表评分无关,这可能由于PD患者神经功能和认知情况有偏身侧差异,但DKI参数变化呈现双侧变化[27]。
3.4 局限性
本研究只分析了PD 患者各核团DKI 参数与MMSE 量表评分的相关性,UPDRS评分较MMSE量表评分对PD筛查针对性、专业性更强,评估需要专业人员参与。PD 患者各核团DKI 参数与UPDRS 评分的相关性,以及PD 患者各核团DKI 参数MMSE 量表评分与UPDRS 评分差异的比较分析将是下一步研究的目标。
综上所述,DKI 技术可应用于PD 中的诊断,且黑质DKI 参数可作为PD的鉴别诊断及预测病情程度的优先指标。
作者利益冲突声明:全体作者均声明无利益冲突。

