基于RhoA/ROCK信号通路番茄红素对骨肉瘤MG63细胞荷瘤小鼠的抑瘤作用机制研究*
王新强,吴良邦,章月红,顾增辉
(中国人民解放军联勤保障部队第903医院骨三科,杭州 310004)
番茄红素(lycopene,LP)是一种属于类胡萝卜素家族的膳食抗氧化剂,可在红色和黄色水果或植物中合成[1]。主要存在于胡萝卜、西瓜、木瓜、芦笋和欧芹中[2]。LP(化学式为C40H56)是一种亲油性四萜,具有共轭双键结构[3]。LP具有多种功能,包括抗炎、抗氧化和抗增殖,可预防或治疗心力衰竭、肿瘤。LP可通过抑制氧化应激、神经元凋亡和炎症及恢复线粒体功能表现出治疗作用,这其中包括帕金森病、亨廷顿病、阿尔茨海默病、癫痫和抑郁症及恢复啮齿动物的记忆能力[4]。LP还可以有效预防和治疗心血管疾病和癌症。其中在降低肺癌和前列腺癌风险方面起到了明显的预防作用[5]。但LP在骨肉瘤中的作用及其潜在机制鲜有文献报道,本研究旨在通过体外试验观察LP对人骨肉瘤MG63细胞的作用,并通过荷瘤裸鼠模型探讨其对荷瘤裸鼠肿瘤生长的影响及潜在机制,为寻找骨肉瘤的治疗方法提供新思路,现报道如下。
1 材料与方法
1.1 材料
50只雄性裸鼠,体重(23.26±2.56)g,购自北京维通利华实验动物技术有限公司,许可证编号:SYXK(京)2017-0033。LP(纯度≥98%,南京泽朗生物科技有限公司);注射用顺铂(DDP,山东齐鲁制药有限公司);DMEM高糖培养基、胰蛋白酶、胎牛血清(FBS,美国HyClone公司);MTT、二甲基亚砜(DMSO,美国Sigma公司);膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡检测试剂盒(美国BD公司);PI-RNase A试剂(美国Trevigen公司);组织蛋白裂解液、蛋白酶抑制剂(美国Roche Molecular Biochemicals公司);聚偏二氟乙烯(PVDF)膜(美国Life Technologies公司);Immobilon Western Chemiluminescent HRP Substrate底物发光系统(美国Millipore公司);鼠抗兔小GTPase RhoA和Rho相关卷曲螺旋形成的蛋白激酶(ROCK)一抗、辣根过氧化物酶耦联的兔二抗(美国CST公司);Luminescent图像分析仪LAS-4000mini用于分析显影结果(美国GE Healthcare公司);酶标仪、流式细胞仪(美国Biorad公司);BI-2000医学图像分析系统(成都泰盟科技有限公司);DYY-11型多用电泳仪、DYCZ-40B转印泳槽(北京六一仪器厂)。
1.2 方法
1.2.1分组
MG63人骨肉瘤细胞购自美国ATCC细胞库,在混合10% FBS的DMEM高糖培养基中培养,选取对数生长期细胞用0.25%胰酶消化,调整细胞浓度为5×104个/mL后分为对照组、LP 5、10、20 μg/mL组和DDP(40 μg/mL)组[6]。各组细胞分别给予LP或DDP处理48 h进行后续试验。
1.2.2细胞增殖
调整细胞浓度至5×104个/mL,转移至96孔板,每孔滴加MTT溶液(5 mg/mL,20 μL)后继续培养4 h。去除细胞上清液后添入DMSO 200 μL,常温下振荡10 min后在570 nm处波长下用酶标仪测定吸光度(A)值。细胞增殖抑制率(%)计算公式为:抑制率(%)=[1—(实验组A值—空白组A值)/(对照组A值—空白组A值)]×100%。
1.2.3流式细胞术
收集每组处理后的细胞并用磷酸盐缓冲液(PBS)洗涤两次。对于细胞周期检测,在—20 ℃下用乙醇固定细胞,再将细胞置于PI-RNaseA试剂中室温下孵育25 min后,用PBS洗涤染色的细胞并通过流式细胞仪分析。对于细胞凋亡测定,收集处理过的细胞后,将它们用Annexin V-FITC/PI在25 ℃避光条件下染色25 min。用PBS洗涤2次后,被染色的细胞用于细胞凋亡分析。
1.2.4移植瘤模型建立
参照之前的方法[7]制备荷瘤鼠模型:收集对数生长期DMEM高糖培养的人骨肉瘤MG63细胞,制备浓度为5×106/mL的单细胞悬液,在无菌条件下于背部后部皮下接种(0.2 mL,1×106个细胞)。50只模型裸鼠分为5组:模型组,LP 10、20、40 mg·kg-1·d-1组和DDP(2 mg/kg)组,每组10只。造模成功后通过LP或DDP腹腔给药,持续14 d[8]。抑瘤率计算方法为:抑瘤率(%)=(模型组瘤质量—实验组瘤质量)/模型组瘤质量×100%。
1.2.5蛋白免疫印迹
用冷PBS洗涤骨肉瘤组织,用组织蛋白裂解液混合蛋白酶抑制剂的混合物裂解。在冰上孵育30 min后,4 ℃下以12 000×g离心15 min后收集上清液,并使用BCA法测定蛋白质浓度。含有等量总蛋白的(20 μg)的样品通过10%十二烷基硫酸钠-聚丙烯凝胶电泳(SDS-PAGE)分离并转移到PVDF膜上。膜在室温下用5%脱脂奶粉封闭2 h,然后与对应一抗混合孵育4 ℃过夜。随后,将膜与辣根过氧化物酶耦联的兔二抗一起孵育。使用高度灵敏的底物发光系统检测抗体结合蛋白条带,Luminescent图像分析仪LAS-4000mini用于分析显影结果。
1.3 统计学处理
2 结 果
2.1 LP对MG63细胞增殖抑制率的影响
与对照组比较,LP 5、10、20 μg/mL组和DDP组MG-63细胞增殖抑制率均明显升高(P<0.05),且LP 20 μg/mL组细胞增殖抑制率明显高于DDP组(P<0.05),见图1。
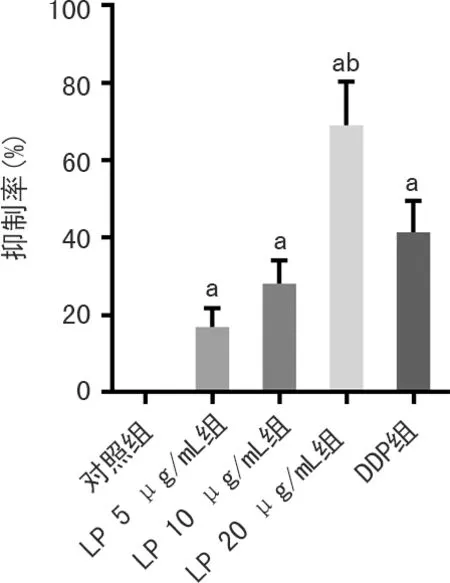
a:P<0.05,与对照组比较;b:P<0.05,与DDP组比较。
2.2 LP对MG63细胞周期的影响
与对照组比较,LP 5、10、20 μg/mL组和DDP组MG-63细胞周期G0/G1期明显延长(P<0.05),S期和G2/M期明显缩短(P<0.05)。与DDP组比较,LP 20 μg/mL组细胞在上述细胞周期的改变更为明显(P<0.05),见图2。

A.流式细胞术检测LP和DDP对MG63细胞周期的分布改变;B.各组细胞周期统计分析结果;a:P<0.05,与对照组比较;b:P<0.05,与DDP组比较。
2.3 LP对MG63细胞凋亡的影响
与对照组比较,LP 5、10、20 μg/mL组和DDP组MG-63细胞凋亡率均明显升高(P<0.05),且LP 20 μg/mL组MG-63细胞凋亡率明显高于DDP组(P<0.05),见图3。

A.流式细胞术检测LP和DDP对MG63细胞凋亡的改变;B.各组细胞凋亡统计分析结果;a:P<0.05,与对照组比较;b:P<0.05,与DDP组比较。
2.4 LP对各组裸鼠荷瘤质量和抑瘤率的影响
与模型组比较,LP 20、40 mg·kg-1·d-1组和DDP组瘤质量明显降低、抑瘤率明显升高(P<0.05);LP 40 mg·kg-1·d-1组瘤质量和抑瘤率与DDP组比较,差异无统计学意义(P>0.05),见表1、图4。

表1 各组裸鼠瘤质量和抑瘤率比较

图4 各组裸鼠瘤体比较
2.5 LP对各组裸鼠荷瘤组织中RchoA和ROCK蛋白表达的影响
与模型组比较,LP 10、20和40 mg·kg-1·d-1组和DDP组RchoA和ROCK蛋白表达水平明显降低(P<0.05);LP 40 mg·kg-1·d-1组与DDP组比较,差异无统计学意义(P>0.05),见图5。

a:P<0.05,与模型组比较。
3 讨 论
有研究表明,在人结肠癌细胞系HT-29细胞的体外研究中,LP可以通过抑制糖原合酶激酶-3β的磷酸化来抑制癌细胞的侵袭和基质金属蛋白酶-7、Akt和细胞外信号调节蛋白激酶1和2的表达。在前列腺癌PC3细胞系中,LP可通过降低AKT2的表达、增加microRNA Lethal-7的表达来阻止细胞增殖和诱导细胞凋亡[9]。本研究中,LP能够阻滞MG-63细胞周期于G0/G1期,抑制细胞增殖和促进凋亡;体内研究发现,LP能够抑制荷瘤裸鼠的肿瘤生长、提高抑瘤率。这说明LP对骨肉瘤细胞的细胞增殖和肿瘤生长均具有一定的抑制作用。
RhoA是Rho家族的小GTPase蛋白成员,已被证明是癌症进展中的关键信号通路[10]。WANG等[11]研究表明RhoA/ROCK信号通路的激活可以促进卵巢癌细胞的迁移和侵袭。此外,RhoA/ROCK信号通路可以参与血管形成并限制非小细胞肺癌的侵袭[12-13]。LIN等[14]研究表明CXCR4可以促进RhoA GTPase的激活和ROCK1的磷酸化。本研究中,LP剂量组RchoA和ROCK蛋白表达明显下调,其对RhoA/ROCK信号通路的作用与顺铂组相似,这可能是LP促进荷瘤组织细胞凋亡而抑制肿瘤生长的重要分子机制之一。
综上所述,LP可抑制体外人骨肉瘤MG-63细胞增殖、细胞周期,促进细胞凋亡,还可抑制骨肉瘤裸鼠肿瘤生长,其机制可能与LP抑制RhoA/ROCK信号通路有关。

