花椒树腐朽病病原菌鉴定及其生防菌剂筛选
梁巧兰,魏列新,徐秉良,吴 琼
(甘肃农业大学 植物保护学院,甘肃省农作物病虫害生物防治工程实验室,兰州 730070)
花椒Zanthoxylum bungeanumMaxim 是芸香科Rutaceae花椒属ZanthoxylumL.多年生香料和油料树种,叶片和果实都有挥发性油和脂肪,可作食物香料和香精原料,具有一定的医疗作用[1-2],并可用于粮食贮存期间病害防治及制作香皂、肥皂和工业油漆等的原料[3-5];花椒树根系发达,能够固土和耐干旱,是优势生态林经济树种之一[6]。因其良好的经济、社会和生态效益,花椒已成为甘肃经济支柱产业[7]。近年来,随着花椒产业和种植面积的不断发展,花椒病害发生严重,已成为限制花椒生产的主要因素。2018年5月,在甘肃省永靖县三塬镇调查发现,花椒主要病害有干腐病、流胶病和腐朽病等,其中腐朽病发生最重[8]。已有报道表明,花椒树腐朽病是由裂褶菌(Schizophyllum commune)引起的[9-10],该菌可引起花椒树树皮腐烂,而对于树杆上无子实体的溃疡斑是否由裂褶菌侵染所致及其生物学特性和生物防治等尚未见系统研究。为此,对引起甘肃省花椒树腐朽病病原物进行分离纯化鉴定及生物学特性研究;同时针对病原菌进行生物农药室内筛选,旨在探明引起花椒树腐朽病病原菌种类及影响发病的因素;同时,为指导利用生物农药有效防治花椒病害提供依据。
1 材料与方法
1.1 花椒病害发生情况调查及病样采集
2018年5月7-12日,在甘肃省永靖县三塬镇花椒园内,采用5点取样调查法,依据表1分级标准[11],按照东、西、南、北4个方向分别对花椒树主杆及枝条上腐朽病病害发生情况进行调查,每个点调查10株,共调查50株,每个方向调查3个枝条,采用“十字”交叉法测量病斑长径和短径,按下列公式计算发病株率和病情指数。同时,采集病样带回实验室,备用。

表1 花椒树腐朽病病害分级标准Table 1 Grading standard of decay disease on Zanthoxylum bungeanum
发病率=病株数/调查总株数×100%
病情指数=∑(病级株数×代表数值)/(调查总株数×发病最高级代表数值)×100
1.2 病原菌分离纯化及鉴定
1.2.1 病原菌分离纯化 将采集具有子实体的腐朽病枝条和具有腐烂病斑、无子实体的花椒树枝条分别放置在不同容器中,用清水冲洗干净,再用流水冲洗2 h,冲掉表面腐生菌,然后用0.1%升汞溶液表面消毒30 s,无菌水清洗后,取子实体、腐烂病斑边缘树皮分别放在铺有3层无菌湿滤纸的培养皿里,置于25 ℃、L/D 为12 h/12 h(2 200 lx)光照培养箱中保湿培养,直至子实体、树皮上长出菌丝,挑取菌丝接种到PDA 培养基,待长出菌丝后,及时挑取菌丝块转接到新的PDA平板上纯化培养,连续纯化3次后,将子实体弹射在培养皿盖上的孢子用灭菌水洗下悬浮在离心管中,通过显微镜观察将孢子悬浮液浓度调整为1×105个/m L),将孢子悬浮液稀释100 倍后倒入2%琼脂培养基表面(厚度0.5mm),转动培养皿当孢子悬浮液布满整个表面后,将多余的孢子悬浮液倒掉,用灭菌的解剖刀将琼脂培养基切割成1 mm×1 mm 大小的琼脂块,然后将琼脂块挑到灭菌的载玻片上,置于显微镜下进行观察,将有单个孢子的琼脂块接种在PDA 培养基上进行单孢分离培养[12],观察菌落形态并将单孢分离纯化的菌落4 ℃斜面保存,备用。
1.2.2 分离物致病性测定 参考周仪等[13]及张祥林等[14]的方法,略有改进,从生长健康的花椒树上剪取长20 cm、直径1 cm 左右枝条,用自来水冲洗干净后,分成2组,每组20根,共40根,其中1组用烧红的铁钉对枝条进行烫伤处理,另1组不做烫伤处理,在超净工作台上用75%酒精对3组枝条进行表面消毒后分别接种病斑分离的菌饼、孢子(孢子获得和浓度同“1.2.1”)和子实体分离菌饼,以接种PDA 培养基为对照,每个处理重复5次,枝条两端用无菌湿棉球保湿,然后放入垫有湿滤纸的培养皿中,培养条件同“1.2.1”。定期观察接种枝条的发病状况,对所有接种发病的枝条从病斑处分离病原菌,并观察培养形态、菌丝和孢子与原分离菌是否一致。
1.2.3 病原菌鉴定 采用形态学和分子生物学两种方法对病原菌进行鉴定。通过观察菌落形状、菌丝和孢子形态结构,结合《植物病原真菌学》[15]进行病原菌鉴定。
按照真菌DNA 提取试剂盒说明,以菌丝为材料提取DNA,利用真菌通用引物ITS-1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS-4(5′-TCCTCCGCTTATTGATATGC-3′)进 行ITS序列扩增,PCR 扩增反应体系(25μL):12.5μL mix,9.5μL dd H2O,1μL上游引物,1μL下游引物,1μL cDNA 模板。PCR 反应条件:94 ℃初始变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸1 min,共30 个循环,再72 ℃延伸5 min。扩增产物由西安擎科有限公司进行测序,测序结果在GenBank 上进行Blastn 同源性比对,利用MEGA7软件采用Neighbor-joining法构建系统发育树并分析结果[16]。
1.3 病原菌生物学特性
1.3.1 不同培养基对花椒腐朽病病原菌菌丝生长的影响 制备马铃薯葡萄糖琼脂培养基(PDA)[12]。在PDA 组成的基础上分别用花椒树皮、花椒叶、花椒枝条各200 g,代替200 g马铃薯,制作成花椒树皮、花椒叶及花椒枝条煎汁培养基,高温灭菌后倒入灭菌培养皿中,冷却凝固后,分别接入用直径为5 mm 打孔器在病原菌菌落边缘打取的菌饼,每个处理重复3次,放置于25 ℃恒温培养箱中,4 d后观察菌落生长情况,“十字”交叉法测定菌落直径。
1.3.2 不同温度对花椒树腐朽病原菌菌丝生长的影响 选用“1.3.1”中病原菌生长最适培养基,制备成平板并接种病原菌(方法同“1.3.1”),然 后 分 别 放 置 于10 ℃、15 ℃、20 ℃、25 ℃、30 ℃、35 ℃的培养箱中,4 d后“烫十字”烫交叉法测菌落直径。
1.3.3 不同湿度对花椒树腐朽病病原菌菌丝生长的影响 使用“1.3.1”中病原菌生长最适培养基,制备成平板,并接种病原菌(方法同“1.3.1”),放置于25 ℃、相对湿度为50%、60%、70%、80%、90%光照培养箱中,每个处理重复3 次,4 d后采用“烫十字”烫交叉法测量菌落直径。
1.3.4 不同p H 对花椒腐朽病病原菌菌丝生长的影响 分别用浓度为0.1 mol/L 的HCl和NaOH 溶液调节,制成p H 分别为5、6、7、8、9、10的平板,接种病原菌(方法同“1.3.1”),置于25 ℃、适宜相对湿度、光照度的培养箱中培养,4 d后“烫十字”烫交叉法测量菌落直径。
1.3.5 裂褶菌对花椒树的侵染过程 分别选用菌盖培养的菌丝、病斑分离菌的菌丝和孢子(孢子获得和浓度同“1.2.1”),通过有伤接种健康的花椒枝条后,置于温度30 ℃、相对湿度70%的培养箱中,逐天观察发病情况。
1.4 花椒树腐朽病病原菌室内生物农药筛选及毒力测定
1.4.1 几种生物农药对裂褶菌抑制作用测定采用生长速率法,将药剂的推荐浓度扩大50 倍(表2)用无菌水配制成溶液,取1 m L药剂加到灭菌冷却至45 ℃左右的49 m L PDA 培养基中,摇匀,倒入4 个培养皿中制成含药培养基,以只加1 m L无菌水的PDA 培养基为对照,然后接种病原菌,置于25 ℃培养箱中培养,4 d后“烫十字”烫交叉法测量菌落直径,并按下式计算药剂抑菌率,供试药剂种类及浓度见表2。

表2 供试药剂及推荐使用浓度Table 2 Tested fungicide and its recommended concentration
抑菌率=(对照菌落直径-处理菌落直径)/(对照菌落直径-5 mm)×100%
1.4.2 几种药剂对裂褶菌室内活性测定 参考杀菌剂室内毒力测定方法,以各药剂推荐浓度为最高浓度,按照对半稀释法用灭菌水将上述供试药剂分别稀释成5个浓度梯度,采用“1.4.1”中的方法制备不同浓度含毒PDA 平板,接菌培养、测量菌落直径,计算药剂抑菌率,然后将药剂浓度转化为对数值,为横坐标,再将抑菌率转化为机率值,为纵坐标,求出毒力回归方程和EC50。
1.5 数据分析
采用Excel2010和MEGA7软件对数据进行统计分析。
2 结果与分析
2.1 花椒病害发生情况调查
调查发现甘肃省永靖县三塬镇花椒园区内花椒树腐朽病发生严重,发病病株率高达77.50%,病情指数为29.00,该病害主要危害花椒树主干,尤其在疏剪、除孽后的伤口、枝干壁裂和芽眼处,受害部位的树皮开始慢慢开裂、脱落、腐朽、直至裸露,枝干由外向内不断干枯腐烂,形成大小不一的溃疡斑,最大的溃疡斑长度可达120 cm,危害严重的枝条整枝枯死,上面布满白色或灰白色的蘑菇状子实体,呈重叠状群生于树杆皮层上;同时还发现有的椒树枝条也出现溃疡斑,但其上并没有裂褶菌的子实体(图1)。在剪锯口、昆虫危害孔处长满子实体,有的未见子实体,但树皮腐朽脱落,露出木质部,形成大小不一的长条状溃疡斑,导致树势衰弱,品质下降,产量降低,树体老化,寿命缩短,严重时椒树干枯死亡。

图1 花椒树腐朽病症状Fig.1 Symptoms of decay disease of Zanthoxylum bungeanum tree
2.2 花椒树腐朽病病原菌分离纯化及鉴定
2.2.1 分离纯化 花椒枝条上裂褶菌子实体经保湿培养获得纯化菌(图2-A);从没有子实体的花椒枝条溃疡斑上共分离纯化到3种菌,经过形态学观察,分别是腐皮镰刀菌(Fusarium solaniMart.)、链格孢(Alternaria alternata)和一种未知菌(编号为Z1),其分离频率分别为20%、25%和80%。Z1单孢分离纯化菌培养发现菌落初期呈白色,辐射状向外生长,并伴有蘑菇的气味,培养一段时间后菌落表面产生大小不等的菌丝柱,在其顶部产生扇形的子实体,培养后期在子实体顶部培养皿盖上产生与子实体菌盖大小相同的淡黄色孢子印(图2-B)。
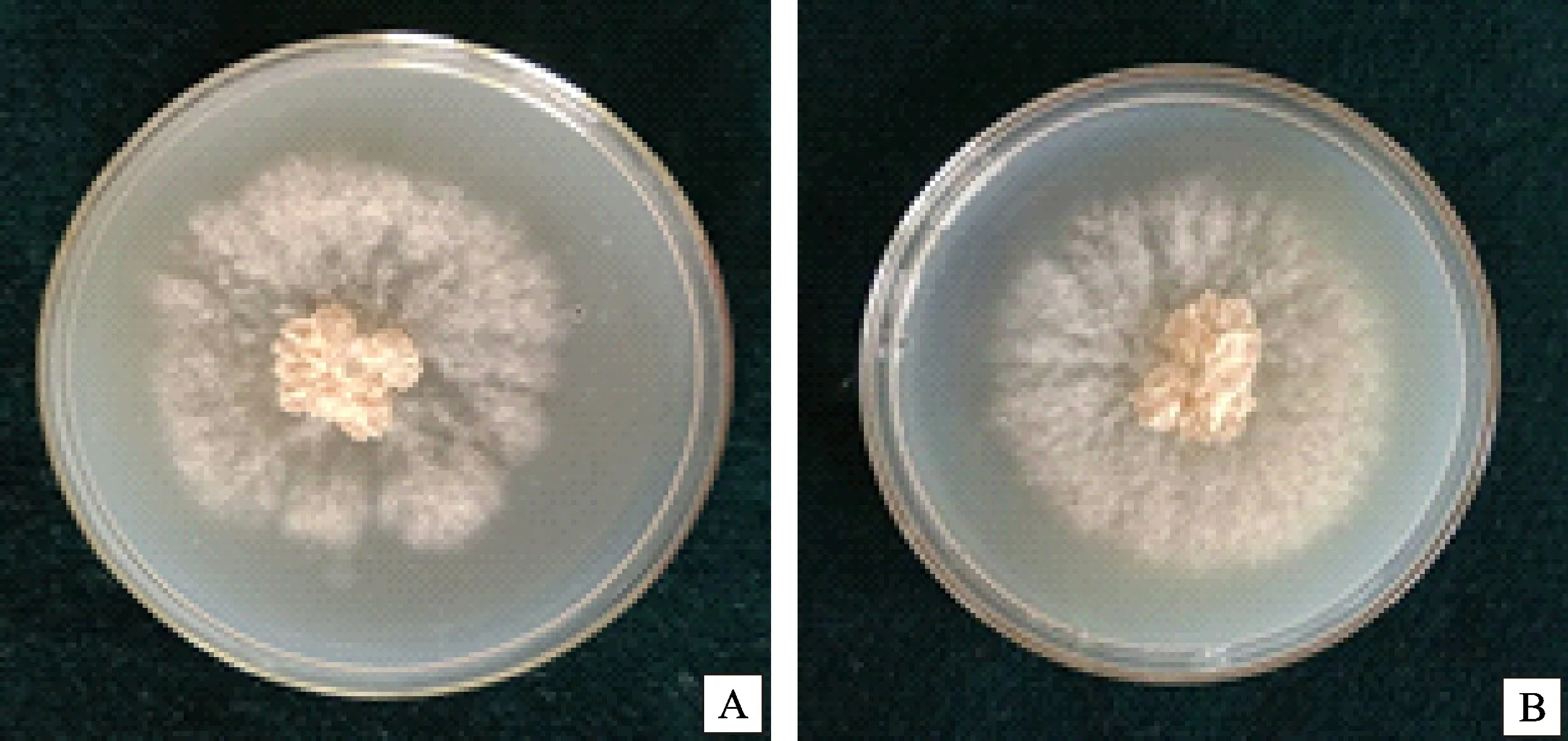
图2 病原物形态图Fig.2 Morphology of pathogens
2.2.2 Z1分离菌致病性 经致病性测定发现,分离菌Z1菌丝、孢子悬浮液接种于有伤口的花椒枝条上第5天时均能够侵染发病,且症状和裂褶菌子实体上分离到的菌丝的致病症状相同,将发病枝条上的菌丝清洗干净后,从枝条的病健交界处分离到与最初分离的Z1、裂褶菌子实体分离菌相同的病原菌(图3-A,3-B,3-C),无伤接种第5天时均未发病。
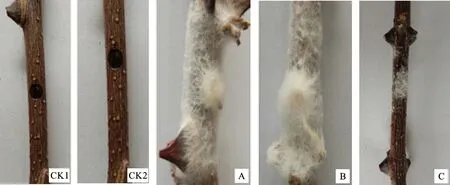
图3 分离菌Z1致病性测定Fig.3 Pathogenicity test of Z1 strain isolated from Zanthoxylum bungeanum tree
2.2.3 病原菌Z1的鉴定 Z1病原菌在PDA 上为辐射状白色菌落,随着培养时间的增加菌落上产生大小不等且倾斜向上生长的菌丝柱,菌丝柱顶端有凹陷小孔,呈珊瑚状,顶端慢慢膨大,在边缘形成几条菌褶,最后顶端张开,形成长约0.4~1.4 cm、宽约0.2~1.4 cm 菌褶朝上的子实体,菌盖圆形或扇形,外缘向内卷,有多个裂瓣,初形成时菌褶较密,等长或不等长,从基部辐射而出,呈白或灰白色,后期变为深褐色、灰褐色或黄褐色(图4-A~4-G),并在菌盖上部的培养皿盖上弹射出与其相同大小的担孢子堆,孢子印白色(图4-H),孢子形态为单孢无色,棍棒状,一端有一斜角,大小为11.81μm×6.62μm(图4-I);挑取菌丝进行显微观察,菌丝有隔、分支状,粗细不一,在近隔膜处形成锁状联合,菌丝外着生小梗细棍棒状,为针状体,未见分生孢子,偶见菌丝膨大;菌丝粗细不均(图4-J~4-L);发现该菌根据病原菌的形态特征及培养性状,将引起花椒枯枝病的病原菌初步鉴定为裂褶菌Schizophyllum communeFranch.。
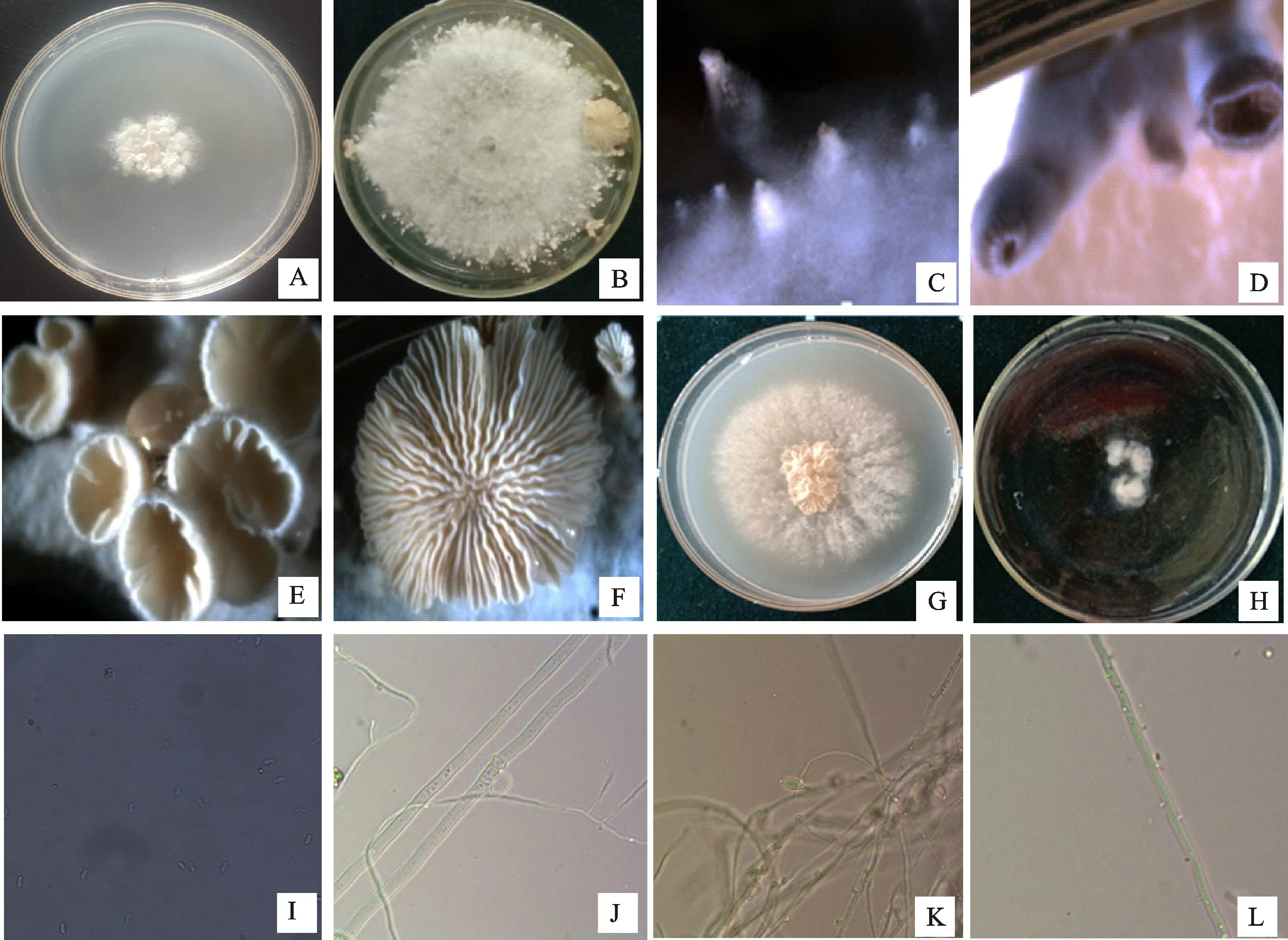
图4 Z1菌株形态特征Fig.4 Morphological characteristics of Z1 strain
通过PCR 扩增得到1条长度为602 bp的片段,通过序列同源性比对发现Z1 分离菌与裂褶菌Schizophyllum communeFranch的同源性达到99%,结合形态学特征,进一步将该菌鉴定为担子菌门(Basidiomycotina)、层 菌 纲(Hymenomycetes)、伞菌目(Agaricales)、裂褶菌科(Schizophyllaceae)、裂褶菌属(Schizophyllumsp.)、裂 褶 菌(Schizphylhls commneFranch),GenBank序列号为MT251888.1(图5)。
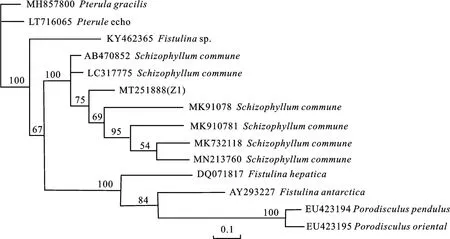
图5 花椒树腐朽病病原菌系统发育分析Fig.5 Phylogenetic analysis of pathogen of Zanthoxylum bungeanum tree decay disease
2.3 花椒树腐朽病病原菌生物学特性
2.3.1 不同培养基对裂褶菌生长的影响 裂褶菌在不同种类培养基上均能生长,且生长速度存在明显差异。其中在花椒枝条煎汁培养基上菌落生长最快,第4天时菌落直径最大,为67.2 mm;PDA 培养基和花椒叶煎汁培养基次之,菌落直径分别为58.3 mm 和58.0 mm,花椒树皮煎汁培养基生长最慢,菌落直径仅为44.3 mm,除PDA培养基和花椒叶煎汁培养基菌落直径之间差异不显著外,其他培养基菌落直径之间差异极显著(图6)。
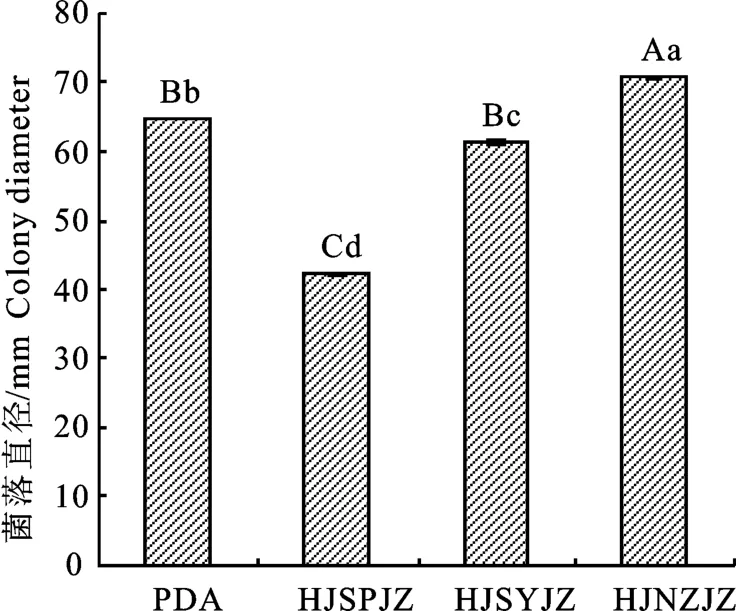
图6 裂褶菌在不同培养基上的生长情况Fig.6 Growth of S.commune on different medium
2.3.2 温度对裂褶菌生长的影响 温度对病原菌生长状况影响显著,在15~35℃裂褶菌均可生长,且在10~30℃,菌落生长速度与温度成正比,温度越高菌落生长越快,不同温度下培养4 d时,10 ℃下菌落直径仅为10.7 mm,30 ℃下菌落直径最大,为58.7 mm,其他温度的菌落直径介于二者之间,且存在极显著差异;当温度超过最适温度(30 ℃)后,菌落生长速度开始下降,35 ℃的菌落直径为41.3mm,与20 ℃的菌落直径之间异显著差(图7)。
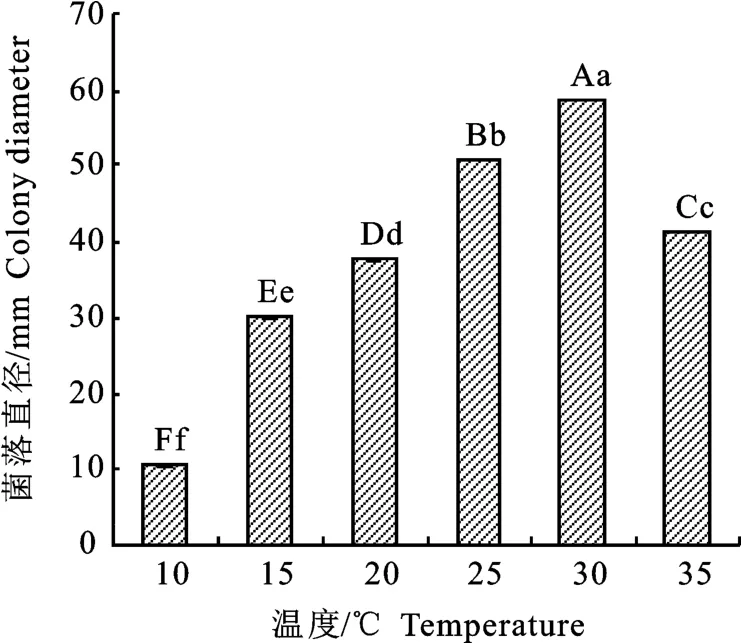
图7 不同温度下裂褶菌生长情况Fig.7 Growth of S.commune under different temperatures
2.3.3 湿度对裂褶菌生长的影响 裂褶菌在相对湿度为50%~90%时均能生长,当相对湿度在50%~70%时,菌落生长速度随着湿度的增加而增大,且在相对湿度为70%时菌落生长最快,直径最大,为58.6mm,在相对湿度在70%~90%时,菌落生长速度随湿度的增加而减小;除相对湿度为60%和80%时菌落直径之间差异显著外,其余相对湿度下菌落直径之间均存在极显著差异(图8)。
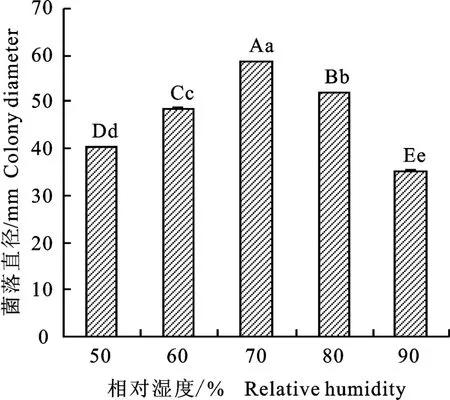
图8 不同湿度下裂褶菌生长情况Fig.8 Growth of S.commune under different humidity
2.3.4 p H 对裂褶菌生长的影响 裂褶菌在p H为5~10的培养基上均能生长,在p H 为7的培养基上菌落生长最快,第4 天菌落直径为34.0 mm;p H 为10时,菌落生长最慢,其直径为21.0 cm,其余p H 条件下菌落直径介于二者之间,除p H 为6和7时菌落直径之间差异不显著外,与其他p H 条件下的菌落直径之间差异极显著(图9)。
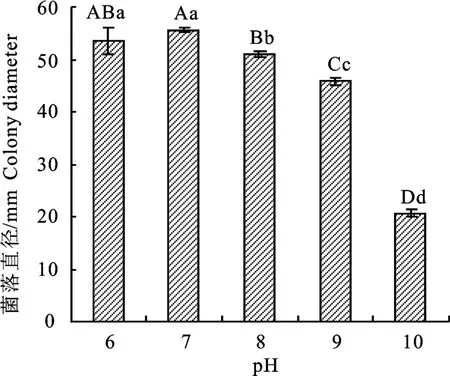
图9 不同p H 条件下裂褶菌生长情况Fig.9 Growth of S.commune under under different p H conditions
2.3.5 裂褶菌对花椒树的侵染过程 观察置于温度30 ℃、相对湿度70%的培养箱中的有伤接种菌盖培养的菌丝、病斑分离菌的菌丝和孢子的花椒枝条,发现在该适宜条件下2 d后裂褶菌两种菌丝接种的部位均产生茂密的白色菌丝且菌丝向无伤的树皮扩展,5 d后菌丝扩展至整个枝条,15 d后菌丝更加茂密,且菌丝柱产生,25 d后菌丝柱进一步形成子实体原基;而接种孢子悬浮液的枝条2 d后仅在接种部位产生稀疏的菌丝,5 d后菌丝向四周扩展,扩展面积为接种面积的1.5倍,15 d后菌丝扩展至整个枝条,有少量的菌丝柱产生,25 d后菌丝茂密,菌丝柱变大,但未见子实体原基(图10)。

图10 花椒树腐朽病病原菌侵染过程Fig.10 Infection process of S.commune on Zanthoxylum bungeanum tree
2.4 室内生物药剂筛选及活性测定
研究结果表明,4种生物农药对裂褶菌均具有较强的抑菌作用,在推荐使用浓度下6%寡糖链蛋白、哈茨木霉和深绿木霉的抑菌率分别为99.99%、100%和100%,与1 500 g/m L 80%嘧霉胺的抑菌率相同,且高于667 g/m L 30%氟菌唑的抑菌率;1 000亿/g枯草芽孢杆菌的抑菌率较低,为83.39%,毒力测定结果表明,80%嘧霉胺活性最强,EC50值为30.45μg/m L,1 000亿/g枯草芽孢杆菌的活性最低,为486.46μg/m L,其他3种生物农药和30%氟菌唑的EC50值介于二者之间(表3,表4)。
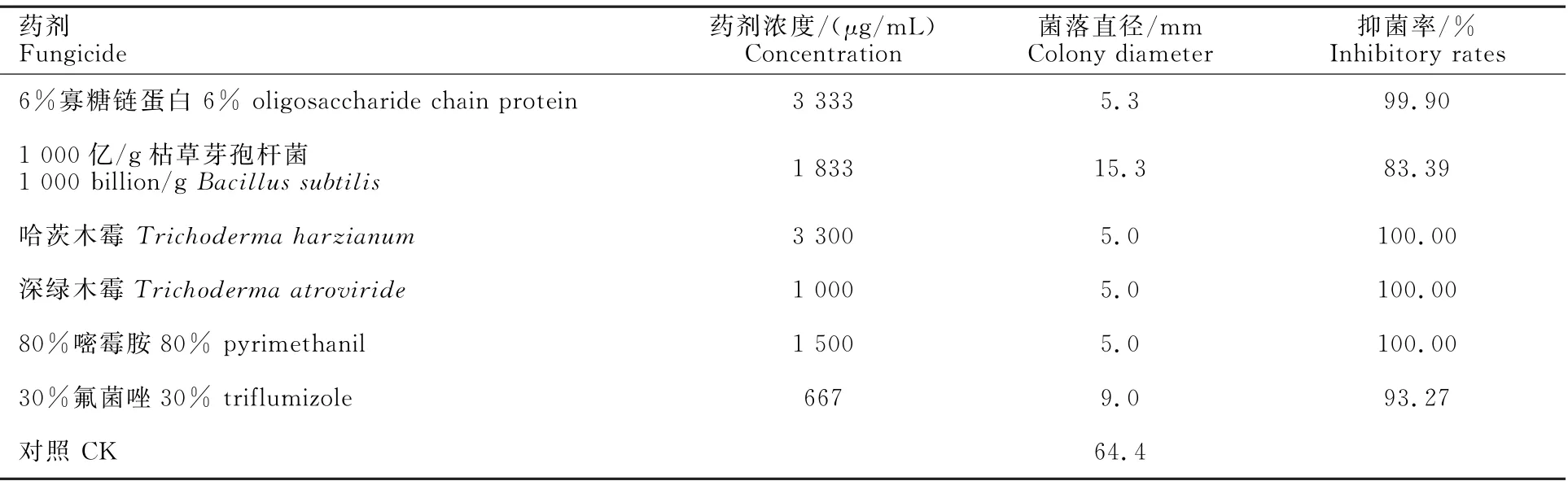
表3 4种生物农药对裂褶菌抑制作用Table 3 Inhibition of four kinds of biological pesticides on S.commune

表4 4种生物农药对裂褶菌的活性测定Table 4 Activity determination of four biological pesticides against S.commune
3 讨论
通过对花椒树腐朽病病原菌形态学鉴定发现,该病原菌菌落的形状、颜色、菌丝的菌锁结构和针状体、孢子及子实体以及分子鉴定均表明该菌为裂褶菌Schizophyllum communeFranch;在自然寄主及人工培养基上S.communeFr.均为有性型,未发现无性型。裂褶菌是一种兼性寄生真菌,既能腐朽枯立木和倒木,也能侵染活立木[17]。在伤口处和主杆有腐烂斑的地方侵染率极高[18],可以引起木材白色腐朽[19-21]、苹果树腐烂病、桃树腐朽病,发病率高达100%,且树龄越长发病率越高[22];本研究也发现该病原菌在树势弱、剪锯口和腐烂斑多的花椒树主杆和大枝上发生严重。
目前,对于花椒树腐朽病主要采用化学农药通过防治天牛等蛀杆昆虫,减少伤口,减轻该病害的发生,在防治核桃裂褶菌病害时,主要采用涂抹剂防治核桃溃疡病的发生,尚未见直接针对裂褶菌进行防治的化学药剂和生物药剂的研究报道[8,17],选用生物药剂防治花椒树腐朽病对减轻裂褶菌的危害,降低化学农药残留污染、提高花椒品质具有重要意义,在室内筛选出对花椒树腐朽病菌具抑菌作用且与两种化学农药80%嘧霉胺和30%氟菌唑相同或略高,抑菌活性较高的3种生物农药,分别为6%寡糖链蛋白、哈茨木霉和深绿木霉。但是,本研究仅对分离获得的主要分离菌进行了致病性测定,而对另外两种菌是否具有致病性,与裂褶菌之间的协同关系,以及3种生物药剂在田间对花椒树腐朽病的防治等问题尚未涉及,还有待进一步研究。
4 结论
花椒树树杆腐朽病在甘肃省永靖县三塬镇10 a树龄的花椒树上发生严重,平均发病率约为77.50%,病情指数为29.00,枝条上枯斑面积最大可达240 cm2,将引起该病害的主要病原菌鉴定为Schizophyllum communeFranch,病原菌生长的最适培养基为花椒枝条煎汁葡萄糖琼脂培养基,最适条件为30 ℃、相对湿度70%、p H7,菌丝比孢子侵染寄主快10 d,在菌丝侵染寄主第15天时产生菌丝柱,第25天时菌丝柱进一步形成子实体原基,接着产生子实体;筛选出3种对Schizophyllum communeFr.抑菌活性较高的生物农药——6%寡糖链蛋白、哈茨木霉和深绿木霉。

