青枯菌Ⅲ型分泌系统HrcN 原核表达与亚细胞定位
周大祥,杨俊年,龙泉洲,殷幼平,熊 书
(1.重庆大学 生命科学学院,重庆市基因功能与调控重点实验室,重庆 400300;2.重庆三峡学院 生物与食品工程学院,重庆 404120;3.重庆三峡医药高等专科学校 基础医学部,重庆 404120)
青枯病由青枯菌(Ralstonia solanacearum)引起,是一种世界性分布的重大病害[1]。该菌能够侵染50多个科200余种植物,在全球范围内曾导致重大的经济损失。青枯菌能够在潮湿的土壤或水体中存活数年[2],当遭遇易感寄主,青枯菌就会进入植物根部,在根部皮层定殖,然后入侵木质部导管,最终通过导管系统迅速扩展到植物地上部,在寄主体内大量增殖引起导管堵塞、功能紊乱,出现萎蔫症状。
自青枯菌基因组测序完成后,在致病力分化[3]、群体感应[4]、分泌系统[5-6]和寄主免疫应答[7-8]等方面研究进展较快,相应的基因功能与调控网络相继被解析[9-10]。青枯菌利用Ⅲ型分泌系统(typeⅢsecretion system,T3SS)将效应蛋白分泌注入植物细胞中,而效应蛋白的分泌由T3SS转位介导。T3SS 含有多种ATP 酶,为效应蛋白的分泌提供能量[11]。hrc N基因作为T3SS结构基因之一,表达产物为ATP 酶(ATPase),通过催化ATP 水解为效应蛋白的分泌提供能量。Hrc N 蛋白可利用水解ATP 产生的能量重塑多种蛋白底物,因此,其在膜融合、蛋白质修饰和降解等许多生理活动中发挥重要的作用[12]。
野油菜黄单胞菌辣椒疮痂致病变种(Xanthomonas campestrispv.vesicatoria)敲除hrc N基因后,导致一些需要能量才能转运的效应蛋白分泌受阻,病原菌致病力降低,表明hrc N基因对病原菌的致病性有重要的影响[13]。丁香假单胞菌菜豆致病变种(Pseudomonas syringaepv.phaseolicola)的Hrc N 是一种通过寡聚作用激活的ATP酶,电镜观察、流体力学和蛋白表达等分析发现,Hrc N 有4种不同的组成形式,其中十二聚体是细胞内膜的主要形式,其ATP 酶活性比单聚体的高700倍。Hrc N 作为激活的同源寡聚物催化蛋白质易位,对T3SS和细菌的致病性有重要的影响[14]。Hrc N 的稳定性依赖于保守的Hrc L蛋白,该蛋白与HrcN 结合,Hrc N 和Hrc L均与保守的内膜蛋白Hrc U 相互作用[13]。由于T3SS分子伴侣不能被分泌或转运,必须在效应蛋白分泌前从分子伴侣-效应蛋白复合体中释放出来,这种作用是由T3SS相关的ATP 酶(InvC和Hrc N)以ATP依赖的方式进行的。这些ATP酶也作为T3SS效应蛋白的去折叠酶发挥作用,使效应蛋白保持未折叠或部分未折叠的构象[15]。最近Gan等[16]研究发现Hrc N 以ATP依赖的方式催化分子伴侣HpaB与T3SS效应蛋白复合物释放出游离效应蛋白。
青枯菌Hrc N 蛋白Motif预测显示该蛋白为ATP酶,定位于细胞内膜和细胞质。根据现有的文献报道和预测结果,推测HrcN 蛋白是一种位于青枯菌细胞内膜上的ATP 酶。为了验证此假设,本研究对青枯菌hrc N基因进行原核表达和蛋白亚细胞定位,初步分析该蛋白的功能,为进一步深入分析青枯菌T3SS及其效应蛋白的功能奠定基础。
1 材料与方法
1.1 材料
野生型番茄青枯菌CBM613 菌株由西南大学植物保护学院马冠华教授馈赠。DH5α和农杆菌GV3101,pET30a和p RI-eGFP质粒载体由重庆大学生命科学学院重庆市基因功能与调控重点实验室保存。孔雀绿磷酸酶检测试剂盒购自美国Hayward公司。限制性核酸内切酶BamHⅠ、XhoⅠ和NdeⅠ等购自美国Thermo 公司;IPTG、MES和乙酰丁香酮等购自北京鼎国生物技术有限责任公司。Ni-NTA sefinose Column及其支撑介质购自生工生物工程(上海)股份有限公司,其余试剂皆为国产分析纯。
1.2 青枯菌HrcN 蛋白原核表达分析
1.2.1 重组质粒的构建 根据CBM613 菌株hrc N基因序列及p ET30a多克隆位点设计引物(5′→3′),L2024:GGCTGATATCGGATCCAT GACCCATCTCGCGCTG,下划线为BamHⅠ酶切位点;L2025:GGTGGTGGTGCTCGATCATGCCAGTGCGATCTCGTC,下划线为XhoⅠ酶切位点。下划线前面是p ET30a载体序列,后面是hrc N基因序列。以青枯菌CBM613菌株基因组DNA 为模板进行PCR 扩增,将回收的DNA片段连接到T 载体,转化DH5α大肠杆菌,挑取PCR 验证过的阳性克隆菌株测序。同时将电泳后回收的PCR 产物与BamHⅠ和XhoⅠ双酶切的p ET30a质粒无缝克隆构建重组载体p ET30ahrc N。以L2024/L2025 为p ET30a-hrc N载体进行引物鉴定,并送苏州金维智生物科技有限公司测序。
1.2.2 重组蛋白诱导表达及纯化 挑取阳性克隆(p ET30a-hrc N)接种于含卡那霉素(Kan)的LB培养基中,加入1 mmol/L IPTG 37 ℃诱导2 h。超声5 s,间隔5 s,超声破碎20 min,通过SDS-PAGE 电泳发现Hrc N 蛋白主要存在于沉淀中,经Ni-NTA sefinose Column层析柱纯化,250 mmol/L 咪唑洗脱。该蛋白表达为包涵体,将洗脱液在TGE(Tris-甘氨酸-EDTA)缓冲液中进行透析复性。复性的Hrc N 蛋白利用孔雀绿磷酸酶检测试剂盒测定其活性,按照Lorenz 和Büttner[13]的方法分别测定1、5、10、15、20、25和30 min时的吸光度,测定波长为650 nm,将测定的吸光度与磷酸盐标准曲线的吸光度进行比较。
1.3 青枯菌HrcN 蛋白亚细胞定位
1.3.1 重组质粒构建 根据CBM613 菌株hrc N基因序列及p RI-eGFP 多克隆位点设计引物 (5′→3′),L2035:TCTTCACTGTTGATA CATATGATGACCCATCTCGCGCTGCT,下划线为NdeⅠ酶切位点;L2036:GCCCTTGCTCACCATGGATCCTGCCAGTGCGATCTCGTCA,下划线为BamHⅠ酶切位点。下划线前面是p RI-eGFP载体序列,后面是hrc N基因序列。以青枯菌CBM613菌株基因组DNA 为模板进行PCR 扩增,测序后将电泳回收的PCR 产物与NdeⅠ和BamHⅠ双酶切的p RI-eGFP质粒无缝克隆构建重组载体p RI-eGFP-hrc N。以L2035/L2036为p RI-eGFP-hrc N载体进行引物鉴定,并送苏州金维智生物科技有限公司测序。
1.3.2 蛋白亚细胞定位 提取p RI-eGFP-hrc N重组质粒与空载体p RI-eGFP,化学转化法转化农杆菌GV3101 后,扩繁农杆菌28 ℃培养至OD600=0.3,用等体积的缓冲液悬浮,室温静置4~6 h,然后由下表皮注射到烟草叶片中,继续培养4~6 d,用激光共聚焦显微镜直接观察叶片的荧光情况。
2 结果与分析
2.1 p ET30a-hrcN 阳性克隆菌落PCR鉴定
使用L2024/L2025 引物对,以青枯菌DNA为模板,扩增出hrc N基因片段,长度为1 320 bp(图1)。
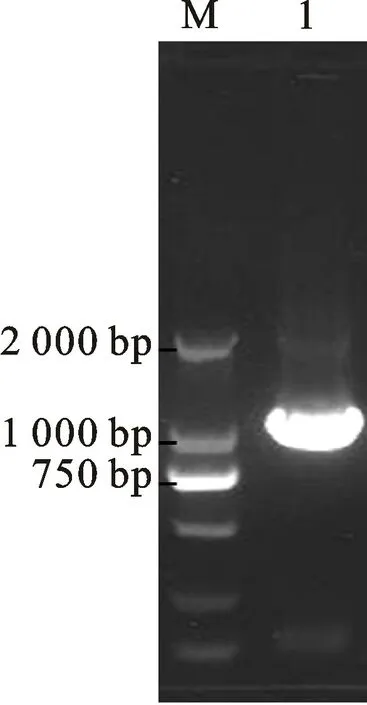
图1 青枯菌CBM613菌株hrcN 基因的扩增Fig.1 PCR amplification of hrc N of Ralstonia solanacearum isolate CBM613
p ET30a-hrc N原核表达载体构建完成后,挑取在Kan抗性平板上生长的菌落进行PCR 鉴定。若载体与目的基因连接,则出现1 350 bp左右的条带(图2)。测序结果证实hrc N基因与p ET30a原核表达载体连接成功。
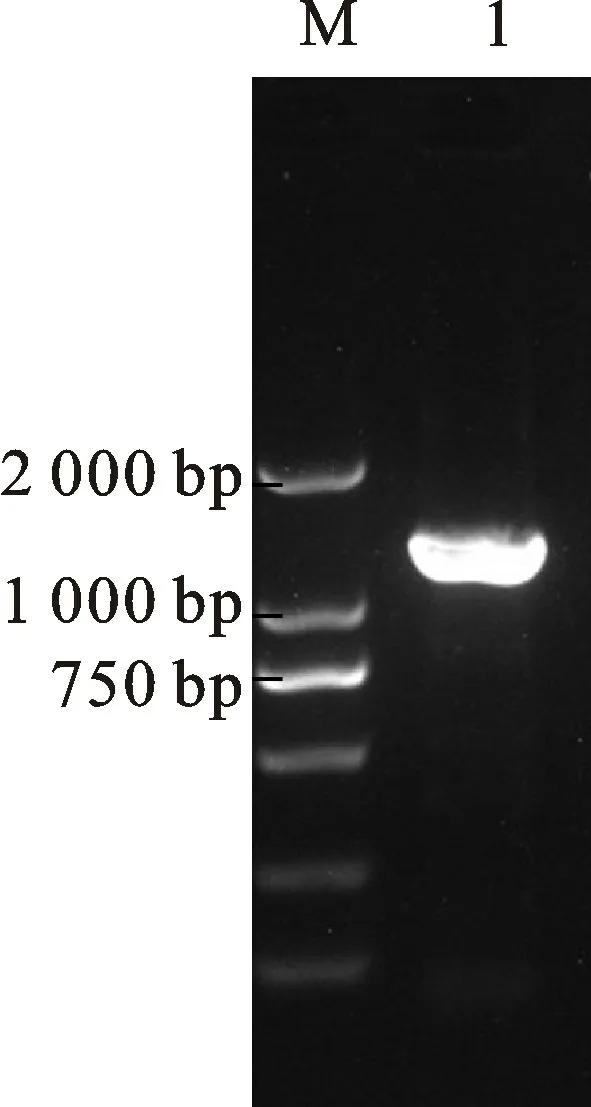
图2 PCR 扩增鉴定pET30a-hrcN 阳性克隆菌落Fig.2 Identification of pET30a-hrc N positive colonies based on PCR amplification
2.2 p ET30a-hrc N 融合蛋白诱导表达
挑取p ET30a-hrc N阳性克隆接种于含Kan(50μg/m L)的LB 液体培养基中,37 ℃,200 r/min培养后,加入1 mmol/L IPTG 诱导表达蛋白,从SDS-PAGE蛋白电泳图可以看出,2 h即可诱导表达出Hrc N 蛋白,对照和上清液中的Hrc N 蛋白很少,主要存在于沉淀中,Hrc N 蛋白质分子质量为47 ku左右,表达的蛋白主要以包涵体形式存在(图3)。纯化的Hrc N 蛋白大约1 mg(图4)。
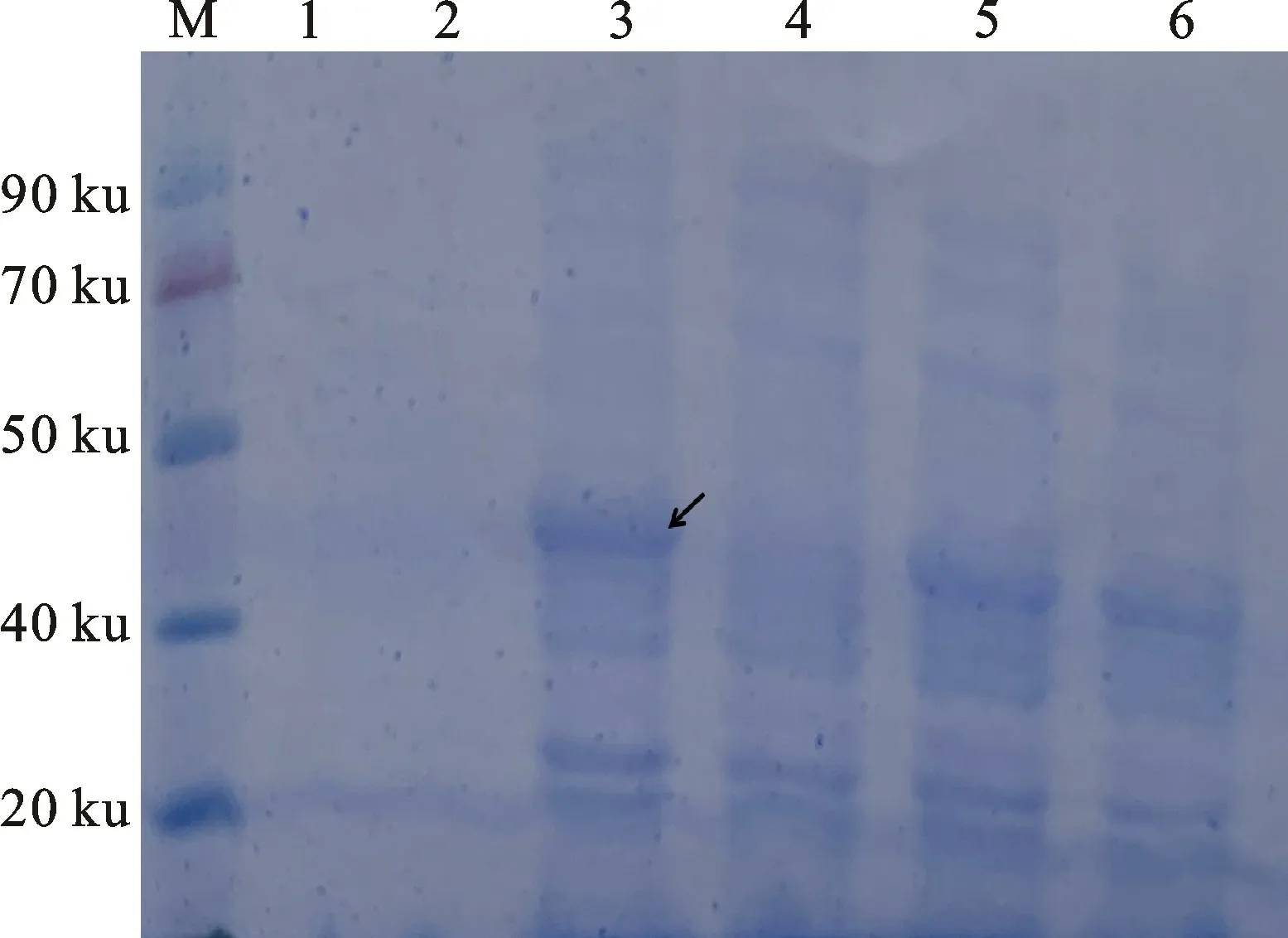
图3 融合蛋白诱导表达的SDS-PAGE结果Fig.3 SDS-PAGE of expression of protein induced by IPTG

图4 HrcN 蛋白纯化Fig.4 Purification of HrcN protein
2.3 HrcN 具有ATP酶活性
利用孔雀绿磷酸酶检测试剂盒测定Hrc N 蛋白的活性,发现Hrc N 蛋白水解ATP酶与时间呈线性关系,每微克蛋白质每分钟释放0.4 nmol左右的磷酸盐(图5)。结果表明HrcN 蛋白作为一种ATP酶,可以在胞内水解ATP,为分泌过程提供能量。
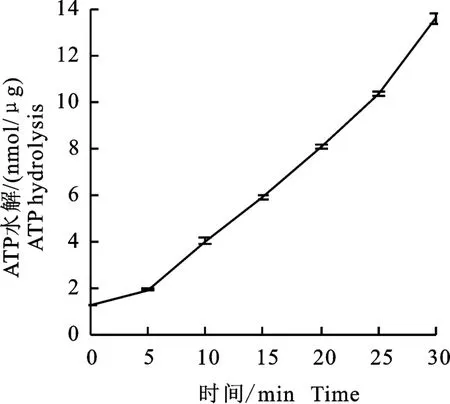
图5 HrcN 蛋白活性Fig.5 Activity of HrcN protein
2.4 PCR鉴定p RI-eGFP-hrc N 阳性克隆菌落
使用L2035/L2036引物对,以青枯菌DNA为模板,扩增出hrc N基因,长度为1 320 bp(图6)。
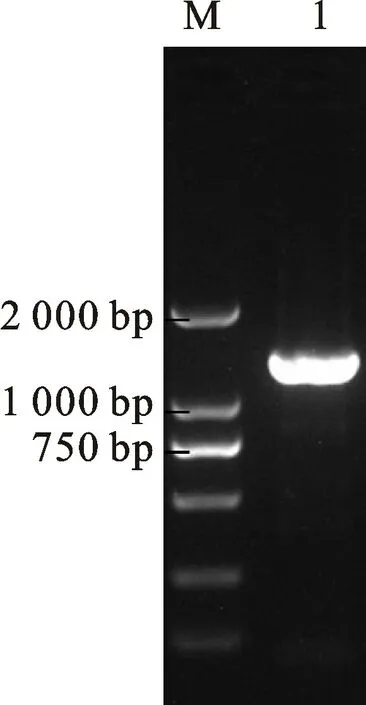
图6 PCR 扩增青枯菌CBM613的hrc N 基因Fig.6 PCR amplification of hrcN of Ralstonia solanacearum isolate CBM613
p RI-eGFP-hrc N 蛋白亚细胞定位载体构建完成后,挑取在Kan抗性平板上生长的菌落进行PCR 鉴定,若载体与目的基因连接,则出现1 360 bp左右的条带(图7)。测序证实hrc N基因与p RI-eGFP-hrc N 蛋白亚细胞定位载体连接成功。
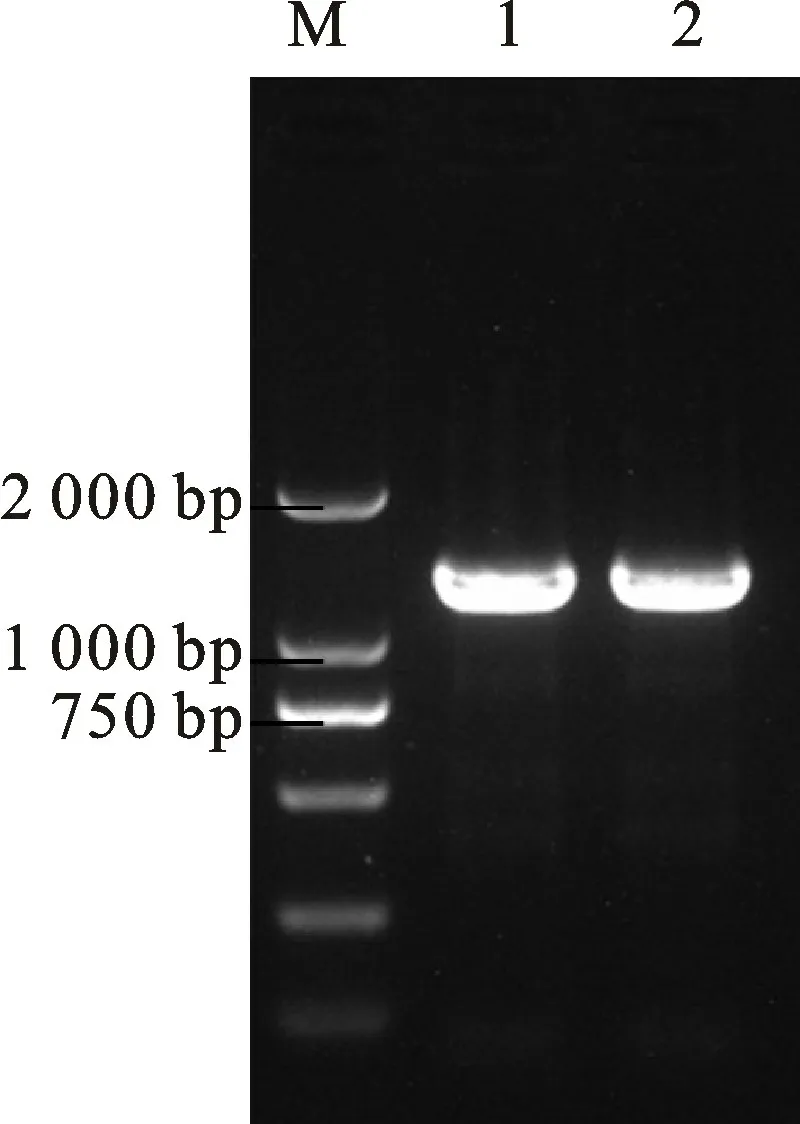
图7 PCR 鉴定pRI-eGFP-hrcN 阳性克隆菌落Fig.7 Identification of p RI-eGFP-hrcN positive colonies based on PCR amplification
2.5 亚细胞定位荧光检测
p RI-eGFP-hrc N重组质粒和空载体转化农杆菌后,扩大培养,由下表皮注射到烟草叶片中,用激光共聚焦显微镜观察叶片的荧光。烟草自发光比对分析表明,Hrc N 蛋白部分在叶绿体表达,根据烟草细胞形态分析,部分在细胞内膜和细胞质表达(图8),与蛋白亚细胞定位预测结果基本一致。
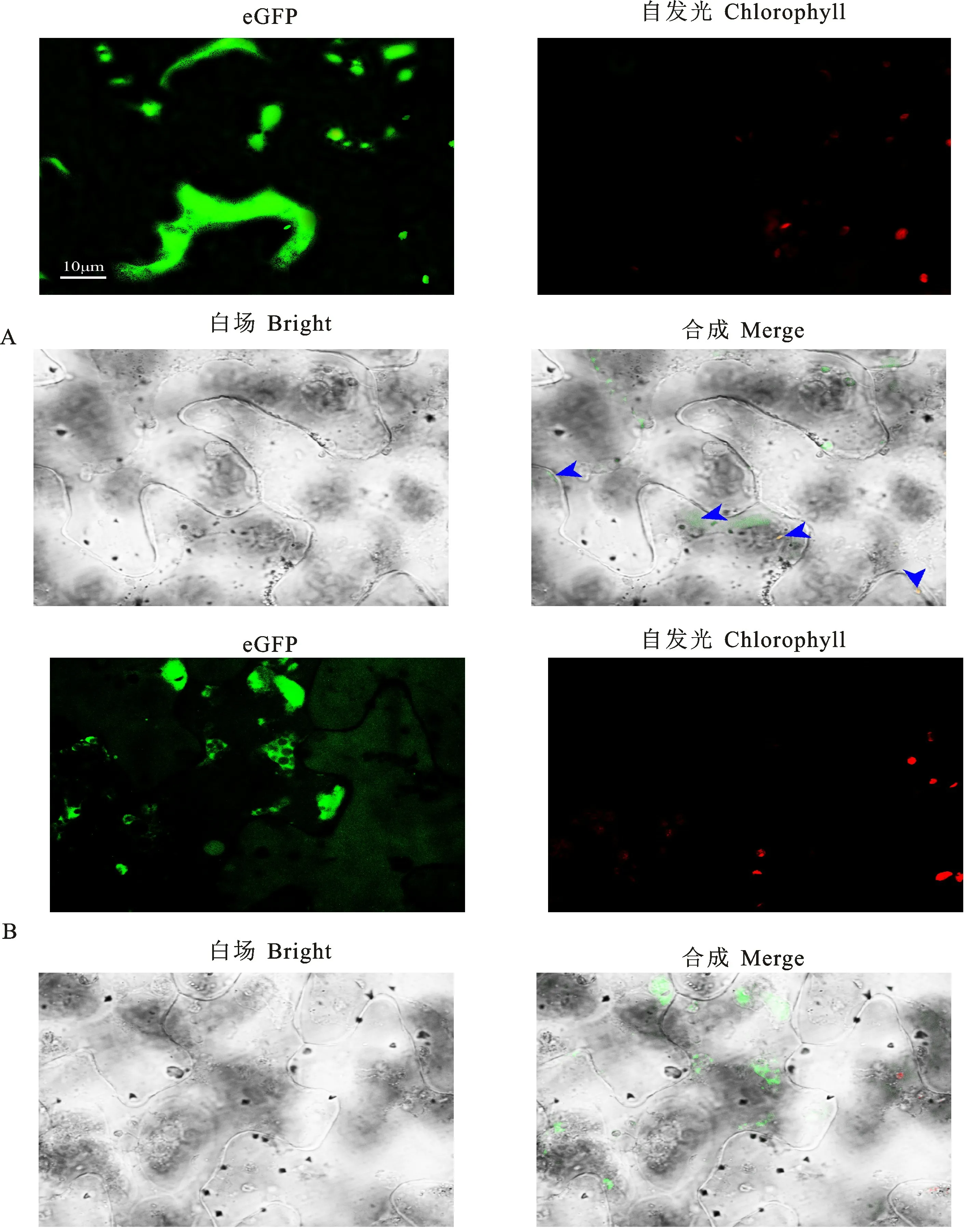
图8 HrcN 蛋白在烟草表皮的亚细胞定位Fig.8 Subcellular localization of HrcN protein in tobacco epidermal cell
3 讨论
T3SS是一种蛋白质分泌系统,通常将效应蛋白注入寄主细胞中,跨膜的T3SS装置与一种可能为分泌过程提供能量的ATP 酶有关,且依赖于ATP 酶的活性催化蛋白质的去折叠[17]。T3SS效应蛋白的分泌由跨病原菌细胞内膜和外膜的转位酶催化,需要与F1/V1 ATPase同源的亲水性T3SS组分存在。
Hrc N 蛋白作为植物病原菌T3SS的结构蛋白之一,可利用水解ATP 产生的能量重塑多种蛋白底物,因此在膜融合、蛋白质修饰和降解等多种生理活动中发挥重要的作用[12]。与其他T3SS相关的ATP酶一样,Hrc N 与F0/F1 ATPase亚基同源,包含介导ATP 结合和水解的Walker框[18]。蛋白互作研究显示,Hrc N 与T3SS 底物特异性开关蛋白HpaC以及分子伴侣HpaB相互作用,促进多种效应蛋白的分泌。体外伴侣试验显示Hrc N 以ATP 依赖的方式解离T3SS分子伴侣HpaB和效应蛋白Xop F1之间的复合物,表明Hrc N 参与了HpaB结合效应蛋白的释放。同时,效应蛋白的释放依赖于Hrc N 磷酸盐结合环中保守的甘氨酸残基,这对酶活性和蛋白质功能有重要影响。然而,不依赖HpaB 高效分泌的T3SS易位子和菌毛蛋白也需要Hrc N[13]。此外,除了T3SS 中的invC和hrc N基因表达ATP酶,还有一些与ATP酶有关的基因,其中有3个直接表达ATP 酶,编号分别为 Aave2163、Aave1249和Aave1063,T3SS中转运蛋白所需的能量可能从这3 个ATPase基因中获得[19]。大肠杆菌ATP酶Esc N 以及中心柄Esc O 的冷冻电镜结构显示,Esc N 具有旋转ATP 酶的不对称性[20]。原核表达结果发现青枯菌Hrc N蛋白主要存在于沉淀中,表达的蛋白主要以包涵体形式存在。ATP 酶活性测定结果显示Hrc N 蛋白作为一种ATP酶,可以在胞内水解ATP为分泌过程提供能量,蛋白注射接种番茄叶片显示Hrc N蛋白对番茄叶没有过敏反应,上述结果表明Hrc N 是T3SS的结构蛋白之一。大多数蛋白质不能单独发挥生理功能,而需要与其他蛋白互作形成复合体。基于互作蛋白的作用机理,研究蛋白间互作网络才能全面阐明靶标蛋白的生理功能[21]。关于Hrc N 是单独完成还是与其他蛋白协同完成ATP 的水解需要通过酵母双杂交、免疫共沉淀(CO-IP)和Pull-down等蛋白互作技术进一步研究。
蛋白亚细胞定位是基因功能研究的主要内容之一,对全面认识目的蛋白的形态建成、作用机制以及调控机理等具有参考意义。目前蛋白亚细胞定位的主要手段有生物信息学预测、免疫组织化学定位、蛋白组学技术、荧光蛋白定位、共分离标识酶定位等。Hrc N 是一种ATP 酶,通过催化ATP的水解为效应蛋白的分泌提供能量[12],蛋白亚细胞定位结果显示HrcN 蛋白可能定位于叶绿体、细胞内膜或细胞质。根据试验结果和已有的文献报道,推测Hrc N 是一种定位于细胞内膜的外周蛋白,但还需要通过细胞内膜特异性染料证实。至于为什么Hrc N 蛋白在叶绿体和细胞质表达,可能与叶绿素和细胞质中的线粒体与内质网等细胞器膜上也存在ATP 酶有关,可通过特异性细胞器染料定位进一步确定。

