石榴低温响应因子CBF基因家族鉴定及其表达分析
刘龙博,郑树轩,郑 洁
(1.淮北师范大学 生命科学学院,安徽淮北 253001;2.河南省农业广播电视学校 夏邑分校,河南商丘 476400)
植物生长发育过程中不可避免地遭遇多种多样的不良环境胁迫,其中低温被认为是限制植物生长和地理分布的重要生态因素,也是影响农作物与园艺植物生产的主要自然灾害。低温胁迫可引起植物形态变化,并导致代谢紊乱,作物减产,甚至死亡[1]。研究指出植物可通过调控一系列生理生化过程以适应不利生长环境,如冷驯化(Cold acclimation,CA)被认为是温带植物提高耐寒性和安全越冬的重要策略[2]。CBF(C-repeat binding factors)又称DREB(dehydration-responsive element binding),是参与冷驯化的重要转录因子[3]。它能够识别并结合至低温应答基因COR(cold-regulated)启动子区的CRT/DRE(G/ACCGAC)元件参与冷驯化过程[4]。模式植物拟南芥CBF1/DREB1C、CBF2/DREB1B、CBF3/DREB1A能够迅速响应低温诱导,进而调控173个COR 参与低温胁迫应答[5]。过表达AtCBF1能够显著提高水稻、烟草、草莓、番茄和黄瓜低温胁迫抗性[6],而CBF1和CBF3敲除后拟南芥低温胁迫抗性降低约60%[7]。以上研究表明CBF 在植物低温胁迫抗性调控过程中发挥重要功能。
CBF属于AP2转录因子家族的一个保守分支,除含有AP2结构域外,在其上下游还分布有PKKPAGRx KFx ETRHP 和DSAWR 两 个 特 征氨基酸序列。拟南芥CBF基因家族共6个成员,除CBF1~CBF3外,还 包 含 有CBF4/DREB1D、DREB1E/DDF2和DREB1F/DDF1[8]。 但AtCBF4、At DREB1E和At DREB1F主要参与ABA、干旱以及盐渍胁迫响应,而并非低温。基于全基因组数据,大量CBF基因家族成员已在多个植物物种中被广泛研究并证实参与植物低温胁迫响应,如:小麦(Triticum aestivum)[9]、油菜(Brassica rapa)[10-11]、苹 果(Malus domestica)[12]、茶树(Camellia sinensis)[13-14]、月季(Rosa chinensis)[15]等。然而有关石榴CBF基因家族的研究鲜有报道。
石榴(Punica granatumL.)起源于中亚地区,经由丝绸之路引入中国,距今已有2 000多年栽培历史。其果实外型美观、口感鲜甜,含大量安石榴苷等鞣花单宁类抗氧化活性物质,具备潜在保健和医用价值[16]。石榴花期长、树姿美观,兼具有观赏价值,逐步被应用在园林绿化。石榴业已成为一种价值较高的经济树种。但石榴喜暖畏寒,在中国北方及黄淮石榴栽植片区冬春季气温较低,常有降温霜冻甚至倒春寒等灾害性天气,石榴易遭遇周期性冻害问题,特别是以‘突尼斯’软籽石榴为代表的软籽系列品种耐寒性更差,不利于优良品种推广[17]。但目前石榴抗寒性研究主要集中在通过测定生理生化指标比较不同石榴品种低温胁迫抗性方面[17-18]。‘大笨籽’‘泰山红’‘突尼斯’基因组密码的成功破译,高质量基因组图谱的成功构建,为进一步系统开展石榴分子生物学和遗传改良奠定了研究基础[16,19-20]。本研究从石榴全基因组中共鉴定到7个CBF 基因家族成员,基于生物信息学方法对PgCBFs基因家族成员氨基酸保守序列、染色体定位、理化性质、进化关系、外显子/内含子排列、蛋白质二级与三级结构、共线性关系、GO 注释、启动子顺势作用元件和表达模式等方面进行综合分析,为进一步探索石榴CBF家族基因功能提供参考和理论依据。
1 材料与方法
1.1 试验材料与处理
‘突尼斯’软籽石榴(Punica granatumL.‘Tunisia’)扦插苗种植于淮北师范大学园艺实验基地温室内,温度控制在26°C 左右,湿度为60%~70%,光照时间为白天14 h,夜间10 h,栽培基质为泥炭土、珍珠岩和蛭石(体积比为3∶1∶2),低温处理前每5 d浇水1次;采用上口径和高分别为28 cm 与30 cm 的种植盆进行栽种,每盆栽3株,每5盆为1次重复。试验所采用的石榴幼苗均生长稳定且长势一致,无病虫害。低温处理时将石榴幼苗与种植盆共同放置于低温冷藏柜中,处理温度为-4℃,分别在处理后0、1、3、6、12、24 h收集幼嫩不定根和1 a生枝条韧皮部。每个样品收集时间点均设置3次重复,样品收集后置于液氮处理并储存于-80 ℃低温冰箱,待用。
1.2 石榴CBF基因家族成员鉴定
石榴基因组数据下载自NCBI(https://www.ncbi.nlm.nih.gov/genome/? term=Punica+granatum)[20],拟南芥和水稻基因组数据分别来源于TAIR(http://www.arabidopsis.org)和RGAP(http://rice.uga.edu/)。使用7个拟南芥(Arabidopsis thaliana)和10 个水稻(Oryza sativa)CBF 蛋白序列通过本地Blast初步鉴定石榴CBF 候选基因(E<1.00E-10)。在Pfam 数 据 库(http://pfam.xfam.org/)中 下 载AP2结构域(PF00847)种子文件,通过HMMER 3.1软件鉴定含有AP2结构域的候选基因家族成员(E<1.00E-10)。提取Blast与HMMER 相同候选基因蛋白序列,利用SMART(http://smart.emblheidelberg.de)数据库和Clustal W2(https://www.ebi.ac.uk/Tools/msa/clustalo/)分析候选PgCBFs蛋白质保守结构域与CBF基因家族特征序列,确定石榴CBF 基因家族成员。
根据基因组注释文件,通过TBtools软件对PgCBF基因家族成员进行染色体定位绘图[21],并根据染色体定位信息对PgCBF 成员命名。PgCBF基因家族成员m RNA 和CDS 数据均来自于基因组注释信息。通过Ex Pasy 在线网站(http://www.expasy.org/tools/)分析各成员的蛋白质长度、分子量和理论等电点。利用在线工具BUSCA(http://busca.biocomp.unibo.it/)对7个PgCBF成员亚细胞定位进行预测。
1.3 系统进化树构建
除石榴7个PgCBF基因家族成员外,收集拟南芥(A.thaliana)、水稻(O.sativa)、大豆(Glycine max)、番 茄(Solanum lycopersicum)、桃(Prunus persica)、苹果(M.domestica)以及茶树(C.sinensis)等7个物种的49个CBF 基因家族氨基酸序列,通过MEGA X 软件构建进化树。设定条件为:最优替代模型使用JTT+ G,构建方法使用最大似然法(Maximum Likelihood method,ML),Bootstrap设置为1 000重复。
1.4 石榴PgCBF基因结构、保守基序和蛋白质二级及三级结构分析
根据7个物种的GFF3文件,提取50个CBF基因家族成员的基因序列、外显子、内含子以及上下游非翻译区长度与排布信息。通过Motif Elicitation(http://meme-suite.org/tools/meme)分析CBF基因家族成员的保守基序类型,设置鉴定到MEME 数量为10 个。利用TBtools工具对CBF基因家族系统进化树、基因结构和保守基序进行可视化[21]。分别利用NPS@:SOPMA(https://www.predictprotein.org/signin)和Ex-PaSy Swiss-Model(http://swissmodel.expasy.org)预测PgCBF基因家族成员蛋白质二级和三级结构。
1.5 CBF基因家族成员共线性分析
苹果(M.domestica)和桃(P.persica)基因组数据下载自GDR(https://www.rosaceae.org/)。使用MCScan X 软件对4 个物种的基因组序列进行比对,获得它们的CBF基因家族共线性关系,使用TBtools绘制基因共线性结果[21]。
1.6 PgCBF基因家族成员GO 注释分析
将石榴蛋白序列数据比对到Swiss-Prot数据库,利用TBtools 进行蛋白序列GO 注释分析[21]。
1.7 石榴PgCBFs基因家族启动子区顺式作用元件分析
使用TBtools提取PgCBF 基因家族各成员起始密码子(ATP)上游2 000 bp的碱基序列作为启动子区域,利用plantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行顺式作用元件分析。通过TBtools构建热图呈现顺势作用元件分析结果[21]。
1.8 石榴PgCBFs基因家族转录表达分析
分别选取石榴根、叶片、花、内种皮、外种皮和果皮转录组数据,分析石榴PgCBF基因家族在不同组织中的表达模式。石榴转录组数据下载自NCBI SRA 数据库(No.SRP100581)[19]。下载获取转录组后,使用TBtools转录组数据分析系列功能,通过FastQC进行质控,利用Trimmomatic去除接头,使用Kallisto对基因表达分析,通过TBtools绘制基因表达热图[21]。
1.9 RNA提取与石榴PgCBFs表达分析
使用RNA 提取试剂盒(TIANGEN,China)提取石榴根和枝条韧皮部总RNA,去除基因组DNA 后,合成cDNA,并使用DEPC水稀释10倍用做qRT-PCR 模 板。QRT-PCR 使 用20μL 反应体系,包含1μL cDNA 模板、0.5μL上和下游引物、10μL SYBR 预混液(cham Q SYBR qPCR Master Mix,Vazyme,China)以及8μL DEPC水。使用ABI 7300进行qRT-PCR 反应,设定程序为:95 ℃5 min预变性;95 ℃5 s,60 ℃35 s,40个循环。基因表达量使用Pg Actin作为内参基因,通过2-ΔΔCT方法计算相对表达量[22]。本研究使用的引物信息见表1。
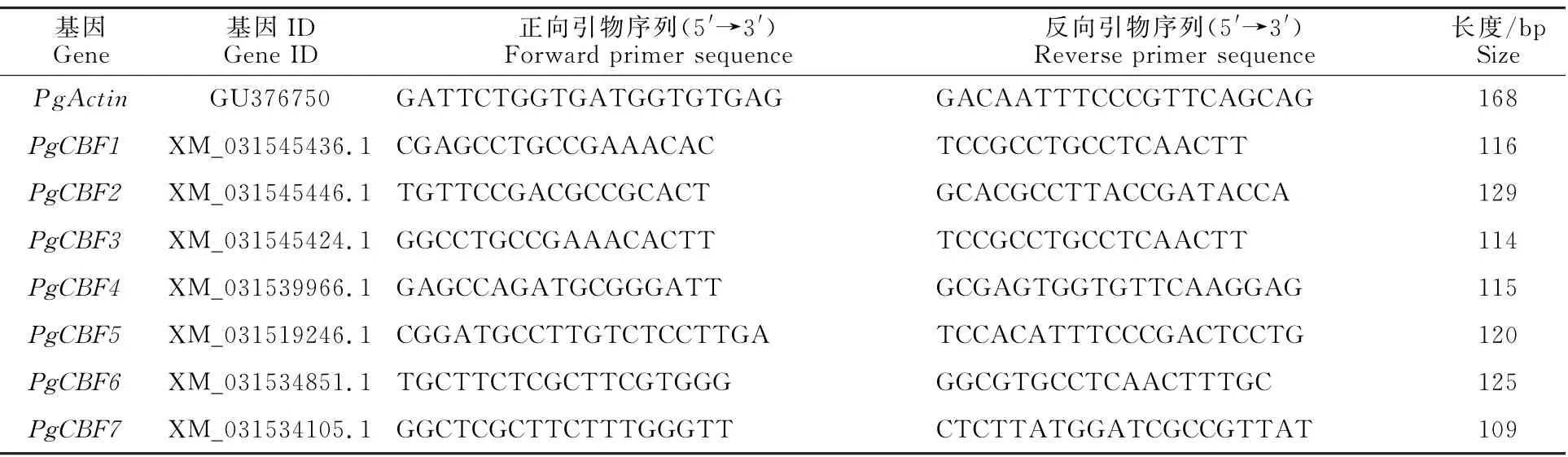
表1 石榴PgCBF基因qRT-PCR 引物Table 1 Primers used for qPCR assay of PgCBF genes in pomegranate
2 结果与分析
2.1 石榴CBF基因家族成员鉴定与染色体定位分析
利用17个拟南芥和水稻CBF蛋白序列通过Blast以及HMM 方法,去除冗余序列后,在石榴基因组中鉴定到7 个CBF 候选基因家族成员。通过多序列比对(图1),7个PgCBF 成员与拟南芥和水稻CBF 基因家族成员类似,除AP2结构域外,也包含有2个保守氨基酸序列(PKK/RPAGRx KFxETRHP和DSAWR),分别位于AP2结构域上下游,表明鉴定到7个PgCBFs为石榴CBF基因家族成员。

图1 拟南芥、水稻、石榴CBF家族基因蛋白质多序列比对Fig.1 Multiple alignment of CBF protein from A.thaliana,O.sativa and P.granatum
根据PgCBF基因家族成员的染色体位置信息将它们命名为PgCBF1~PgCBF7(图2-A)。7个成员分布在2 条染色体上,PgCBF1~PgCBF5集中分布在1号染色体下部,聚集在一起形成基因簇(图2-B),PgCBF6和PgCBF7分别位于4号染色体的上部和下部。

图2 石榴7个CBF基因染色体分布Fig.2 Distribution of seven CBF genes in pomegranate chromosome
2.2 石榴CBF基因家族成员序列理化性质分析
如表2 所示,除PgCBF1和PgCBF3外,其余5个PgCBF m RNA 片段大小各不相同,长度约为1 119~2 763 bp。PgCBF1、PgCBF3和PgCBF5编码区(714 bp)和蛋白质(238 aa)长度一致,蛋白质分子质量(MW)大小相近,PgCBF7与它们相似。7个成员理论等电点(pI)为4.89~5.60;亚细胞定位预测与转录因子蛋白功能定位一致,均处于细胞核内。

表2 PgCBF基因家族成员理化性质分析Table 2 Analysis of physical and chemical properties of family members of PgCBF gene family
2.3 CBF基因家族进化树构建
使用石榴等8个物种的56个CBF基因家族氨基酸序列构建进化树。将CBF 基因家族分为4个亚组,分别包含9、8、19和20个成员(图3)。水稻除OsCBF2 外,其他9 个成员全部位于GroupⅠ,表明GroupⅠ中的CBF成员在单子叶植物中可能有独特的作用[23]。与其他研究结果一致,拟南芥6 个成员分布于Group Ⅲ和Ⅳ中[23],PgCBF2、PgCBF4~PgCBF6与At-DREB1F和AtDREB1E具有较近的亲缘关系,PgCBF7与AtCBF1~AtCBF4、MdCBF1、PpCBF6、SlCBF1、CsCBF3等 均 归 属 于GroupⅢ。PgCBF1和PgCBF3具有较近亲缘关系,均归属于Group Ⅱ。
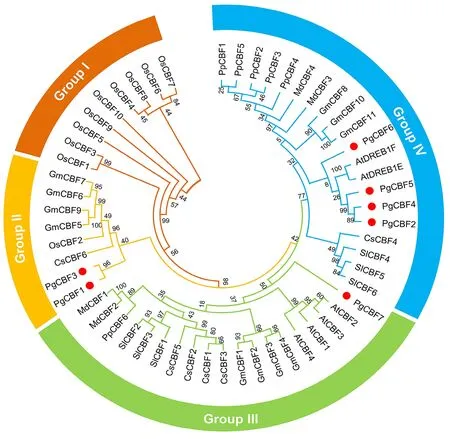
图3 石榴与拟南芥、水稻、大豆、番茄、桃、苹果及茶树CBF基因家族进化树分析Fig.3 Phylogenetic tree analysis of CBF gene family from pomegranate(Pg),Arabidopsis(At),rice(Os),soybean(Gm),tomato(Sl),peach(Pp),apple(Md)and tea(Cs)
2.4 CBF家族基因结构、保守基序及结构域分析
为进一步分析CBF基因家族进化关系,综合分析包括PgCBF 在内的50个CBF 基因结构和保守基序(图4)。通过基因组GFF 注释文件对CBF基因家族CDS分布以及外显子和内含子统计分析,结果显示大部分CBF成员基因结构相似仅有1个外显子,不包含内含子,为内含子缺失型(图4-A)。仅有少部分成员含有1~2个内含子,如:At DERB1E、PgCBF2、PgCBF4和PgCBF5。
通过MEME在线工具预测CBF基因家族成员的10个保守基序(图4-B),各保守基序的氨基酸长度为11~25 aa(表3)。除了少部分成员外,大多数CBF蛋白含有motif 1~7,且在不同CBF亚组中排列较为一致(图4-B),表明这些motif在CBF家族成员高度保守。除与其他物种CBF成员基本一致的motif组合与排列顺序外,7个PgCBF成员中有6个成员含有motif 9(图4-B)。

表3 石榴和其他6个物种CBF蛋白保守基序分析Table 3 Analysis of conserved motif of CBF protein in pomegranate with other six species
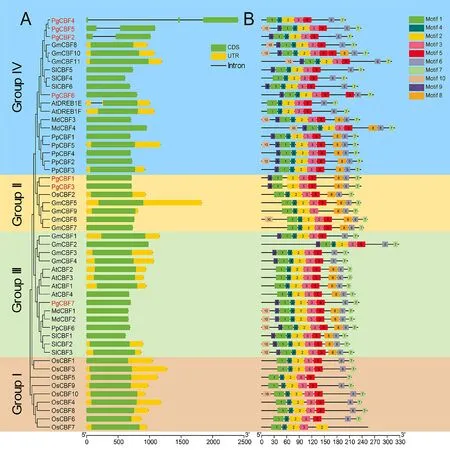
图4 CBF基因家族基因结构和保守基序分析Fig.4 Analysis of gene structure and conserved motif elements of CBF gene family
2.5 石榴CBF家族基因蛋白质二级和三级结构预测
对7个石榴CBF 基因家族成员蛋白二级结构预测发现该家族包含α-螺旋、延伸链、β-转角和不规则卷曲(表4)。在7个编码蛋白中主要是α-螺旋(22.56% ~34.50%)和不规则卷曲(44.50%~59.02%),延伸链(9.05%~15.79%)和β-转角(0.42%~5.50%)较少。
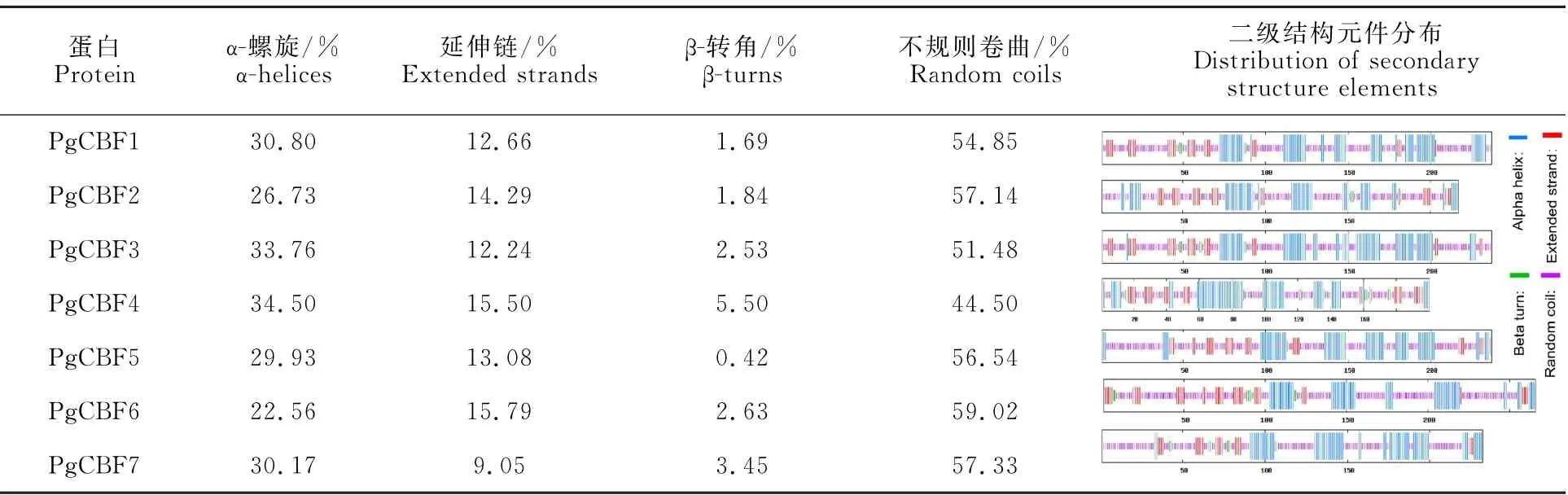
表4 石榴CBF基因家族蛋白二级结构分析Table 4 Secondary structure of protein sequence of CBF gene family in pomegranate
7个石榴CBF 基因家族成员蛋白三级结构与模型5wx9.1.A 较为相似(42.65%~46.58%)(图5),且7个PgCBFs蛋白的三级结构较为相似,均由1个α-螺旋和2个β-折叠构成。

图5 7个石榴CBF基因家族蛋白三级结构预测Fig.5 Tertiary structure of seven CBF proteins in pomegranate
2.6 石榴PgCBF基因共线性分析
如图6所示,在石榴PgCBF家族间存在1个串联复制基因对(PgCBF4/PgCBF5)。并鉴定到石榴共与拟南芥、苹果和桃的10个CBF 基因家族成员存在共线性关系。其中,PgCBF1分别与AtDREB1F、MdCBF4、MdCBF3和PpCBF1具有共线性关系;PgCBF2与At DREB1E具有共线性关系;PgCBF4与PpCBF3具有共线性关系;PgCBF6与MdCBF3以及PpCBF1具有共线性 关 系;PgCBF 7与MdCBF 1、MdCBF 2和PpCBF6具有共线性关系。
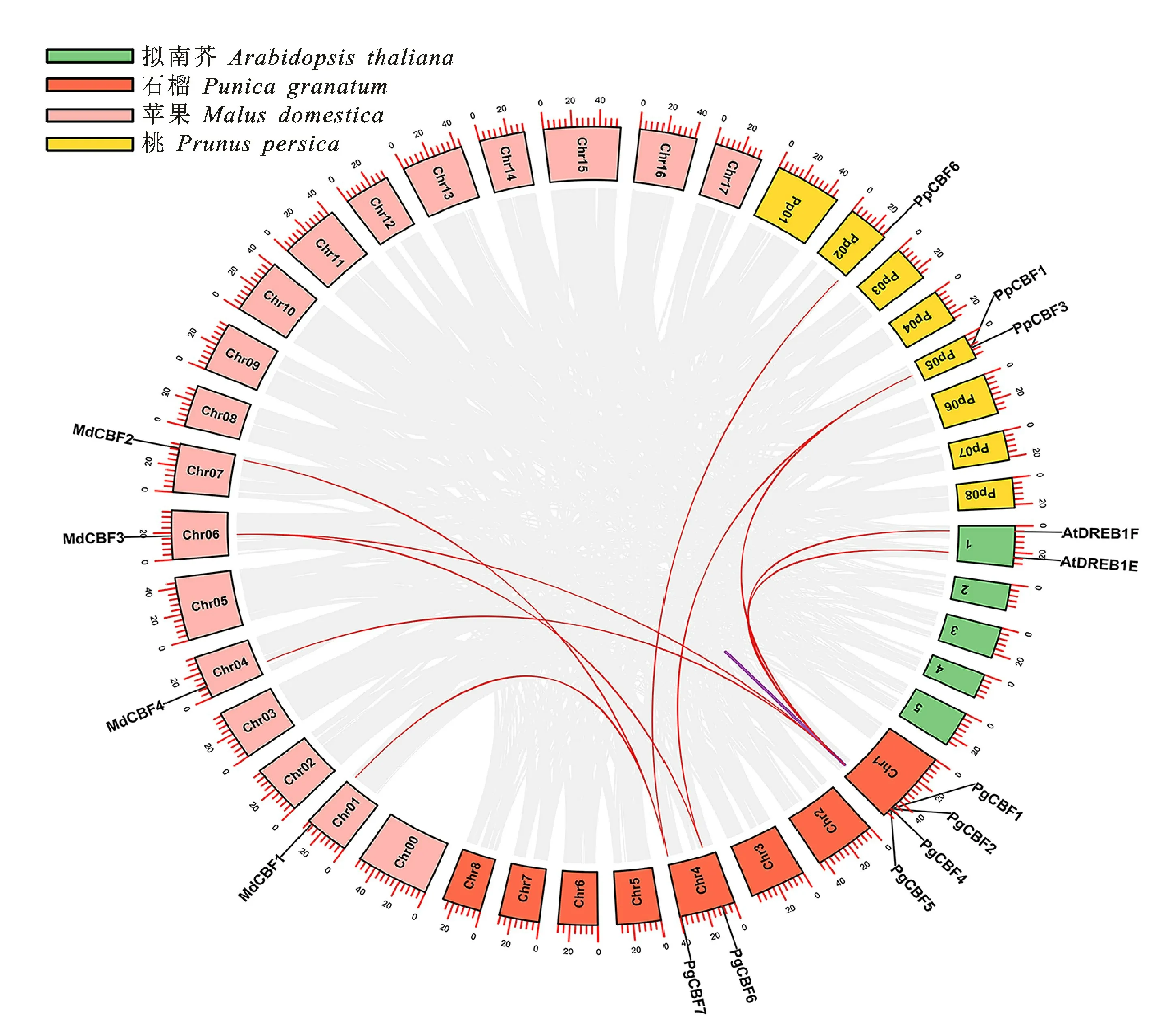
图6 石榴、拟南芥、苹果和桃的CBF基因家族共线性分析Fig.6 Synteny analysis of CBF genes family of P.granatum,A.thaliana,M.domestica and P.persica
2.7 石榴PgCBF基因GO 注释
利用GO 注释分析发现7个PgCBF 可被划分在分子功能、细胞组分、生物过程3 个大类的26个亚类中(图7)。分子功能主要涉及顺势作用元件结合与转录调控(10个亚类),细胞组分主要参与细胞核内组分形成(1个亚类),生物过程中涉及冷驯化(GO:0009631)、响应低温、高温与环境胁迫刺激(GO:0050826、GO:0009408、GO:0006950、GO:0050896)、参与赤霉素、ABA 等激素合成与信号转导过程(GO:0009686、GO:0046885、GO:0009738、GO:0071215、GO:0010817、GO:0009737、GO:0009737、GO:0032870)。GO注释表明7个PgCBF参与转录调控与胁迫及植物激素刺激应答,尤其是温度胁迫。
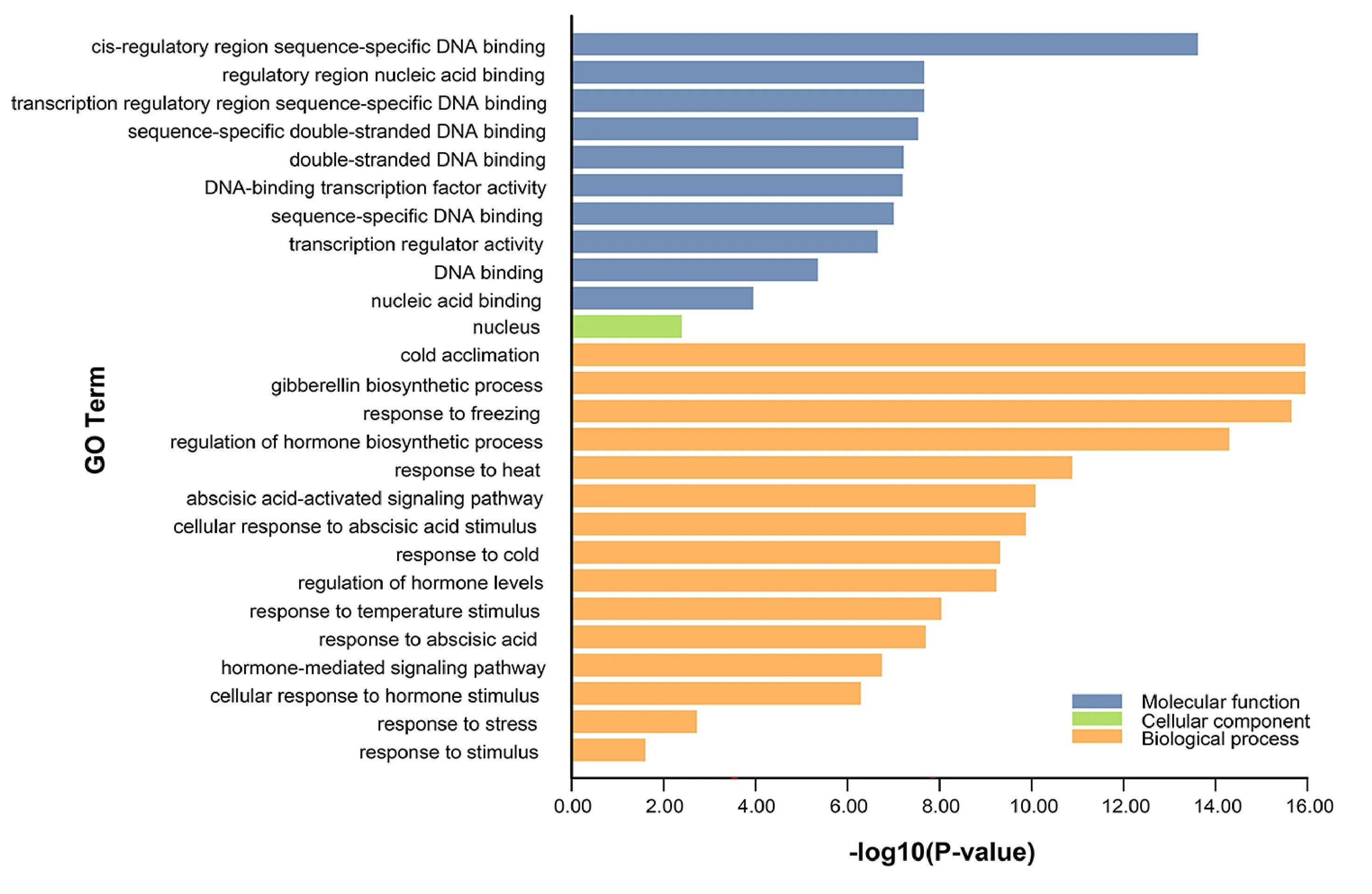
图7 石榴PgCBF基因家族成员GO 注释分析Fig.7 Information from gene ontology(GO)annotation of PgCBFs
2.8 石榴PgCBF家族基因顺式作用元件分析
位于上游启动子区的顺势作用元件是植物内部信号和胁迫刺激响应的重要调控区域。对7个石榴CBF基因家族起始密码子上游2 kb碱基序列进行分析。鉴定到一系列与胁迫相关(低温、干旱、厌氧)、激素相关(ABA、MeJA、GA、SA、生长素)以及光诱导相关顺势作用元件(图8)。在胁迫诱导的启动子元件中,除PgCBF6外,6个成员含有16个厌氧诱导元件ARE;有5 成员含有6个低温应答元件LTR;4个成员含有7个干旱诱导元件MBS。在激素响应元件中,在7个成员中鉴定到36个ABA 响应元件ABRE,40个MeJA应答元件CGTCA-motif和TGACG-motif,2 个GA 应答元件P-box,7 个生长素应答元件Aux RR-core、TGA-element、TGA-box,5 个SA应答元件TCA-element。在PgCBF 启动子区还存在大量光诱导元件,其中G-box 元件最多,共在7个成员共鉴定到40个。结果表明PgCBF参与响应石榴胁迫应答、激素和光诱导。
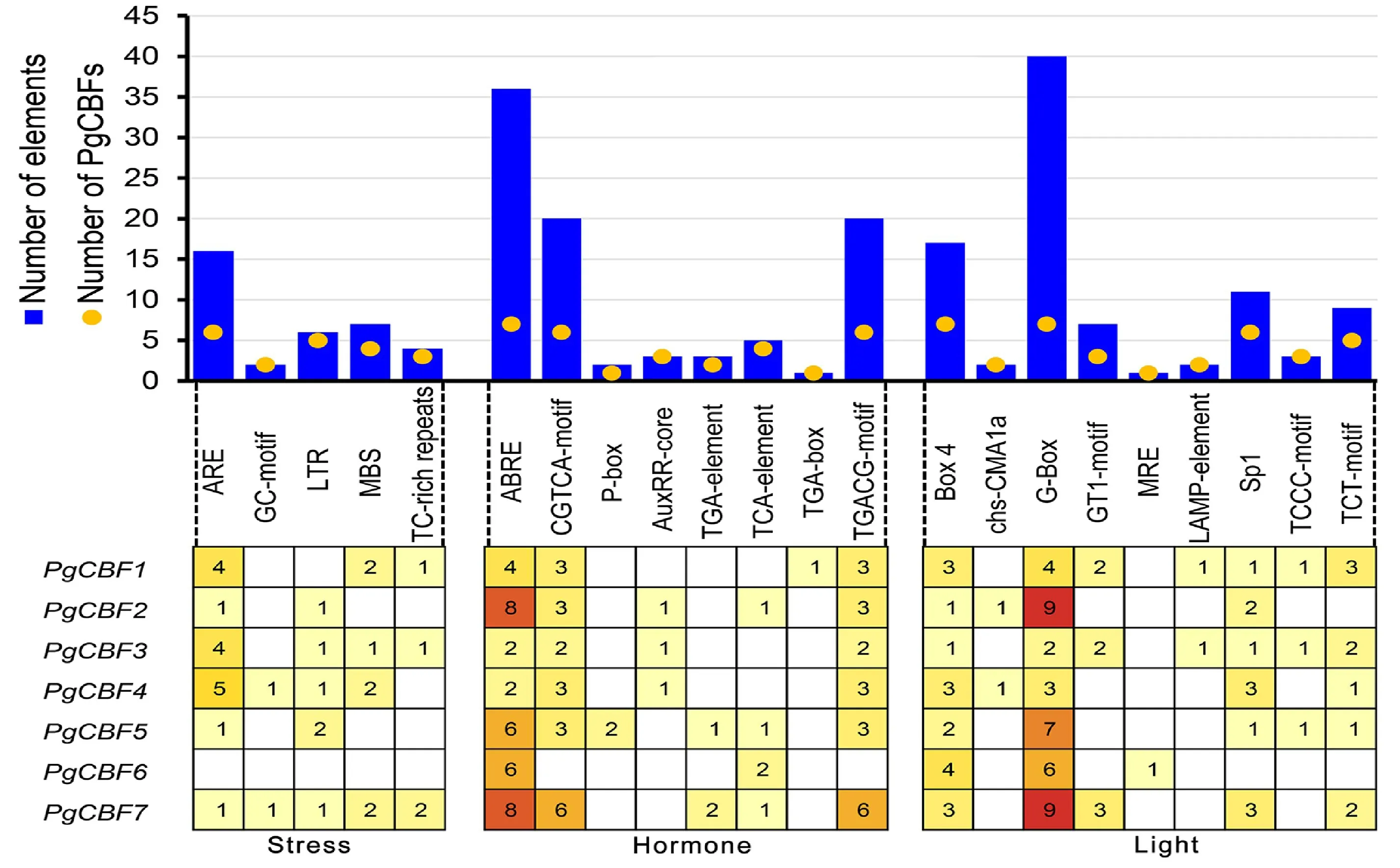
图8 石榴CBF基因家族启动子顺式作用元件分析Fig.8 Analysis of putative cis-regulatory elements in promoter regions of CBF genes family in pomegranate
2.9 石榴PgCBF家族基因表达分析
通过石榴转录组数据[19],在石榴根、叶片、花和果实不同组织中对7个PgCBF 成员的表达模式进行分析(图9)。结果显示,除PgCBF6外,其余6个基因在根中显著表达,其中PgCBF5的表达量最高。PgCBF2和PgCBF5在花和果皮中表达显著高于其余成员。PgCBF6仅在果皮中有显著表达。与其他成员相比,PgCBF7在果实内种皮和外种皮中表达上调。但所有PgCBFs在叶片中只有痕量表达或不表达。结果表明PgCBF 成员在不同组织中发挥功能存在差异。
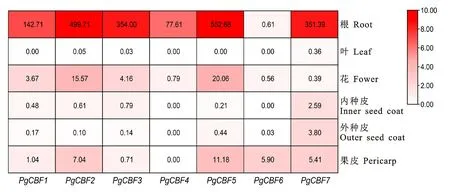
图9 PgCBFs在石榴不同组织中的表达热图Fig.9 Heatmap of expression level of PgCBFs in different tissues of pomegranate
在低温处理后的石榴根和枝条韧皮部中PgCBF基因家族成员表达量均显著上调,但存在差异(图10)。在根中,PgCBF1、PgCBF2、PgCBF4和PgCBF5在低温处理后0~6 h表达量逐步升高并达到最大值,其中PgCBF2、PgCBF4和PgCBF5在6 h表达量均为0 h的10倍以上,而PgCBF1仅为0 h的2.2倍。在枝条韧 皮 部,PgCBF2、PgCBF3、PgCBF4和PgCBF5表达量均在处理后6 h 达到最高峰。PgCBF6在根和韧皮部表达趋势一致,在处理24 h后达到最大值。PgCBF7在低温处理1 h后表达量显著升高并达到最大值,分别较0 h根和韧皮部升高35.3和23.3倍。在低温处理12至24 h后,PgCBF7在根和韧皮部中仍显著上调,上调8.3~13.0倍,表明PgCBF7能够快速响应低温诱导并持续应答低温胁迫。

图10 低温处理后PgCBF在石榴根和枝条韧皮部中的相对表达量Fig.10 Relative expression of PgCBF in pomegranate roots and phloem under low temperature treatment
3 讨论
低温是制约植物生长发育的一个主要非生物胁迫因子。植物遭受冷胁迫时,约有12%的转录组基因参与CBF转录因子转录表达调控过程,以增强植物耐寒能力[24]。随着植物全基因组测序、组装和注释研究的进一步发展,通过比较基因组方法在不同的植物物种中识别和鉴定到越来越多的CBF基因家族。通过分析发现CBF是一个小的基因家族,如在拟南芥(A.thaliana)、水稻(O.sativa)、油 菜(B.rapa)、大 豆(G.max)、苹 果(M.domestica)、桃(P.persica)、梨(Pyrus bretschneideri)、葡萄(Vitis vinifera)[23]、鹅掌楸(Liriodendron chinense)[25]和茶树(C.sinensis)[14]中分别鉴定到6、10、9、11、4、6、11、4、14和6个CBF成员。同样的,本研究共在石榴全基因组中仅鉴定到7个CBF基因家族成员(表2),包含1个串联复制基因对(PgCBF4/PgCBF5)(图6),但在染色体间未鉴定到片段重复(图6),这可能是CBF家族成员较少的一个原因。鉴定到的7个PgCBF蛋白序列中均含有由59个氨基酸残基组成的高度保守AP2结构域和2个特征序列(图1),其中位于N 端的特征序列内的PKK/RPAGRx KF属于细胞核定位信号(nuclear localization signal,NLS)序列,表明PgCBF 定位在细胞核 内(表2),与 棉 花 GhDREB1[26]、茄 子Sm CBF[27]、茶树CsCBF[14]亚细胞定位分析结果一致。
构建系统进化树有利于分析基因家族成员蛋白质结构与功能。与其他双子叶植物CBF 成员分布一致(图3)[23],PgCBF成员分布在GroupⅡ~Ⅳ。在石榴中,PgCBF2、PgCBF4、PgCBF5、PgCBF6与At DREB1F、At DREB1E共 同 归 属于Group Ⅳ,且均含有ABRE 顺势作用元件(图8),推测它们可能参与ABA 信号转导或胁迫应答过程(图7)。在Group Ⅲ中多数成员能够显著响应低温胁迫,如:苹果MdCBF1转基因至拟南芥能够显著诱导AtCOR15a、AtRD29A和At RD29B表达,低温胁迫抗性明显增强[12];PpCBF6在桃遭遇低温胁迫时表达量显著升高,能够结合至Pp VIN2启动子区抑制其表达,降低液泡转化酶(vacuolar invertase,VIN)活性,提高蔗糖含量,从而缓解低温对果实的伤害[28];在低温胁迫条件下,番茄slcbf1突变体更易遭受低温胁迫伤害,电导率和丙二醛含量明显升高[29];茶树CsCBF3在拟南芥中过表达后,能够显著诱导AtCOR15a和At RD29A表达上调,明显改善了转基因植株在-4 ℃和-8 ℃的生长状态[14]。在石 榴 中,PgCBF7与MdCBF1、MdCBF2、PpCBF6均归属Group Ⅲ,并与它们存在共线性关系(图6),GO 注释(图7)、LTR 顺序作用元件(图8)以及基因表达分析(图10)等结果表明PgCBF7能够直接并快速响应低温胁迫,其可能在低温胁迫中发挥重要功能,但具体分子机制还需进一步研究说明。
PgCBF基因家族成员与已鉴定到的大部分CBF基因家族成员平均蛋白质长度、分子质量均值类似[14-15]。同时,不同基因亚组在基因结构和motif组成与排列上并没有明显的区分(图4),PgCBF蛋白二级和三级结构类似(表4,图5),表明CBF基因家族在进化过程中相对保守[13]。
一些转录因子已被证实能够结合至CBF 启动子区参与其表达调控,如ICE1/2、CAMTA1-3、PIF4/7、EIN3、MYB15 等[15]。在石榴PgCBF启动子区鉴定到大量胁迫应答、激素响应与光诱导元件(图8)。虽然PgCBF1和PgCBF6启动子区并未鉴定到LTR 元件,但在低温处理诱导后显著诱导表达量上升(图10),表明在石榴中可能存在不依赖LTR 元件调控CBF表达途径。如研究指出,PIF4/7与CBF1和CBF2基因启动子中的G-box结合后能够在长日照条件下抑制CBF1和CBF2表达,而在短日照条件这种抑制可被解除,从而导致CBF表达上调,增加耐寒性[30]。此外,CBF还参与植物激素信号转导。如外源Me-JA 处理能够显著诱导苹果愈伤组织中Md-CBF1、MdCBF2、MdCBF3表达,增强愈伤组织低温抗性[31]。在敲除番茄slcbf1后,吲哚乙酸的含量明显增加,但MeJA、ABA 和玉米素核苷的含量减少[29]。需要注意的是,虽然在7个启动子中共鉴定到36个ABRE元件(图8),但研究发现ABA可直接结合至COR基因启动子区的ABRE元件,而提高植物耐寒性并不依赖CBF 途径[32];然而,目前仍然缺少ABA与CBF基因表达调控相关报道,但可能存在某些机制,它可以通过与其启动子结合来调节CBF表达[33]。仍需要进一步研究以阐明ABA和CBF基因之间的复杂调节关系。
本研究共在石榴基因组中鉴定到7 个CBF基因家族成员,它们的蛋白质序列与结构相对保守;通过GO 注释与顺式作用元件分析,发现PgCBF基因家族与石榴激素和胁迫响应紧密相关,尤其在低温条件下各基因表达均明显上调,特别是PgCBF7能够快速响应低温诱导并持续高表达,表明PgCBF7可能在石榴幼苗低温胁迫应答中发挥重要调控功能。

