西洋参枯萎病病原分离与鉴定
赵璟琛,伏松平,胡加怡,田小曼,王 强,商文静
(1.西北农林科技大学 植物保护学院,农业农村部黄土高原作物有害生物综合治理重点实验室,陕西杨凌 712100;2.天水市植保植检站,甘肃天水 741020;3.福建农林大学 植物保护学院,福州 350002;4.杨凌职业技术学院,陕西杨凌 712100)
西洋参(Panax quinquefoliusL.),又名花旗参、美国人参,为五加科人参属多年生草本植物,其根、茎、叶和果实均可入药,是2015版中国药典收载植物种质,并于2021年进入药食同源的名贵作物序列试点[1]。西洋参具有抗肿瘤、降血糖血脂、抗疲劳和提高免疫力等多种药理活性,有极高的药用和保健价值,被誉为“绿色黄金”[2]。西洋参原产于北美洲加拿大和美国的五大湖地区,1980年在中国东北、华北、西北、华南、西南等地引种成功后,国内西洋参产业不断壮大,并逐渐形成吉林省抚松县、山东省文登市和陕西省留坝县三大主要西洋参优势栽培区,特别是留坝西洋参被誉为“最接近原产地品质”产品[1,3-6]。
2020-2021年,在对陕西省留坝县和太白县西洋参病害的常规调查中发现,部分地块西洋参植株地上部生长势衰弱,叶片逐渐由外向内褪绿变黄萎蔫,茎秆瘦弱黄化,参根表皮无明显病变,但解剖后维管束变黄,根据田间症状表现高度怀疑为一种新型土传西洋参病害,严重地块发病株率达60%。西洋参生产和加工是留坝县支柱产业,也是当地农户脱贫致富的主要途径,基于土传病害对西洋参产量和品质的潜在威胁,加之土传病害亦是引起西洋参连作障碍的主要原因,故准确鉴定该病病原种类、明确田间发生特点和规律,对预防和消减西洋参连作障碍具有重要意义。为此,笔者及其研究团队对该病害进行系统调查探究,以期为该病害的田间诊断和防治提供参考。现将主要结果报道如下。
1 材料与方法
1.1 标本采集
2020年7月至2021年10月,多次对陕西省留坝县、太白县西洋参种植区发病地块进行调查,记录发病情况。采集具典型症状植株标本,记录采样时间、地点等信息并编号,带回实验室,4 ℃保藏供试。
1.2 病原菌的分离与纯化
采用常规组织分离法进行病原菌分离与纯化[7]。流水冲洗去除标本表面灰尘和泥土,用灭菌滤纸吸干表面残留的水分,室温下阴干。切取5 mm×5 mm 的发病组织块,75%乙醇溶液消毒45 s,无菌水漂洗1 min共3次,无菌滤纸吸干组织块表面水分,放入PDA 培养基(含链霉素50 μg/m L)上,倒置于25 ℃黑暗培养。待组织块边缘有菌落长出,挑取菌落边缘菌丝,接种于新的PDA 培养基平板上进行纯化。单孢纯化后的病原菌培养物保存于-20 ℃,备用。
1.3 形态学鉴定
将供试病原菌纯培养物制作为常规水装片,显微镜下观察鉴定供试菌的属、种,测量孢子形态及大小,并记录菌落形态、颜色、繁殖体形态等。挑取直径5 mm 的供试菌株单孢培养物菌饼置于PDA 平板上,25 ℃黑暗培养5 d后观察病原菌的培养性状,采用十字交叉法测定菌落直径,试验重复3次。
1.4 分子生物学鉴定
取100μL 单孢纯化后的供试分离菌孢子悬浮液涂布于铺有玻璃纸的PDA 培养基上,25 ℃培养7 d 后收集菌丝,采用CTAB 法提取菌株DNA,经Nanodrop 2000检测合格后,于-20 ℃下保存,备用。
参考Fan等[8]方法对代表菌株YL002基因组DNA 进行PCR 扩增,引物采用内部转录区间隔区r DNA-ITS基因、翻译延伸因子TEF1-α基因和RNA 聚合酶最大亚基RPB1基因引物(表1)。PCR 扩 增25 μL,反 应 体 系 为:引 物(10 μmol/L)各0.5μL,10×TransTaq-T Buffer 2.5μL,2.5 mmol/L d NTPs 2μL,TransTaq-TDNApolymerase 0.25 μL,模 板 DNA (50 ng/μL)1μL,dd H2O 18.25μL。PCR 扩增程序为:94 ℃预变性5 min;94℃变性1 min,55 ℃退火1 min(r DNA-ITS与RPB1),72 ℃延伸1.5 min,35个循环;72 ℃延伸8 min,4 ℃保存,其中TEF1-α基因PCR 扩增程序的退火温度为56 ℃,其余扩增条件相同。PCR 产物用1.5%的琼脂糖凝胶电泳检测,回收纯化后送至北京擎科生物技术有限公司西安分公司测序。

表1 供试病原鉴定所用PCR 引物Table 1 PCR primers for pathogenic identification of Fusarium wilt
对测序结果在NCBI的BLAST 中进行同源性比对分析。利用MEGA-X 软件通过最大似然法(Maximum Likelihood)构建多基因系统发育树,同时对构建的系统树作自展检验(Bootstrap test)以获得分支的支持率,自展检验中重复抽样次数为1 000 次。以大丽轮枝菌(Verticillium dahliae)作为外群参考序列。
1.5 回接试验与致病菌的再分离
回接植物材料为两年生且长势一致的健康西洋参植株。将供试代表性菌株YL002制备成浓度为1.0×106个/m L的孢子悬浮液,分别采用灌根法和伤根法进行回接试验,具体方法参考Lai等[11]略有改动,无菌水接种处理为空白对照,每组处理重复3次。接种后的供试植株置于23±5 ℃的温室中培养,光周期为14 h,50 d后观察记录植株发病情况。采用常规组织分离法对回接发病的植株及参根进行再分离,将再分离得到的菌株在PDA 培养基上进行纯化,并与原接种菌进行形态学比较。
2 结果与分析
2.1 西洋参枯萎病田间发生情况及症状
2020-2021年,对陕西省留坝县和太白县西洋参主要种植区的西洋参枯萎病发生情况进行调查发现,各主要种植区西洋参枯萎病零星发生,部分地区特别是连作参田发病较为严重,发病率可达30%以上。发病初期受害植株地上部生长势衰弱,植株矮小,叶色淡白,叶缘变黄萎蔫并逐渐向内部扩展,参根瘦弱萎细,无明显腐烂或坏死,参根剖面维管束变黄。发病后期受害植株枯萎,叶片完全褪绿且皱缩卷曲,质地较脆,但不脱落(图1-B),参根皮层坏死,维管束呈棕褐色或黄褐色(图1-D)。

图1 西洋参枯萎病症状Fig.1 Symptoms of Panax quiquefolium wilt
2.2 西洋参枯萎病病原菌形态特征
从发病西洋参根部病健交界处分离到的5个菌株(编号为YL001~YL005),其菌落和形态学特征无明显差异。
代表菌株YL002在PDA 平板上生长良好,培养5 d菌落直径可达68~71 mm,菌落圆形,白色或浅黄色,底部有浅紫色色素形成;菌丝疏松絮状,气生菌丝茂盛发达(图2-A,2-B);分生孢子梗菌丝状,顶生或侧生分生孢子;小型分生孢子无色透明,圆柱形或长椭圆形,0~1 个隔膜,大小为1~2μm ×4~13μm,数量较多(图2-C);大型分生孢子无色透明,呈镰刀形,有2~3个隔膜,大小为3~5μm×12~35μm,数量较少(图2-C)。菌丝老熟后产生厚垣孢子,褐色圆形,表面光滑,直径平均为3.5μm(图2-D)。根据以上形态特征,参考Booth的镰胞菌属分类系统[12],初步将供试菌鉴定为尖孢镰胞菌(Fusarium oxysporum)。
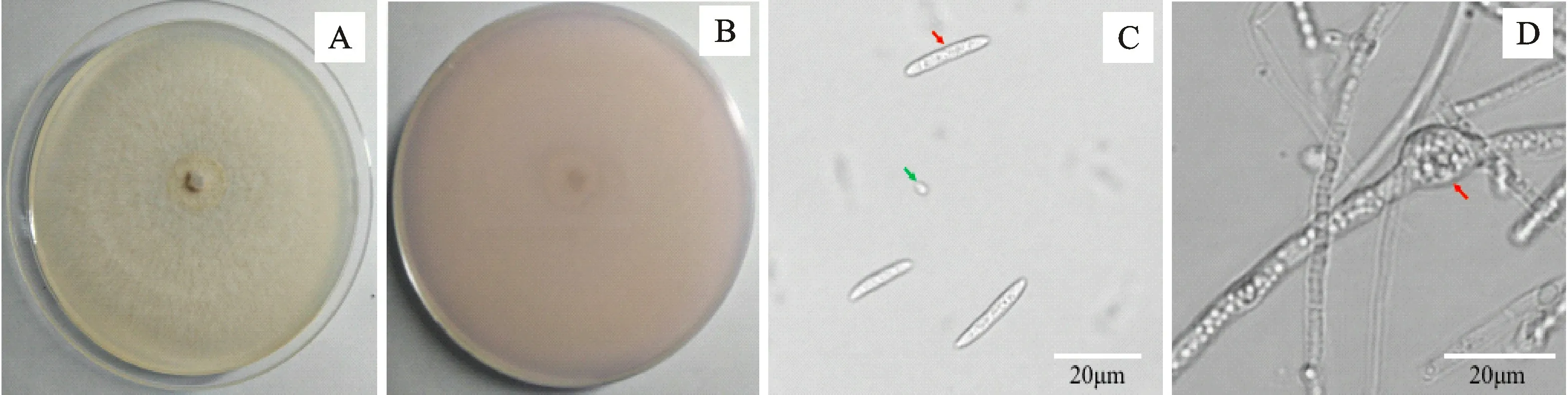
图2 西洋参枯萎病病原菌形态特征Fig.2 Morphological characteristics of isolates from Panax quiquefolium wilt
2.3 西洋参枯萎病病原菌回接
供试菌株YL002回接后,均可产生典型西洋参枯萎病症状,与田间症状基本一致。接种50 d后西洋参植株叶片边缘变黄萎蔫,叶片不脱落,维管束发生褐变,对照组西洋参均未发病。对发病参根进行再分离,分离物与接种菌株有相同的形态学特征,表明供试菌株为西洋参枯萎病的致病病原菌。
2.4 菌株YL002分子生物学鉴定
以供试菌株YL002基因组DNA 为模,使用ITS1/ITS4、EF1/EF2 和Fa/G2R 引 物 分 别 对rDNA-ITS、TEF1-α和RPB1基因进行PCR 扩增,分别得到大小为540、720 和1 600 bp片段。BLAST 比对分析后利用MEGA-X 软件构建多基因系统发育树,结果表明,基于不同扩增引物获得的YL002 序列与尖孢镰刀菌F.oxysporum均在同一发育分支,且序列相似性高达100%(图3)。结合形态学特征、回接结果以及分子生物学鉴定结果,确定引起西洋参枯萎病的病原菌为尖孢镰胞菌F.oxysporum。
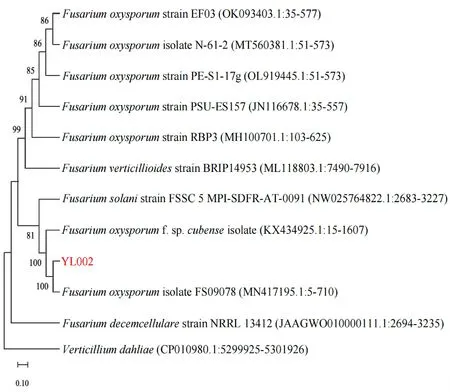
图3 基于供试菌株r DNA-ITS、TEF1-α 及RPB1 序列的多基因系统发育树Fig.3 Phylogenetic tree of YL002 based on rDNA-ITS,TEF1-αand RPB1 sequence
3 讨论
半知菌类镰胞菌属(Fusariumspp.)真菌在西洋参上的危害多有报道,Zamir等[13]发现引起英国哥伦比亚地区西洋参根腐病的4种主要镰胞菌(F.solani、F.oxysporum、F.avenaceum及F.equiseti)中F.solani的致病性最高。随后,Lee[14]对韩国西洋参根腐病植株的根部及其周围土壤中分离得到的115株分离菌株进行鉴定,并发现其中镰刀菌数目最多,且主要为F.solani、F.oxysporum及F.moniliforme。Fan 等[8]首次发现F.redolens亦能引起西洋参根腐病的发生,且该菌在5~40℃的条件下均能生长,对大多数碳源、氮源均可利用,更适宜于在西洋参根际微酸环境下生长,可能成为从西洋参种子层积处理到收获全程潜在病原菌,是引起西洋参连作障碍形成的主要土传病原菌之一。
本研究通过田间症状观察、病原菌分离、柯赫氏法则验证、形态学观察和分子生物学分析,对采自陕西省西洋参主产区表现西洋参枯萎症状的样本进行病原分离与鉴定,结果表明,分离纯化得到的供试菌均可侵染西洋参植株引起枯萎病典型症状,结合形态学特征、真菌r DNA-ITS位点、TEF1-α和RPB1基因序列分析,供试病原菌被鉴定为尖孢镰刀菌F.oxysporum,该病被定名为西洋参枯萎病,为新记录西洋参病害。西洋参枯萎病症状和由同为F.solani引起的西洋参根腐病有较大区别,西洋参枯萎病发病植株地上部分常枯萎凋零但叶片不脱落,地下参根症状也较轻,仅参根皮层出现小面积水渍状病斑,维管束变黄。而西洋参根腐病地上部分症状常表现为植株矮小,叶片枯萎脱落只剩茎秆,地下部参根表皮湿腐,维管束变褐,严重情况下整个参根变黑腐烂消失。
F.oxysporum是一种严重影响植物产量和品质的土传病原真菌,且其寄主范围极为广泛,可引起150多种植物枯萎病和根腐病的发生[15-16]。由于尖孢镰刀菌具有高度的寄主专化性,其致病性也因寄主、环境等的变化发生显著差异,目前,关于F.oxysporum致病性差异研究主要集中在番茄、香蕉和拟南芥等寄主植物上,而豆科作物、十字花科和五加科植物等具有重要经济价值的寄主植物在这方面研究尚少[17],特别是其在侵染引起西洋参枯萎病和根腐病上的致病性差异研究有待深入。

