‘金冠’苹果及优系(SGP-1)果实糖积累与其代谢相关酶活性研究
杨文渊,谢红江,陶 炼,宦云敏,陈善波,林立金,廖明安
(1.四川农业大学 园艺学院,成都 611130;2.四川省农业科学院 园艺研究所,成都 610066;3.农业部西南区域园艺作物生物学与种质创制重点实验室,成都 610066;4.四川省林业科学研究院,成都 610081)
苹果(Malus domesticaBorkh.)是中国主要水果之一,因其营养丰富和良好的口感,深受广大消费者喜爱。苹果果实糖的种类、含量及比例影响果实风味和营养成分,是决定果实品质和商品价值的重要因素[1-4]。研究发现,苹果中可溶性糖主要含果糖、葡萄糖、蔗糖和山梨醇,通常果糖含量最高,占40%以上[5-8],而‘金冠’苹果的果糖含量更高,占60%以上[9]。果实中的糖积累、种类与糖代谢酶的活性变化密切相关[10-12],起主要调控作用的有蔗糖合成酶(SS)、酸性转化酶(AI)、中性转化酶(NI)、蔗糖磷酸合成酶(SPS)、山梨醇脱氢酶(SDH)[13-15]。作为苹果碳水化合物主要运输形式的山梨醇,经韧皮部卸载,在果实中被山梨醇脱氢酶(SDH)和山梨醇氧化酶(SOX)迅速转化成果糖和葡萄糖,参与果实的生长发育和品质形成[2,16-17]。而蔗糖是苹果果实中糖卸载的另一种重要形式,并在品质形成有关的代谢中起着重要作用[1,2,16]。但对西南冷凉高原苹果果实生长发育期间糖积累及代谢相关酶活性的变化规律,尤其与代谢有关酶的关系尚缺乏研究。
多年田间观测发现,西南冷凉高原产区‘金冠’苹果变异优系(SGP-1)果实口感纯甜,风味极佳,为进一步探讨‘SGP-1’果实糖代谢机理,以‘金冠’苹果及其优系(SGP-1)为材料,通过测定果实生长发育期间糖组分、含量及糖代谢相关酶活性,分析主要糖含量变化规律及其与糖代谢相关酶活性的关系,明确可溶性糖积累的关键时期和关键酶,探讨‘金冠’苹果和‘SGP-1’果实生长发育期间可溶性糖积累的生理差异,为深入研究其果实糖代谢的分子机制奠定基础,也为苹果果实增糖降酸提供理论依据。
1 材料与方法
1.1 材料
供试材料为四川省阿坝州苹果园‘金冠’苹果及优系(SGP-1)的果实。选取生长势基本一致的3株苹果树进行样品采集,树龄8 a,株行距3 m×4 m,栽培管理水平中等。在花后7 d开始采集样品,每20 d取1 次样品,直至果实达到生理成熟(花后160 d左右),共取9次样品。幼果期至成熟期果实大小差异较大,因此每次取果量应根据果实大小而定。样品前处理:果实带皮去心切碎,迅速用液氮冷冻(-196 ℃)后混匀,分2 份置于超低温冰箱(-80 ℃),备用,一份用于检测糖组分及含量,另一份用于分析酶活性。
1.2 方法
1.2.1 果实中糖组分提取与测定 果糖、葡萄糖、蔗糖和山梨醇含量均采用高效液相色谱法(HPLC)测定,果实中糖组分提取和测定参照陈美霞[18]和张丽丽等[19]的方法并略加改进。称取液氮研磨成粉的果实1 g左右(计重),加入4 m L超纯水,摇匀,在80 ℃水浴提取15 min,8 500 r·min-1离心10 min,残渣中再加入4 m L 超纯水再次提取,合并上清液并定容到10 m L,经0.45μm 滤膜过滤,待测。
色谱条件:色谱柱为Thermo(4.6 mm×250 mm)NH2柱,检测器:RID,以乙腈∶水=80∶20为流动相,流速为0.8 m L·min-1,柱温35℃,进样量10μL。可溶性糖含量为各糖组分相加之和。
糖组分标曲的制作:糖标样均购自Sigma 公司。分别称取果糖50 mg、葡萄糖50 mg、蔗糖20 mg、山梨醇20 mg溶解于5 m L 超纯水,制成混标原液。 各糖质量浓度分别为果糖10 mg·m L-1,葡萄糖10 mg·m L-1,山梨醇4 mg·m L-1,蔗糖4 mg·m L-1。将混标分别稀释10、8、4、2、1倍,各管质量浓度如下(表1)。
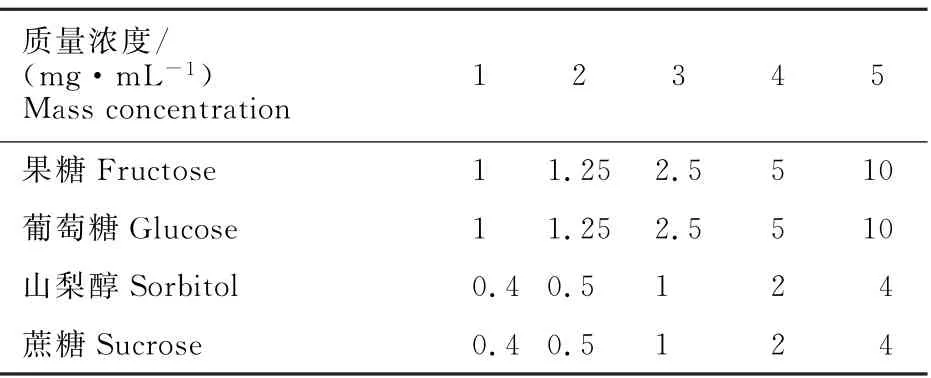
表1 标样配制质量浓度Table 1 Concentration of standard sample preparation
1.2.2 果实中糖代谢相关酶活性的测定 所有酶液制备参考Keller等[20]的方法。称取冷冻果实样品,液氮研磨,加由50 mmol·L-1HEPESNaOH (p H7.5)、10 mmol· L-1MgCl2、1 mmol·L-1EDTA、2.5 mmol·L-1DTT、0.05%(V/V)Tritonx-100 和0.1%(m/V)BSA组成的提取缓冲液,匀浆,用冷却的脱脂纱布过滤,低温离心,收集上清液,2 ℃下透析24 h后的酶液用于酶活性测定。按照酶试剂盒说明书分别测定:蔗糖合成酶(SS-S和SS-C)、蔗糖磷酸合成酶(SPS)、山梨醇脱氢酶(SDH)、酸性转化酶(AI)、中性转化酶(NI)、山梨醇氧化酶(SOX)酶活性,3 次重复,平行3 次。
1.3 数据统计
用Excel 2010 软件进行数据整理和绘图,应用SPSS 20进行差异显著性分析(Duncan’s新复极差法,0.05 水平上测试)和相关性分析(pearson法)。
2 结果与分析
2.1 ‘金冠’苹果及其优系(SGP-1)果实发育期间糖积累变化
如图1-A 所示,发育前期(7~87 d)‘金冠’及‘SGP-1’果实中可溶性糖以山梨醇为主,果糖、蔗糖和葡萄糖含量极少;发育后期(107~167 d),两种材料果实中的可溶性糖以果糖为主,蔗糖、葡萄糖次之,而山梨醇含量极低。随着果实的发育,两材料果实的可溶性糖及各糖组分(果糖、蔗糖、葡萄糖、山梨醇)变化规律总体一致(图1-A~1-E),可溶性糖含量总体呈上升趋势,果糖、蔗糖含量的变化趋势与可溶性糖相似,而山梨醇呈下降趋势,葡萄糖则呈现升降升动态变化。如图1-B~1-D所示,‘金冠’及其优系(SGP-1)果糖的快速增长期在果实发育前期,蔗糖的快速增长期在果实发育后期,山梨醇在果实发育初期积累高而后快速下降,而葡萄糖的快速积累期在果实发育后期(花后127~167 d)。
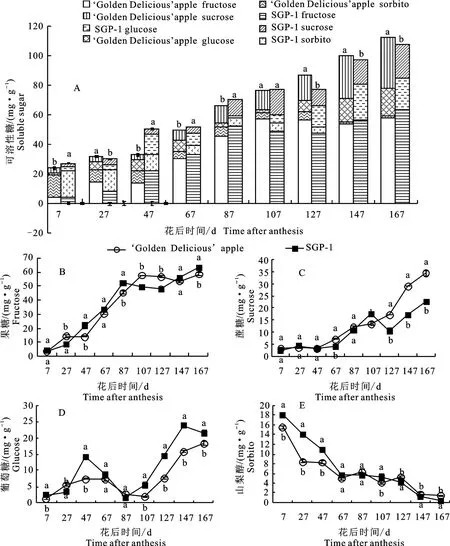
图1 ‘金冠’苹果和‘SGP-1’果实可溶性糖及各组分含量变化Fig.1 Changes of soluble sugar and each sugar component content in‘Golden Delicious’apple and‘SGP-1’fruit
‘SGP-1’可溶性糖总体积累速度慢于‘金冠’,至成熟时‘SGP-1’可溶性糖含量较‘金冠’显著(P<0.05,下同)降低4.05%,‘金冠’为112.26 mg·g-1,‘SGP-1’为107.71 mg·g-1。在各糖组分上,‘SGP-1’的蔗糖总体积累速度慢于‘金冠’,而果糖和葡萄糖总体积累速度快于‘金冠’,至成熟时,‘SGP-1’果实中的蔗糖含量较‘金冠’显著降低34.13%,而果糖、葡萄糖含量分别较‘金冠’显著提高8.66%、17.65%;‘SGP-1’发育前期果实中的山梨醇含量显著高于‘金冠’,但下降速度快,到成熟期时降低74.95%,且显著低于‘金冠’。
2.2 ‘金冠’苹果及其优系(SGP-1)果实发育中糖代谢酶活性变化
2.2.1 蔗糖磷酸合成酶(SPS)活性变化 如图2
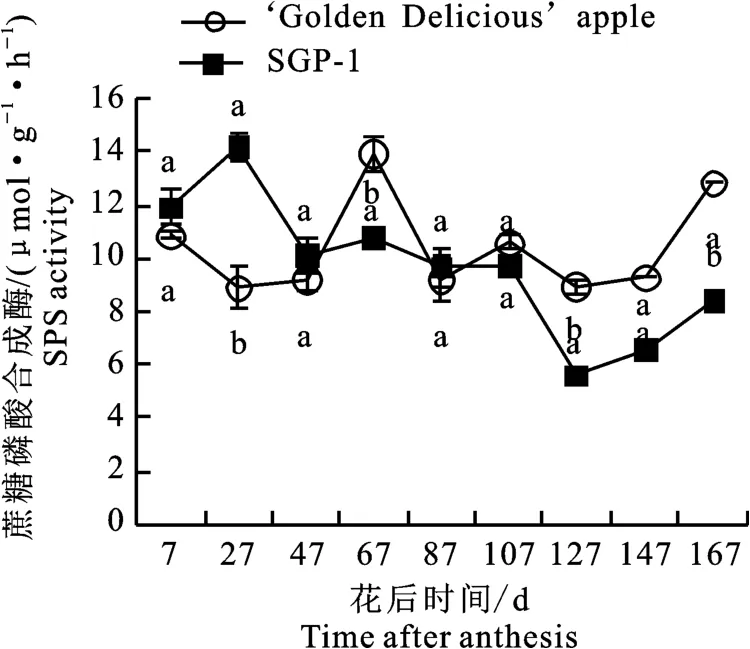
图2 ‘金冠’苹果和‘SGP-1’果实蔗糖磷酸合成酶活性变化Fig.2 Change of SPS activity in‘Golden Delicious’apple and‘SGP-1’fruit
所示,‘金冠’果实中的SPS活性在花后7~127 d处于较低水平(5.22~8.78μmol·g-1·h-1),有所波动,到花后147~167 d 活性逐渐升高(9.65~12.77μmol·g-1·h-1);‘SGP-1’的SPS 活性除在花27 d 出现明显峰值(10.25 μmol·g-1·h-1),在花后7~127 d同‘金冠’一致处于较低值,到花后147~167 d 有所回升(8.52~9.61μmol·g-1·h-1)。除花后27 d‘SGP-1’的SPS活性显著高于‘金冠’,107 d和167 d显著低于‘金冠’,其余时段二者差异不显著。
2.2.2 山梨醇脱氢酶(SDH)活性变化 如图3所示,‘金冠’和‘SGP-1’果实中的SDH 活性变化趋势总体一致,先上升后下降。‘金冠’的SDH活性峰值出现在花后127 d,为3.12μmol·g-1·h-1,‘SGP-1’的峰值出现在花后47 d,为3.63 μmol·g-1·h-1。花后27~47 d‘SGP-1’的SDH 活性显著高于‘金冠’,到花后107~147 d则显著低于‘金冠’,成熟时两者无显著差异。
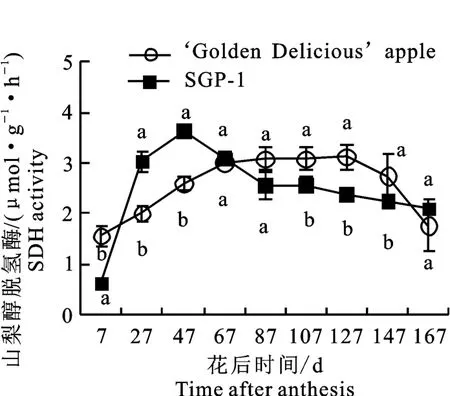
图3 ‘金冠’苹果和‘SGP-1’果实山梨醇脱氢酶活性变化Fig.3 Change of SDH activity in‘Golden Delicious’apple and‘SGP-1’fruit
2.2.5 转化酶活性变化 如图6-A 所示,‘金冠’及‘SGP-1’果实中酸性转化酶(AI)活性变化趋势前期不同,后期基本一致。‘金冠’的AI活性在整个果实发育期间波动不大(7.09~14.40 μmol·g-1·h-1),而‘SGP-1’的活性在花后7~27 d快速上升达到峰值(40.32μmol·g-1·h-1),随后急下降到最大值的三分之一,保持到中后期波 动较小(5.98~12.21μmol·g-1·h-1)。
2.2.3 山梨醇氧化酶(SOX)活性变化 如图4所示,随着果实生长发育,‘金冠’及‘SGP-1’果实中SOX 活性在花后7~87 d变化趋势相反,‘金冠’为先降后升,‘SGP-1’为先升后降,到花后107~167 d,两材料SOX 活性变化趋势相同,为先降后升。除花后67~87 d,‘SGP-1’的SOX 活性显著低于‘金冠’外,其余时段均显著高于‘金冠’。
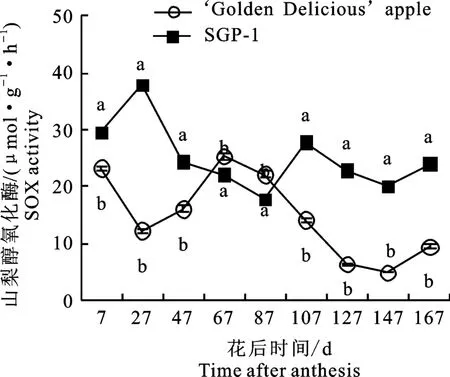
图4 ‘金冠’苹果和‘SGP-1’果实山梨醇氧化酶活性变化Fig.4 Change of SOX activity in‘Golden Delicious’apple and‘SGP-1’fruit
2.2.4 蔗糖合成酶(SS)活性变化 如图5-A 所示,‘金冠’及‘SGP-1’果实中蔗糖合成酶合成方向(SS-S)活性变化趋势前期不同,后期一致。花后7~127 d,‘金冠’SS-S活性总体呈先升后降趋势,在花后67 d达到峰值(13.96μmol·g-1·h-1),而‘SGP-1’的SS-S活性在花后27 d升至峰值(14.20μmol·g-1·h-1),之后降低并维持在一个较稳定的值,到花后127 d进一步降低。花后127~167 d,‘金冠’及‘SGP-1’果实中SS-S活性均呈上升趋势。‘SGP-1’的SS-S活性在果实发育早期高于‘金冠’,在果实发育中后期低于‘金冠’。
如图5-B所示,‘金冠’及‘SGP-1’果实中蔗糖合成酶分解方向(SS-C)活性前期波动较大,后期缓慢上升。花后7~67 d两种材料SS-C 活性较高(4.10~10.54μmol·g-1·h-1),花后87~147 d活性降低(3.77~4.99μmol·g-1·h-1),到花后167 d 活性升至较高值(8.34~8.86 μmol·g-1·h-1)。花后7 d、47 d‘SGP-1’的SSC活性显著低于‘金冠’,而花后27 d‘SGP-1’的活性则显著高于‘金冠’,其余时段二者无显著差异。花后7~47 d和87 d‘SGP-1’果实AI活性显著高于‘金冠’,其余时段显著低于‘金冠’。
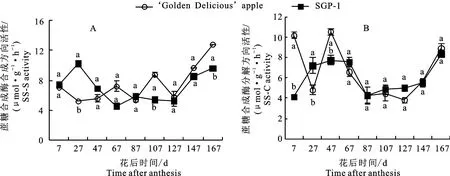
图5 ‘金冠’苹果和‘SGP-1’果实蔗糖合成酶活性变化Fig.5 Change of SS activity in‘Golden Delicious’apple and‘SGP-1’fruit
如图6-B所示,‘金冠’及‘SGP-1’果实中性转化酶(NI)活性波动较大,呈多峰曲线。‘金冠’果实NI活性呈现“降-升-降-升”趋势,在花后7 d、107 d和167 d出现3个小高峰,最大值出现在花后107 d(23.09μmol·g-1·h-1);而‘SGP-1’的活性在花后7~27 d快速上升达到最大值(43.88μmol·g-1·h-1),随后急下降,到花后87 d小幅回升后持续下降。在整个发育期,两材料NI活性差异均达到显著水平,花后7~47 d‘SGP-1’果实AI活性显著高于‘金冠’,花后67 d和107~167 d则显著低于‘金冠’。
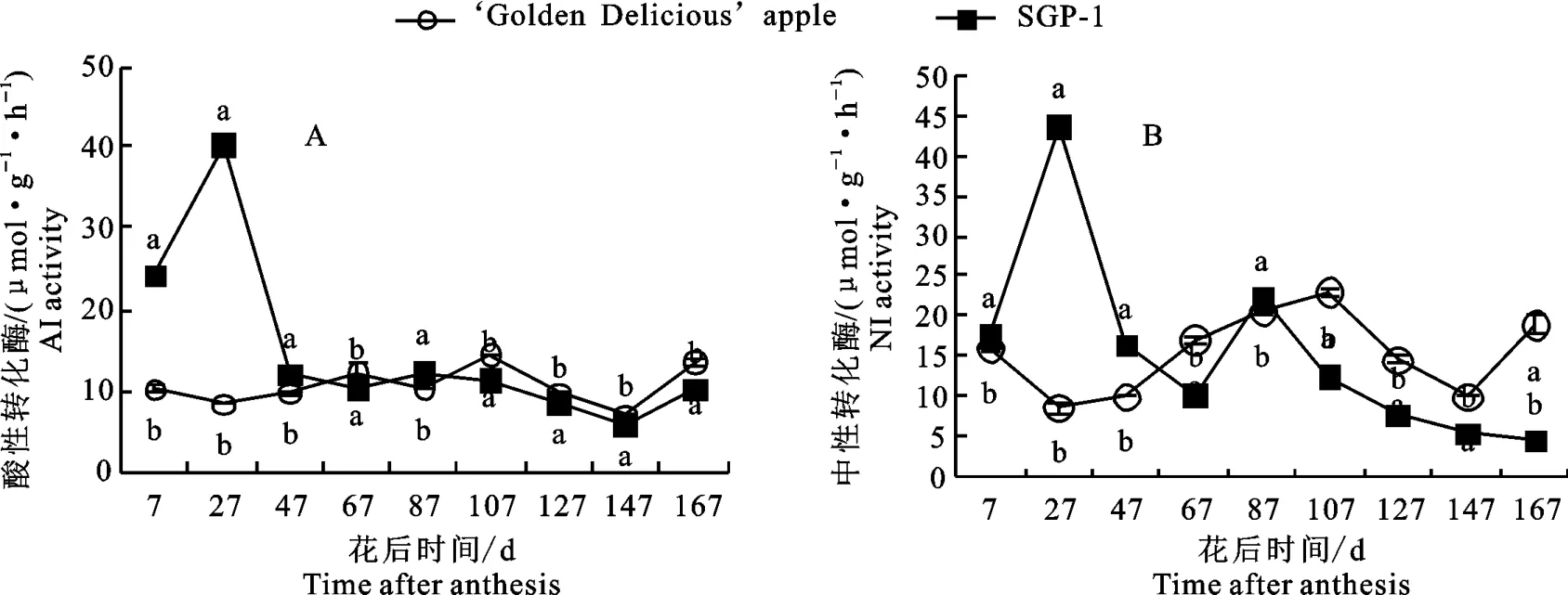
图6 ‘金冠’苹果和‘SGP-1’果实转化酶活性变化Fig.6 Change of invertase activity in‘Golden Delicious’apple and‘SGP-1’fruit
2.3 ‘金冠’苹果及其优系(SGP-1)果实糖积累与其代谢酶活性变化的相关性
根据上述糖及代谢酶动态变化规律,把整个果实发育期分为前期(花后7~87 d)和后期(花后107~167 d),进行‘金冠’苹果和‘SGP-1’果实糖含量与其代谢相关酶活性的相关性分析,结果如表2所示。SPS和SS-S是苹果果实蔗糖合成相关酶,前期‘SGP-1’果糖含量SDH 呈正相关,与SS-S活性呈极显著负相关,而‘金冠’各糖组分与SS-S活性均未达到显著水平;后期‘SGP-1’果糖及两材料葡萄糖和蔗糖均与SPS活性呈显著或极显著正相关,两材料山梨醇与SPS活性呈极显著负相关。
SS-C、AI和NI是苹果果实蔗糖分解相关酶,催化蔗糖分解为葡萄糖和果糖。如表2所示,‘SGP-1’果实的蔗糖含量与此3种蔗糖分解酶相关性未达到显著水平;在前期,果糖含量与AI呈极显著负相关,葡萄糖含量与SS-C 活性呈极显著正相关;在后期,果糖含量与SS-C 活性呈极显著正相关,与NI活性呈极显著负相关,葡萄糖与AI和NI活性呈极显著负相关。而‘金冠’果实前期蔗糖和果糖含量与SS-C 活性呈显著或极显著负相关,与NI活性呈极显著正相关;在后期,蔗糖和葡萄糖含量与SS-C 活性呈显著正相关,果糖含量与AI和NI活性呈极显著正相关。
SDH 和SOX 是苹果果实山梨醇分解相关酶,催化山梨醇分解为葡萄糖或果糖。如表2所示,‘SGP-1’和‘金冠’果实中的山梨醇含量在发育前期均与SDH 呈显著或极显著负相关,在发育后期呈极显著正相关。‘SGP-1’果实的果糖和葡萄糖含量在发育后期与SDH 活性呈极显著负相关;而‘金冠’果实的果糖含量在发育前期与SDH 活性呈极显著正相关,而葡萄糖和蔗糖含量在发育后期与SDH 活性呈极显著负相关。除‘SGP-1’果实后期葡萄糖含量与SOX 呈极显著负相关外,两材料各糖组分与SOX 活性相关性均未达到显著水平。
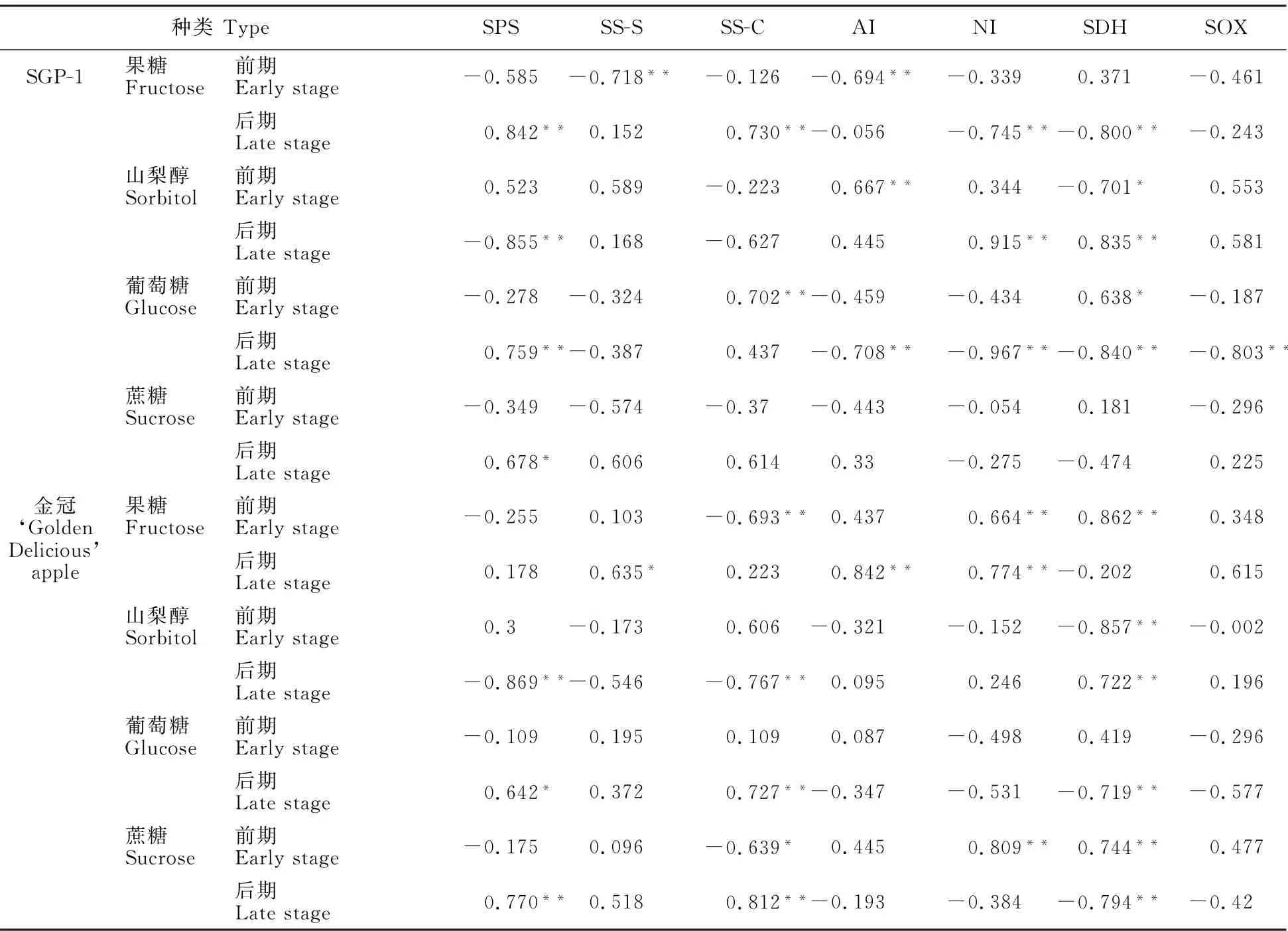
表2 ‘金冠’苹果及‘SGP-1’果实糖含量与其代谢相关酶活性的相关性分析Table 2 Correlation analysis between fruit sugar content and metabolic related enzyme activities of‘Golden Delicious’apple and‘SGP-1’
3 讨论
通过对‘SGP-1’和‘金冠’果实生长发育期间可溶性糖及各组分含量变化的分析,结果表明,两材料果实可溶性糖均以果糖为主,这与李娅楠等[9]、王迪等[21]研究结果一致。各糖组分变化规律总体一致,果糖、蔗糖呈上升趋势,山梨醇呈下降趋势,葡萄糖升降升,但积累速度不同。在果实发育前期,‘SGP-1’果实中果糖、葡萄糖和山梨醇含量整体高于‘金冠’,使得可溶性糖快速积累,蔗糖含量与‘金冠’差异不显著;到果实发育后期,虽葡萄糖含量仍显著高于‘金冠’,但蔗糖含量显著低于‘金冠’,导致可溶性糖总体积累速度显著低于‘金冠’。两材料糖分积累变化规律存在明显差异,与酶活性和糖代谢相关基因的差异有关[22],也受库细胞中韧皮部运输效率、糖的跨膜运输能力的影响[23],需要进一步研究。
苹果的同化产物主要以山梨醇和蔗糖形式运输到果实中,其中山梨醇占80%[24],而糖卸载到果实中的过程在很大程度上取决于果实的库强,衡量库强大小的一个重要生化指标是糖代谢相关酶活性[16]。本研究发现‘SGP-1’果实中主要影响糖代谢的SPS、SDH、SOX、SS-S、SS-C、AI、NI的活性总体表现为在前期显著高于‘金冠’;后期除SOX 活性高于‘金冠’和SS-C 活性持平于‘金冠’,其余酶活性显著低于‘金冠’。前期较高的SDH、SOX、AI、NI活性有利于卸载入‘SGP-1’果实中的山梨醇和蔗糖被分解为葡萄糖和果糖,使前期‘SGP-1’中可溶性糖含量显著高于‘金冠’。在发育后期,苹果中淀粉的快速降解以及SPS、SS-S作用使果实进入蔗糖快速积累期[25],‘金冠’成熟期较高的SPS和SS-S活性使果实中蔗糖含量显著高于‘SGP-1’,进而可溶性糖含量也显著高于‘SGP-1’,相关性分析结果表明,SPS在两材料果实发育后期的蔗糖快速积累阶段起主要调控作用。
相关性分析发现,在果实发育前期调控两材料山梨醇分解的关键酶是SDH,Hideaki等[26]也认为与SOX 相比,果实发育前期山梨醇主要受SDH 影响,研究结果与前人一致;而果实发育后期蔗糖快速积累主要受SPS影响,这与郭燕[27]和温志静等[28]研究认为SS-S在苹果果实蔗糖积累中起主要作用的结论不一致,这可能与品种、发育阶段不同有关。另外本研究中还发现‘SGP-1’果实中的果糖、葡萄糖含量与SPS、SS-C和SDH 活性存在显著或极显著正相关,而‘金冠’果实中的果糖、葡萄糖含量除与上述3个酶活性有密切正相关外,还与SS-S、AI和NI呈正相关。可见,苹果果实的糖代谢存在复杂性,品种差异以及发育阶段不一致均有可能导致相关性改变,可溶性糖含量与代谢酶活性的相关性还有待进一步研究。
4 结论
‘金冠’与‘SGP-1’果实中可溶性糖及各糖组分变化规律总体一致,但积累速度不同,至成熟时‘SGP-1’果实的果糖、葡萄糖含量显著高于‘金冠’,而山梨醇、蔗糖含量显著低于‘金冠’,更高的果糖含量提升了‘SGP-1’果实风味。两材料果实的糖代谢酶在前期变化趋势不同,后期基本一致,‘SGP-1’糖代谢相关酶活性总体表现为前期显著高于‘金冠’,后期除SOX 活性高于‘金冠’、SS-C活性持平于‘金冠’外,其余酶活性显著低于‘金冠’。果实发育前期‘SGP-1’果实各糖组分含量主要受SDH 和SS-S 调控,而‘金冠’则主要受SDH 和NI调控;果实发育后期‘SGP-1’果实各糖组分含量主要受SPS、NI调控,而‘金冠’则主要受SPS、SS-C和AI调控。可见,‘SGP-1’果实可溶性糖积累的关键期为发育前期,而‘金冠’可溶性糖则在发育后期快速积累,且对两材料糖积累起主要调控作用的酶活性和种类存在差异。

