青稞籽粒花青素合成相关基因HvnF3'M 的克隆与表达分析
王 燕,姚晓华,姚有华,苏乐平,2,安立昆,吴昆仑
(1.青海大学,青海省农林科学院,青海省青稞遗传育种重点实验室,国家麦类改良中心青海青稞分中心,西宁 810016;2.延安市农业科学研究所,陕西 延安 716000)
青稞(Hordeum vulgareL.var.nudumHook.f.)也称裸大麦,属禾本科大麦属作物,为禾本科1~2 a生草本植物,可分为二棱、四棱和六棱,是大麦的一个变种[1-2]。因其具有抗寒、耐旱、抗逆性强等特点,被广泛种植于西北、西南等高原地区[3]。青稞的营养价值较高,具有“三高两低”的营养特点,其中,“三高”是指高纤维、高蛋白、高维生素;“两低”是指低脂肪、低糖,因此长期食用青稞对人体营养膳食结构有极大益处[4]。青稞还含有多酚类物质、黄酮类物质和β青葡聚糖等有益成分,对于降胆固醇、降血糖血脂有一定的作用,因此青稞的营养保健功能现已成为国内外研究的热点[5]。中国青稞品种资源丰富,由于不同色素在青稞种子的果皮和糊粉层内沉积而导致不同颜色的呈现,目前带颜色的青稞主要分为蓝、黑、紫3种[1]。与普通青稞相比,有色青稞富含花色苷、酚类化合物、蛋白质以及一些微量元素等有益成分,这也使得目前对于有色青稞的研究越来越受到重视[6]。
花青素(Anthocyanins)又称为花色苷,主要是作为水溶性色素,广泛存在于蔬菜、水果和有色麦类和其他植物中,也是使组织呈现特定颜色的主要次生代谢产物之一[7-8]。花青素是形成谷物籽粒颜色的主要色素成分,具有预防心脑血管疾病、癌症、保护肝脏等保健功能[9-10],可应用于医药保健行业,还可作为着色剂等应用于食品行业[11]。在高海拔地区,花青素还可抵御紫外线辐射,避免对植物造成损伤[12]。近年来随着人们对富含花青素的谷物需求越来越多,有色大米和玉米因其花青素含量高而被用作天然的功能性材料[13]。目前花青素在拟南芥、玉米等植物体内的合成途径已经研究得较为清楚,其主要由黄酮3′羟化酶(F3′H)、查尔酮合成酶(CHS)、黄烷酮3-羟化酶(F3 H)、查尔酮异构酶(CHI)和苯丙氨酸解氨酶(PAL)等多种酶催化完成[14]。然而,青稞紫粒中花青素的合成相关基因及其调控机制研究较少。
类黄酮3′单加氧酶(flavonoid 3′-monooxygenase,F3′M)属于植物细胞色素P450家族(cytochromeP450,CYP450,CYPs)。早 在1986 年Larson等[15]从玉米中分离了F3′M基因,该基因的鉴定确立了玉米中黄酮类化合物生物合成的另一个反应。然而F3′M基因在其他植物中的相关研究鲜见。CYP450是迄今为止支持植物代谢最大的酶家族,在植物体内参与多种重要的代谢反应[16]。CYP450还参与了生物体内脂肪酸偶联物、植物激素、防御化合物等生物的合成与分解代谢[16-17]。在植物的生长发育、抵御生物和非生物胁迫过程中CYP450 也发挥着重要的作用[18]。目前细胞色素P450参与花青素合成相关研究主要集中在模式植物和药用植物中,在青稞粒色形成中的研究尚无报道[16]。因此,本研究基于前期紫色青稞的GBS(Genotyping-by-sequencing)基因定位结果,从紫粒青稞‘达章紫’和白粒青稞‘昆仑12号’中克隆了CYP450 类基因F3′M,并对其序列进行了分析,利用实时荧光定量PCR(RTqPCR)检测了F3′M基因在紫粒和白粒青稞种子着色过程中的表达模式。研究结果为F3′M基因在花青素合成中的调控研究提供理论依据。
1 材料与方法
1.1 材料
以紫粒青稞品种‘达章紫’与白粒青稞品种‘昆仑12号’为材料,2020年4月栽种于青海大学农林科学院青稞实验基地。在籽粒着色不同时期:播种后11周(早期)、13周(中期)和15周(晚期)取两品种籽粒种皮,3次生物学重复。所有样品经液氮中速冻后于-80 ℃超低温冰箱中保存,备用。
1.2 方法
1.2.1 青稞籽粒种皮总RNA 的提取及cDNA合成 将青稞籽粒种皮在液氮中快速研磨至粉末状,对‘达章紫’与‘昆仑12 号’进行总RNA 提取,采用北京麦瑞博生物科技有限公司RNA 试剂盒(Ta KaRa MiniBEST Plant RNA Extraction Kit),用超微量核酸蛋白测量仪(NanoPhotometer)对2个品种的RNA 进行浓度和纯度测定,并借助1.2%的琼脂糖凝胶进行电泳检测其RNA完整性。样品总RNA 的反转录,完全按照c DNA 合成试剂盒(PrimeScript 1st Strand cDNA Synthesis Kit)的操作步骤进行,并置-80 ℃保存,备用。
1.2.2 青稞HvnF3′M基因的克隆 在青稞紫粒的基因定位结果中,7 H 染色体的候选区段内获得一个与花青素合成相关的F3′M序列(基因ID:MLOC_6177),命名为Hvn F3′M[19]。利用Primer 5.0 设计该基因引物HvnF3′M-F/R(表1),以青稞种皮cDNA 为模板进行PCR 扩增。PCR 扩增体系及琼脂糖凝胶电泳检测方法参考姚晓华等[20]的方法。获得的目的条带用DNA 胶回收试剂盒(DNA Gel Extraction Kit)进行切胶回收,用超微量核酸蛋白测量仪(NanoPhotometer)测定胶回收产物的浓度和纯度。将回收产物与p Easy-Blunt载体(全式金生物公司)进行连接、转化至多个大肠杆菌(Escherichia coli)Trans-T1感受态细胞中。最后,将筛选获得的3个阳性克隆以M13为扩增引物进行菌液PCR,并送至生工生物工程(上海)股份有限公司测序。
1.2.3 青稞Hvn F3′M基因的生物信息学分析利用NCBI分析Hvn F3′M的保守结构域[21]。利用Expasy Protparma和Protscale预测蛋白质的理化性质和亲/疏水性[21]。利用SignalP4.1和TMHMM-2.0 预测蛋白质的信号肽和跨膜结构[21]。用Cell-Ploc 2.0对蛋白质的亚细胞进行初步定位[21]。利用SOPMA 和SWISS-MODEL软件对青稞Hvn F3′M分别进行二、三级结构预测[21]。采 用 NCBI 中 的 BLASTP 工 具 与Hvn F3′M 蛋白高度同源的其他禾本科植物氨基酸序列进行比对[21]。利用Mega 5.1软件构建生物系统进化树[21]。
1.2.4 青稞HvnF3′M基因表达模式分析 根据扩增获得的Hvn F3′M基因序列,用Primer 5.0设计定量引物HvnF3′M-SF/SR(表1)。以‘达章紫’和‘昆仑12号’播种后11周(早期)、13周(中期)和15 周(后期)的籽粒种皮cDNA 为模板,选择18Sr RNA 作为内参基因(表1),采用Ta KaRa公司的TB Greenpremix ExTaqⅡ荧光染 料 利 用 Light Cycler480System 进 行 RTqPCR。RT-qPCR 反应体系参照苏乐平等[21]的方法进行。

表1 研究所涉及的引物情况Table 1 Primers used in this study
1.3 数据处理及分析
表达量数据利用Microsoft Excel 2010 和SPSS 22.0统计软件分别进行整理分析,以“平均值±标准差(SD)”方式呈现。基因在不同时期青稞品种的相对表达量采用2-ΔΔCt公式进行计算[22]。所有试验均包含3次生物学重复,试验数据方差分析采用SPSS 22.0。
2 结果与分析
2.1 HvnF3'M 基因的克隆与序列分析
以‘达章紫’和‘昆仑12 号’的籽粒种皮cDNA 为模板,Hvn F3′M-F/R 为扩增引物,获得一条全长为1 675 bp的目的条带(图1),该基因开放阅读框为1 584 bp,共编码527个氨基酸(图2)。序列比对发现,‘达章紫’与‘昆仑12 号’的Hvn F3′M的核苷酸序列存在两个差异,分别位于72 bp和957 bp处,两者一致性为99.87%,导致两个氨基酸差异,一致性为99.62%。利用NCBI中的CD-search对两个品种的氨基酸序列进行基因的保守结构域预测,结果表明该基因有血红素结构域“F××G×R×C×G”,属于细胞色素P450超家族的CYP75家族(图3)。
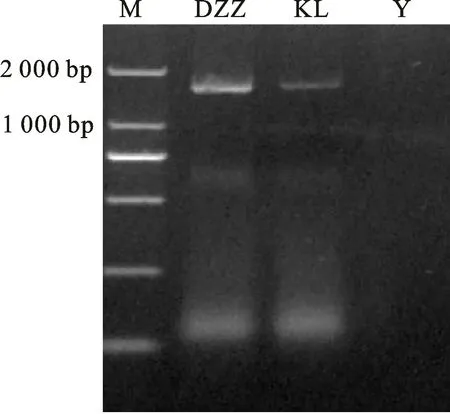
图1 HvnF3'M 基因的PCR 扩增产物Fig.1 PCR amplified product of HvnF3'M gene

图2 HvnF3'M 基因的核酸和推导的氨基酸序列Fig.2 Nucleotide acid sequences and deduced amino acid sequences of HvnF3'M genes

图3 HvnF3'M 蛋白的保守结构域Fig.3 Conserved domain prediction of HvnF3'M Protein
利用在线工具Protparam 预测其理化性质,结果表明,‘达章紫’中的Hvn F3′M 蛋白分子式为C2561H4085N713O723S18,分子质量为57.01 ku,不稳定指数为35.16,脂溶指数为99.39,理论等电点为6.85,其中负电荷残基为59个,正电荷残基为58个。‘昆仑12号’Hvn F3′M 蛋白分子式为C2553H4079N713O720S19,分子质量为56.89 ku,不稳定指数为35.21,脂溶指数为99.39,理论等电点为7.19,其中正、负电荷残基均为58个(表2)。对Hvn F3′M 蛋白亲疏水性、信号肽和跨膜结构预测发现,该蛋白属于亲水性的稳定碱性蛋白,不存在信号肽但存在跨膜结构(图4和图5)。亚细胞定位预测其极可能定位在细胞质的内质网中,得分为1.915,而在周质及外层膜分别为0.333和0.044。

图4 HvnF3'M 蛋白的亲水性和疏水性预测Fig.4 Hydrophilicity and hydrophobicity prediction of HvnF3'M protein
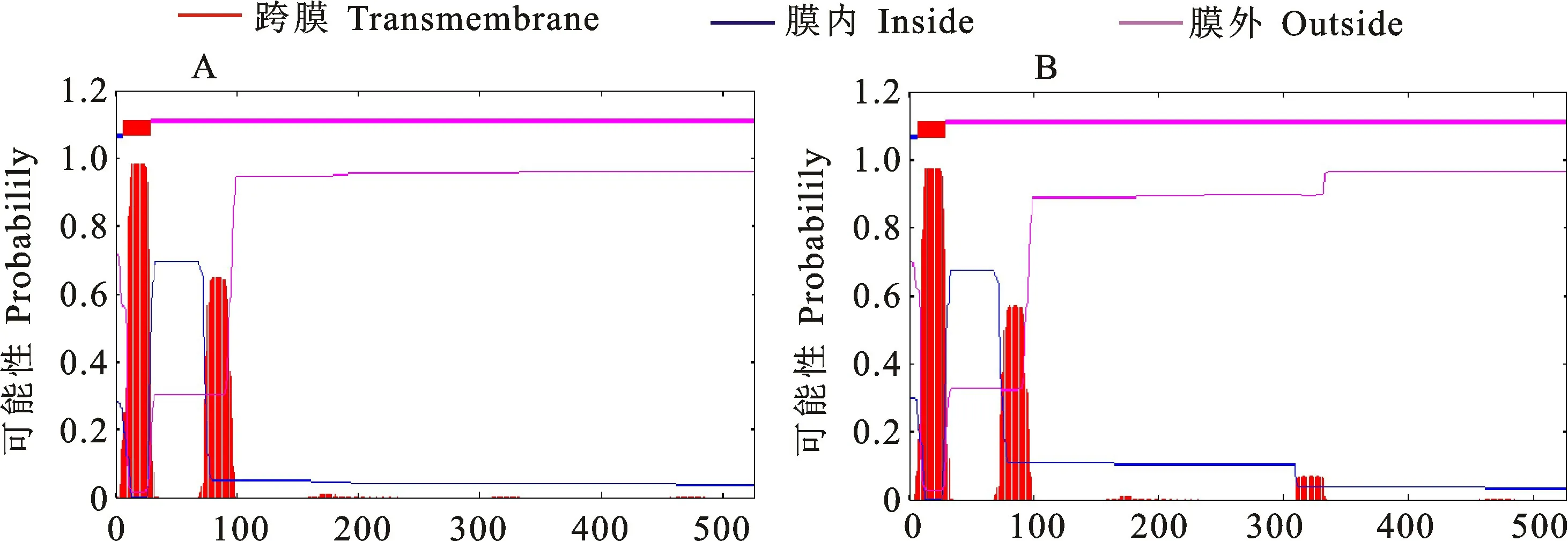
图5 HvnF3'M 蛋白亲跨膜结构预测结果Fig.5 Prediction of transmembrane structure of HvnF3'M protein

表2 HvnF3'M 理化性质分析Table 2 Results of physical and chemical properties of HvnF3'M
HvnF3′M 蛋白的二级结构预测结果发现,‘昆仑12 号’蛋白主要二级结构依次为α-螺旋(49.15%)、无 规 卷 曲(35.86%)、延 伸 链(10.25%)和β转角(4.74%);‘达章紫’蛋白主要二级结构依次为无规卷曲(44.97%)、α-螺旋(42.69%)、延伸链(12.33%)(图6)。对F3′M蛋白的三级预测结果表明,Hvn F3′M 蛋白为低聚态单体,含有α-螺旋与无规卷曲结构(图7)。
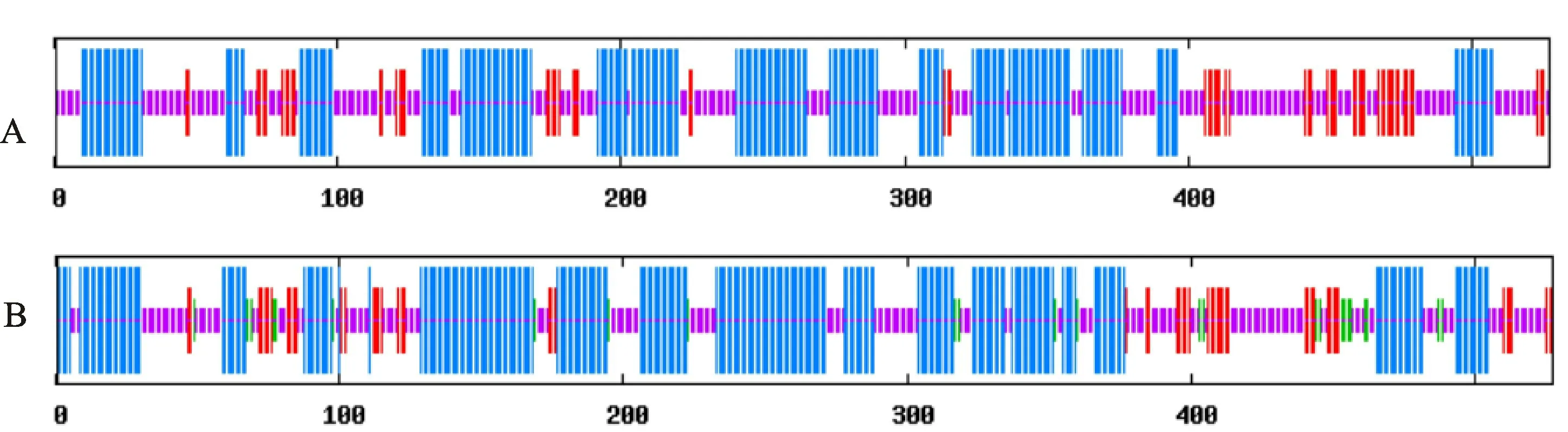
图6 HvnF3'M 蛋白二级结构预测Fig.6 Secondary structure prediction of HvnF3'M protein

图7 Hvt F3'M 蛋白三级结构预测Fig.7 Tertiary structure prediction of HvnF3'M protein
2.2 HvnF3'M 蛋白的同源比较及系统进化分析
DNAMAN 6.0结果分析表明,Hvn F3′M 蛋白与青稞(Hordeum vulgareL.var.nudumHook.f.)、大麦(Hordeum vulgare)、二粒小麦(Triticum dicoccoides)、山羊草(Aegilops tauschii)、二穗短柄草(Brachypodium distachyon)的F3′M 氨基酸序列一致性较高,分别为99%、100%、88.85%、78.23%和77.52%(图8)。系统进化分析表明,在11 种禾本科植物种中,青稞F3′M 蛋白与同物种青稞、大麦的亲缘进化关系最近,与玉米(Zea mays)的亲缘进化关系较远(图9)。

图8 HvnF3'M 与禾本科其他植物多序列比对Fig.8 Multiple alignment of HvnF3'M and other plants of gramineae
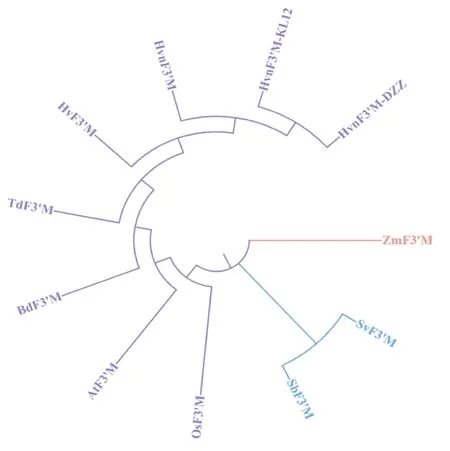
图9 HvnF3'M 蛋白与其他禾本科植物的系统发育分析Fig.9 Phylogenetic analysis of Hvt F3'M protein and other gramineae
2.3 总花青素含量及Hvn F3'M 基因表达分析
对‘达章紫’和‘昆仑12号’粒色形成的3个时期进行粒色表型分析及总花青素含量测定发现,‘达章紫’中总花青素含量呈极显著升高,中期较早期增加了793.81μg/g,为早期的9.38 倍(P<0.01),晚期较早期增加了1 173.07μg/g,为早期的13.38倍(P<0.01);‘昆仑12号’总花青素含量3个时期均无显著差异(图10,图11)。同时为研究Hvn F3′M基因在青稞种皮颜色形成中的表达模式,利用RT-qPCR 检测该基因在‘达章紫’和‘昆仑12号’种皮颜色形成的早、中、晚期的相对表达量。荧光定量PCR 结果表明,在籽粒颜色形成的早、中、晚期,‘达章紫’的Hvn F3′M基因的表达量在早期与中期无显著差异,晚期表达量极显著升高,为早期的1.49倍,中期的1.52倍(P<0.01);而‘昆仑12号’3个时期Hvn F3′M表达量差异不显著;且晚期‘达章紫’Hvn F3′M基因的表达量极显著高于‘昆仑12 号’(P<0.01)(图11-B)。推测随着种皮花青素的合成,Hvn F3′M基因表达量逐渐升高,该基因可能正向调控花青素的累积。
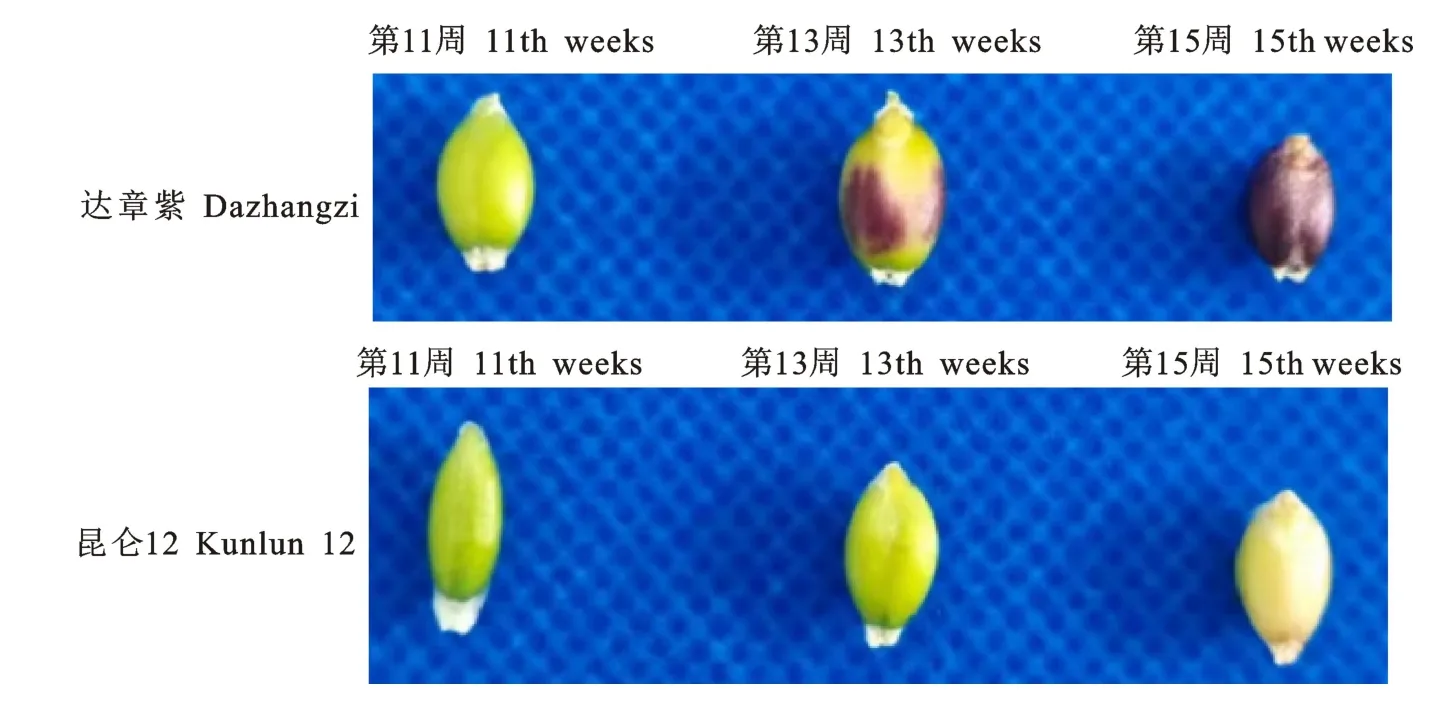
图10 HvnF3'M 基因在不同粒色青稞种子中的着色过程Fig.10 Coloration of HvnF3'M gene in barley seeds of different grain colours
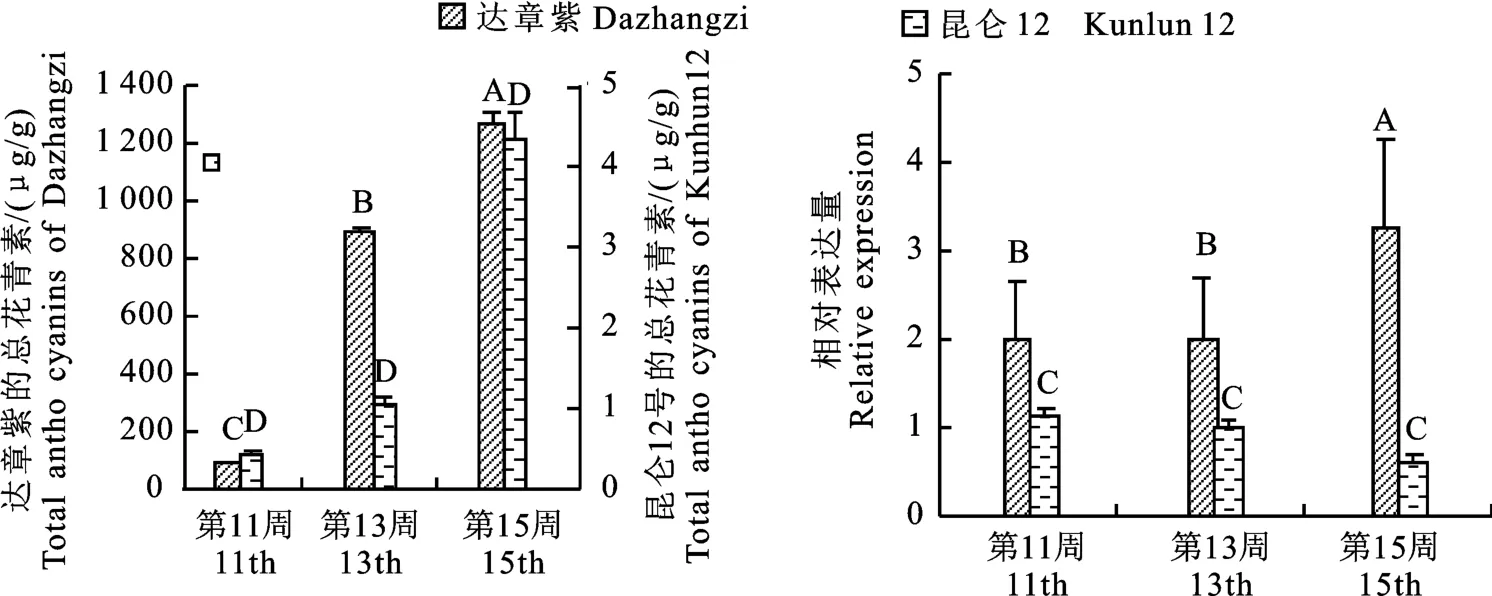
图11 不同粒色青稞品种粒色形成的早、中、晚期的表达量及总花青素含量Fig.11 Expression and total anthocyanin content of different hulless barley varieties at early,middle and late stages
3 讨论
细胞色素P450单加氧酶家族在生物体内对外源化合物(如工业化学品)的代谢和内源化合物(如维生素)的调节过程都扮演着一个重要的角色[23-25]。本研究从紫粒青稞‘达章紫’和白粒青稞‘昆仑12号’,分别克隆获得一条细胞色素P450单加氧酶的F3′M基因。发现‘达章紫’与‘昆仑12号’的Hvn F3′M的序列存在两个碱基和两个氨基酸的差异。研究表明,生物体内碱基的突变都极大可能影响蛋白质或酶的生物学功能,进而导致机体的表型出现异常。例如,欧春青采用基因组重测序结合BSA 分析的方法,从一种红色梨品种中鉴定出一个与红色性状紧密关联的14 bp缺失变异,该片段缺失变异促使了PpBBX24基因产生移码突变,蛋白翻译提前终止,导致部分蛋白功能出现改变[26-27]。本试验中的碱基差异是否也与花青素合成相关有待进一步验证。陆生植物细胞色素P450共有11个氏族,被分为单家族簇和多家族簇两类,多家族簇其功能具有巨大的多样性,其中CYP75属于多家族簇,与类黄酮的合成密切相关,而花青素生物合成途径是类黄酮途径的重要分支之一[16,28]。本试验克隆的F3′M属于CYP75,因此推测该基因与花青素合成存在一定的联系。通过对Hvn F3′M 蛋白跨膜结构与信号肽预测结果发现,该蛋白在2种青稞内均存在跨膜结构。跨膜蛋白位于细胞与外界的连接处,对于细胞与外界之间的信号转导起着重要作用,具有多种生物学功能,该结构的存在对基因功能的研究和探索具有重要意义[29]。亚细胞定位发现,该蛋白均可能定位在内质网中,这与目前诸多研究发现的花青素合成位置具有相同性[30]。
花青素是植物中常见的具有强大抗氧化以及清除自由基等生理功能的代谢产物[31-32]。近年以来,关于F3′M基因在单子叶植物中的研究较少。本实验通过对Hvn F3′M 蛋白的同源比较分析发现,Hvn F3′M 蛋白与大麦的F3′M 蛋白序列相似性最高,达到了100%,与NCBI上青稞未知蛋白(KAE8766982.1)相似性达到了99%,同源比对发现NCBI上青稞未知蛋白序列可能存在缺失现象,但须进一步验证。Hvn F3′M 氨基酸序列具有绝对保守的“E××R”基序和典型的“LPPGP”序列,还具有P450超家族最具代表结构域,即血红素结构域“F××G×R×C×G”,这一特征不仅符合P450超家族蛋白质特征,也与植物花青素合成途径中的F3′H(flavonoid 3′-hydroxylase)氨基酸序列特点相似[16,32-33]。前人研究发现F3′M蛋白与部分植物(如红豆杉、云杉等)的F3′H 蛋白序列存在高度相似性,均具有保守结构域(PPGP,AGTDT 和FGAGRRIC)[34]。因 此 本 研究从大麦参考基因组(ftp://ftp.ensemblgenomes. org/pub/release-63/plants/fasta/hordeum _ vulgare/dna) 中 调 取 了 F3′ H(HORVU1Hr1G094880)序列,比较其蛋白的3个保守结构域(PPGP、AGTDT 和FGAGRRIC),与‘达章紫’F3′M 一致性分别为100%、80%和100%,与‘昆 仑12 号’F3′M 一 致 性 分 别 为100%、60%和100%。F3′H 是类黄酮生物合成途径中的关键酶,研究表明F3′H 基因在转录水平上的丰度能有效影响花青素的合成[33],推测F3′M 蛋白在花青素合成过程中可能与F3′H 蛋白具有相似功能。
花青素的含量与植物籽粒成熟度之间关系密切,且随着花青素的累积,部分基因的表达量也会显著升高[35]。例如,苏乐平等[21]研究发现,青稞类黄酮3-O-葡萄糖基转移酶基因(Hvt UF3GT)在蓝粒青稞‘INB0N-7’和白粒青稞‘昆仑12号’的籽粒灌浆后期不表达,而在黑粒青稞和紫粒青稞中的表达强弱依次为‘黑老鸦’(黑粒)>‘昆仑17号’(黑粒)>‘达章紫’(紫粒)>‘涅如姆扎’(紫粒)。赵佳等[36]通过比较7种不同颜色月季花瓣中的花青素苷含量以及Rh MYBs4-1和Rh MYBs6-1的表达水平,结果发现红色花瓣中花青素苷含量显著高于其他颜色花瓣,其中粉红色月季花瓣中Rh MYBs4-1的表达量极低,且花青素苷含量不到红色花瓣的10%。在本研究中,紫粒青稞种皮着色过程中Hvn F3′M基因的表达量极显著(P<0.01)高于白粒青稞,此外,在紫粒形成过程中的Hvn F3′M基因表达量随着粒色的加深,表达量逐渐升高,且在晚期表达量达到了最高,推测Hvn F3′M基因在紫粒形成过程中正向调控了花青素的累积,但具体调控机理有待进一步探索。
4 结论
本研究从青稞‘昆仑12号’和‘达章紫’中克隆了Hvn F3′M基因。该基因全长为1 675 bp,编码527 个氨基酸,属于P450 超家族。RT-qPCR结果显示,该基因在紫色品种‘达章紫’籽粒形成过程中其表达量在晚期显著升高,在白色品种‘昆仑12号’中则差异不显著;且在‘达章紫’表达量极显著高于‘昆仑12号’。因此推测,该基因在青稞籽粒着色过程中发挥重要正向调控作用。本研究结果为进一步探究Hvn F3′M基因在花青素的合成中的作用和调控机制奠定了基础。

