玉米出籽率相关性状的QTL初定位分析
章 爽,张秀英,刘斌斌,董 远,李 婷,李 勤,薛吉全,徐淑兔,张兴华
(1.西北旱区玉米生物学与遗传育种重点实验室,西北农林科技大学 农学院,陕西 杨凌 712100;2.陕西省汉中农业科学研究所,陕西 汉中 723000)
玉米是全球第一大粮食作物,提高玉米单产和总产不仅为中国粮食安全打下坚实基础,也为中国经济发展做出重要贡献[1]。玉米出籽率、单穗质量、穗轴质量等性状与产量有较强的相关性,作为典型的数量性状,会因环境效应产生变化,且多个微效基因会对其产生影响[2]。穗部性状如出籽率、单穗质量、穗轴质量等是玉米产量的主要构成因素,在玉米高产育种中占有重要地位。有研究表明单穗质量、穗粒质量和百粒质量与产量之间极显著正相关,其中单穗质量对产量的直接效应最大,在玉米产量形成中占主导地位[3]。前人研究证实出籽率与单穗产量紧密联系[4-7],赵延明等[8]认为玉米出籽率对单株籽粒产量影响大,因此玉米遗传改良要重点选择出籽率。综上,研究玉米穗部相关性状的遗传分子机制对玉米高产育种具有重要意义。
近年来,随着技术的发展,利用分子标记技术结合数量性状统计模型发展而来的QTL 定位方法已经成为解析数量性状分子机制的重要手段,且该方法研究挖掘的主效QTL 为后续相关数量性状分子标记辅助育种提供参考,在遗传育种改良实践中发挥重要作用。现有与玉米产量密切相关的穗部性状QTL 定位主要集中在穗长、结实长、穗行数、穗粒数、穗粗和轴粗等方面[9-13]。作为玉米产量主要构成因子单穗质量和穗粒质量,以及玉米高产组合必须具备的高出籽率[14],这些性状的QTL定位相对较少。因此在更为丰富的遗传背景下,挖掘更多的控制玉米穗部性状的QTL位点,有利于解析穗部性状的遗传机制,并为分子遗传育种提供更多的优异基因资源。
本研究以KA105 和KB020 为亲本构建的201份重组自交系(RILs)群体为材料,在榆林和汉中两环境中对玉米出籽率、单穗质量和单穗粒质量3个穗部性状分别进行QTL 定位。研究旨在发现不同环境中可以稳定遗传的QTL,为解析玉米出籽率、单穗质量和单穗粒质量的遗传基础和后续分子标记辅助选择育种提供参考。
1 材料与方法
1.1 供试材料
以陕A、B 群优良自交系KA105 和KB020为基础材料,构建含201 个家系的重组自交系(RILs)群体。将亲本、RILs群体于2019年分别种植于榆林(Yulin,YL)和汉中(Hanzhong,HZ)两地。试验采用完全随机区组设计,单行区,设置2次重复,行长5 m,行距0.6 m,株距22.2 cm。田间管理分别与榆林、汉中一致。
1.2 出籽率等性状测定及数据分析
待玉米成熟后,收获田间所有果穗进行风干,在每个家系中挑选大小均匀一致的5个果穗进行性状测定。参照石云素[15]制定的标准,测定亲本(KA105和KB020)及F5:6 代群体的单穗质量(EW)和单穗粒质量(KWE),并进一步计算出籽率:
出籽率=单穗粒质量/单穗质量×100%
采用SPSS25.0对F5:6代RILs群体以及亲本的出籽率、单穗质量、单穗粒质量进行统计分析和方差分析。广义遗传力的计算公式为:
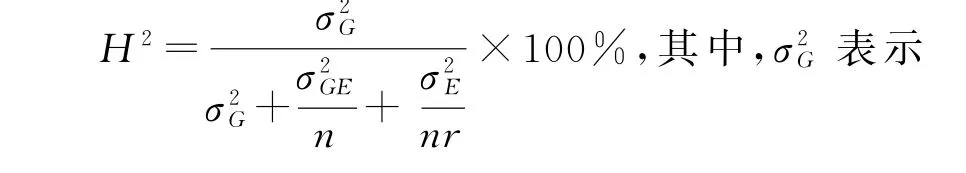
1.3 QTL分析
试验中所用群体及其分子标记连锁图谱构建参考Yang等[17],将RILs群体中与亲本KA105基因型一致的记为2,与亲本KB020基因型一致的记为0,若QTL 分析中加性效应为正,说明该QTL增效等位基因来自于KA105,反之则来自于KB020。利用QTL ICIMapping V4.2软件的完备区间作图法(ICIM),分别对各环境的出籽率、单穗质量、单穗粒质量及其BLUP 值进行QTL 分析。PIN 设置为0.001,步长为1 c M,LOD 阈值以模拟运算1000次的方法来确定,当某个位置检测到的LOD 值大于阈值时,即认为该位置存在一个控制该性状的QTL。QTL 命名参考Mccoch等[18]的方法按照QTL、性状、染色体、QTL个数依次命名。其中QTL以q开始,出籽率、单穗质量、单穗粒质量分别以英文缩写KR、EW、KWE 表示。如果某个性状同一条染色体有多个不同的QTL,则以“-1”“-2”和“-3”加在染色体后以示区分,其余以此类推。
2 结果与分析
2.1 出籽率、单穗质量和单穗粒质量基本统计分析
由双亲及RILs群体的穗部性状分析可以看出(表1),F5:6群体的出籽率、单穗质量、单穗粒质量在榆林和汉中两点均表现出超亲分离,其中母本KA105在出籽率、单穗质量、单穗粒质量上属于低值亲本,父本KB020属于高值亲本。群体中单穗质量和单穗粒质量的变异系数在2个环境均超过了25.00%,说明不同家系在2个环境中均有丰富的表型变异。相对而言,出籽率的的表型变异相对较窄,变异系数小于4.00%。同时,3个性状在2个环境中均表现出一定的超亲现象,即最小值低于低值亲本,最大值高于高值亲本,说明双亲中含有不同的与目标性状相关的有利等位基因数量。同时根据榆林和汉中两个环境下出籽率、单穗质量、单穗粒质量表型值的偏度和峰度绝对值均小于1,符合正态分布(图1),属于数量遗传性状,可进行QTL定位。
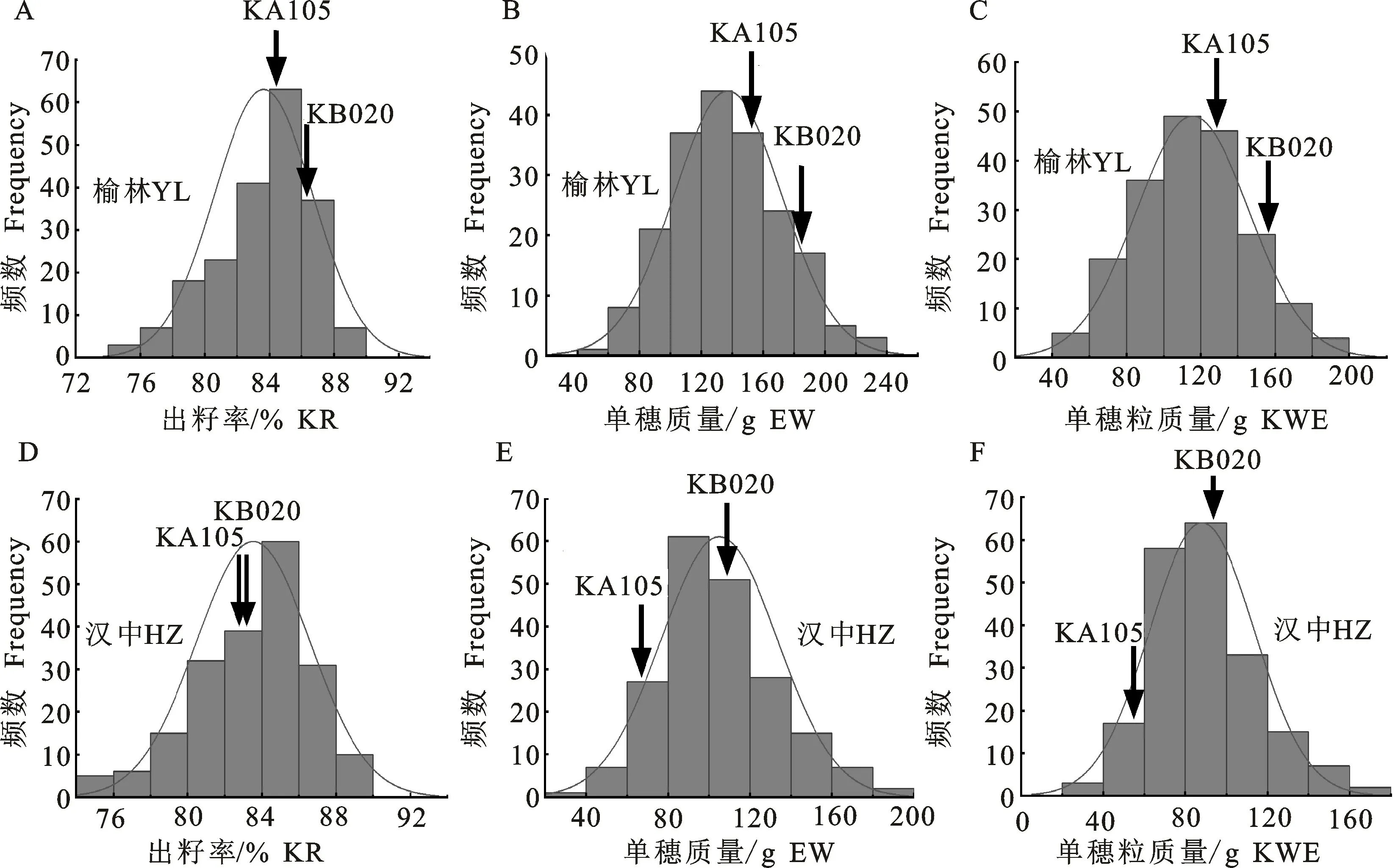
图1 玉米RILs群体及亲本的出籽率、单穗质量、单穗粒质量正态分布Fig.1 Normal distribution plots of KR,EW and KWE of RILs population

表1 玉米RILs群体及其亲本的出籽率相关性状基本统计描述Table 1 Basic description of KR,EW and KWE of RILs population and its parents
2.2 遗传率计算与相关分析
方差分析结果(表2)显示,出籽率、单穗质量和单穗粒质量3个性状在不同家系间均表现为极显著差异(P<0.01),单穗质量和单穗粒质量在榆林、汉中两环境中的差异也达到极显著,表明单穗质量、单穗粒质量同时受环境、基因型影响。相对而言,出籽率受环境影响小,基因型与环境对表型的影响也不显著,即表明该性状受基因型影响较大。通过遗传力计算,出籽率、单穗质量和单穗粒质量的广义遗传力分别为82.82%、81.71%和81.15%。相关性分析表明(表3),同一环境下出籽率、单穗质量和单穗粒质量三者之间均达到极显著正相关,不同环境下同一性状均表现极显著正相关,不同环境下不同性状表现的相关性差异较大,榆林出籽率与汉中单穗质量、汉中单穗粒质量,汉中出籽率与榆林单穗质量、榆林单穗粒质量相关系数较低,小于0.3,其他各性状之间均表现为极显著正相关。

表2 玉米出籽率、单穗质量、单穗粒质量的方差分析Table 2 Variance analysis of KR,EW and KWE in maize RILs population
2.3 QTL定位分析
通过完备区间作图法,以2个环境下出籽率、单穗质量、单穗粒质量的表型值以及各个性状的BLUP值进行QTL 分析,共检测到10个QTL,分别位于1号、2号、5号、6号、9号和10号染色体上,单个QTL可解释5.92%~13.50%的表型变异(表4)。其中,1 号染色体的189.50~193.55 Mb和6号染色体的112.25~120.46 Mb区间在出籽率(q KR1,q KR6)、单穗质量(qEW1,qEW6)和单穗粒质量(q KWE1,q KWE6)中均被检测到。其中qEW1在汉中、榆林和BLUP 中都检测到,而位于6 号染色体的qEW6和q KWE6都 能 在 榆 林 和BLUP 中 检 测到,其增效等位基因均来自于父本KB020。10个QTL中共有7个QTL 的加性效应为负值,增效等位基因来自父本KB020,其他均来自于母本KA105。

表4 RILs群体出籽率、单穗质量和单穗粒质量的QTL定位Table 4 Analysis of QTLs for KR,EW and KWE in RILs population of maize
2.3.1 出籽率QTL 定位 通过完备区间作图法,利用榆林、汉中两环境的出籽率性状及其BLUP值共检测到5个与出籽率有关的QTL,分布在1号、2号、5号、6号和9号染色体上,可解释表型变异率为5.92%~13.49%。位于2号染色体的q KR2和位于6 号染色体的q KR6可解释的表型变异率分别为10.40%和13.49%,可能是控制出籽率的主效QTL。除q KR2和q KR9加性效应为正值,增效等位基因来自于母本KA105外,其他3个QTL 增效等位基因均来自于父本KB020。
2.3.2 单穗质量QTL 定位 利用榆林、汉中两环境的单穗质量性状及其BLUP 值共检测到2个单穗质量QTL,分布在1号和6号染色体上,解释的表型变异率为7.85%~11.88%。其中,1号染色体上的qEW1在榆林、汉中和BLUP环境中均能检测到。6号染色体上的qEW6能在榆林和BLUP两个环境中检测到。他们的加性效应为负值,增效等位基因均来自于父本KB020。2.3.3 单穗粒质量QTL 定位 利用榆林、汉中两环境的单穗粒质量性状及其BLUP 值共检测到3个与单穗粒质量相关的QTL,分别位于1号、6号、10号染色体上,可解释的表型变异率为7.56%~13.50%。在榆林和BLUP条件下共定位到q KWE6,可解释的表型变异率分别为12.40%和13.50%,其加性效应为负值,增效等位基因来自父本KB020。
3 讨论
本研究以自主选育的KA105和KB020构建的重组自交系群体为材料,针对产量重要构成因子出籽率、单穗质量和单穗粒质量为目标性状,进行群体表型变异和QTL定位分析。结果显示,该群体出籽率在两个环境下的平均变异系数(2.25%)均小于单穗质量(17.40%)和单穗粒质量(18.35%),究其原因,出籽率是本课题组自交系选育的重要指标[19],双亲在出籽率性状上差异不大,因此双亲构建的群体变异幅度也较小。但本研究仍能检测到表型贡献率较大的出籽率QTL(q KR2和q KR6),且效应分别来自KA105和KB020,说明按照统一标准进行自交系选育过程,双亲可以通过富集不同的有利等位基因表现出类似的优势表型。
本研究共检测到出籽率、单穗质量和单穗粒质量相关QTL10个,不均匀的分布在1、2、5、6、9和10号染色体上;其中1号和6号染色体上检测到较多的QTL,都有3个,其他染色体上均只检测到1 个QTL。在1 号染色体上分布的3 个QTL 分别控制出籽率(q KR1)、单穗质量(qEW1)、单穗粒质量(q KWE1),且这3个QTL在同一区间,可认为该QTL 同时调控3 个不同性状;6号染色体上的3个QTL也是在同一个区间内,它们分别控制出籽率(q KR6)、单穗质量(qEW6)、单穗粒质量(q KWE6)3 个性状,也是一个一因多效的QTL。兰进好等[20]认为,QTL成簇分布或毗邻分布遗传基础可能是基因的一因多效或是不同基因的紧密连锁。本研究发现1号和6号染色体上都检测到一个多效位点,同时调控出籽率、单穗质量和单穗粒质量。代国丽等[21]认为QTL区域的连锁表现在性状上必然是一定程度的相关,而出籽率是单穗粒质量与单穗质量的比值,单穗粒质量是单穗质量与单穗轴质量的差值,本研究相关性分析表明出籽率、单穗质量与单穗粒质量两两之间极显著正相关,因此出籽率、单穗质量和单穗粒质量能检测到较多共定位到QTL。
Zhuang等[22]认为基因与环境互作很大程度上影响数量性状,因此相同的作图群体在不同环境中检测到的QTL 会有不一致,甚至有较大差异。从本研究的定位结果也可以看出,有且仅有qEW1能在2个单独的环境和BLUP值中能被检测到,是稳定QTL,可开展进一步研究。同时,位于6号染色体的qEW6和q KWE6能同时在榆林和BLUP中定位到,其余QTL 均为单环境下能检测到QTL。通过与前人报道的QTL定位结果进行比较分析发现,出籽率QTLq KR1和q KR9与常立国等[23]定位到的q KR1-2和q KR9-2分别位于同一bin 上,q KR6与赵小强等[24]定位的q KR-Ch.6-1位于相同bin区间;单穗质量qEW6与马金亮[2]定位到的qEW6-2位于相同的bin区间;单穗粒质量q KWE1与马金亮[2]定位的穗粒质量q KWE1-3处于相同bin区间,q KWE10也与马娟等[25]定位的MQTL34处于相同bin。本研究在bin1.07 和bin6.05 上定位的同时调控出籽率、单穗质量和单穗粒质量性状的QTL与马金亮[2]和赵小强等[24]定位的结果一致,同时影响多个性状。综上所述,本研究检测到的QTL中有6个QTL 位点在前人研究的同一性状中已被检测到,可开展进一步的精细定位工作,挖掘功能基因。同时另外2个出籽率QTL(q KR2,q KR5),1个单穗质量QTL(qEW1),1个单穗粒质量QTL(q KWE6)为本研究新检测到的QTL,因此对这些新发现的QTL 附近是否存在控制穗部性状的基因可做进一步研究。
4 结论
本研究利用201份玉米重组自交系在两个环境中的表型值对玉米穗部性状出籽率、单穗质量和单穗粒质量以及两个环境的BLUP 值进行QTL定位,结果共检测到10个出籽率相关性状QTL,其中出籽率检测到5个QTL,单穗质量检测到2个QTL,单穗粒质量检测到3个QTL,有4个QTL解释的表型变异率大于10.00%。2个多效位点(q KR1,qEW1和q KWE1;q KR6,qEW6和q KWE6)都能控制出籽率、单穗质量和单穗粒质量,其中位于6号染色体的QTL在3个性状中均能解释大于10.00%的表型变异,可作为下一步研究的重点关注区域。

