SHANK3基因新发变异致Phelan-McDermid综合征1例病例报告
刘春雪 王 怡 邓晶鑫 徐 琼 张凯峰 李慧萍 周秉睿 胡纯纯 徐 秀
1 病例资料
男,3岁10月,因“语言发育落后、上课多动”就诊于复旦大学附属儿科医院(我院)儿保科。初诊时能表达简单的短句,目光注视、叫名反应、听指令均可,会用食指指物,喜欢接近同龄小朋友,但缺乏正确的交往方式,自言自语较多,主动分享展示尚可,无明显刻板行为和感知觉异常。幼儿园老师反映患儿上课不听指令、注意力不集中、多动。平素患儿主要由母亲带养,母亲自觉患儿学习很慢,教授新技能困难。患儿在当地干预机构进行每周5 d、每日1.5 h的行为干预训练(包括以集体、小组方式进行游戏、画画、唱歌等,以个训方式进行常识、认知训练)。
患儿系G4P1,此前3次妊娠中1次因胎停(葡萄胎)、2次因个人因素人工流产。母亲在本次孕早期曾肌肉注射黄体酮保胎治疗,孕期曾口服“感冒药”(具体药物不详)。患儿系足月自然分娩,出生体重3 650 g,否认窒息史和抢救史。生后第4 天诊断“高胆红素血症”,蓝光照射治疗后好转。新生儿期无明显肌张力减退。曾对牛奶蛋白过敏,经水解奶粉喂养后好转。家长诉患儿大运动发育里程碑均落后于同龄儿童(18月龄会独走,余不详)。父母非近亲婚配,否认遗传性疾病家族史。
4岁时体格检查:身高 106 cm(P50~ P75),体重18.4 kg(P50~ P75),头围49.4 cm(P50)。神清,精神好。头颅无畸形,眼距稍宽,面中部稍平坦,两颊略饱满,球状鼻,宽鼻梁,大耳(图1)。心、肺、腹、外生殖器、神经系统查体未见异常。
Gesell发育量表(发育商DQ):适应性70,大运动发育54,精细运动78,语言57,个人社交48,提示全面发育迟缓。孤独症诊断观察量表-2(ADOS-2),模块2社交情感3分,局限和重复性行为0分,全量表总分3分,提示非孤独症谱系障碍(ASD)。血生化、心超、双肾B超、脑电图、头颅MR平扫均未见异常。血浆二十二碳六烯酸(DHA)含量23.5 μg·mL-1,低于同期检测3名与该患儿同年龄、同性别,且基因检测无SHANK3变异和其他已知致病基因变异的确诊ASD儿童的血浆DHA含量[(42.6 ± 6.9)μg·mL-1]。
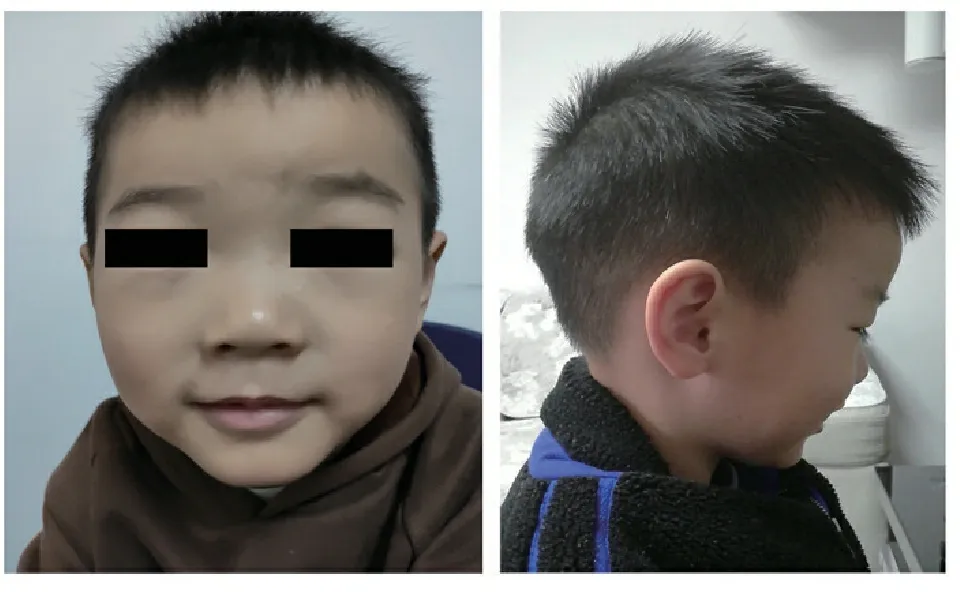
图1 患儿面部特征
经患儿家长知情同意后,抽取患儿及其父母外周静脉血,由我院分子诊断中心对患儿行临床外显子检测,并在父母中验证。患儿SHANK3基因(NM_033517)第5外显子上1个杂合变异c.458delT,导致从第153位氨基酸开始发生移码,形成了翻译提前终止的截短蛋白(p.L153Rfs*14)。父母中未检测到相同变异,故患儿为新发变异。根据美国医学遗传学与基因组学学会序列变异解读标准与指南对该变异进行分析[1]:①移码变异(PVS1),②新发变异(PS2),③在gnomAD、Exome Sequencing Project等数据库中均未发现该变异(PM2),④患儿临床症状与SHANK3基因变异所致的Phelan-McDermid综合征(PMS)表型高度相符(PP4)。综上分析,判定SHANK3基因c.458delT(p.L153Rfs*14)变异为致病变异。
诊疗及随访:根据患儿全面发育迟缓、轻度面部畸形的临床表型,结合基因检测结果,诊断为PMS。初诊后,患儿继续在当地干预机构进行行为干预训练,予DHA 400 mg·d-1,分2次饭后口服。
基线及门诊随访3次(4岁3月、 4岁6月、 4岁9月、4岁11月)对患儿行发育评估,母亲自觉用药后患儿学习新技能较前明显加快。Griffiths发育量表和Vineland量表提示多个发育能区的发育水平均有不同程度提高,第3次随访与基线水平比较如下。①语言:Vineland量表提示沟通领域的发育水平显著提升(DQ:95vs78,标准分:96vs71),尤其是表达性沟通和读写领域;Griffiths量表的语言领域评估结果与之相似,患儿语言长度显著增加(从4~5字增加至至少13个字长度),词汇量也显著增加,能解释自己正在玩的游戏。②运动:大运动和精细运动发育水平显著提高,Vineland量表提示运动技巧显著提高(DQ:85vs75;标准分:99vs78),其中精细运动提升更显著。③日常生活技巧:自理能力明显进步,在个人领域(DQ:58vs35)和社区领域(DQ:64vs43)进步显著。④社会化:在人际关系、游戏与休闲、应对进退技巧3个次领域的进步均显著(标准分:69vs59),假想性游戏较前丰富,会主动和家长转述在学校发生的事情。监测体格发育:3次随访时患儿身高、体重均在中等偏上水平,头围在中等水平。第1、2、3次随访时患儿血浆中DHA含量依次上升至54.5 μg·mL-1、73.5 μg·mL-1、73.9 μg·mL-1。患儿父母的育儿压力总分第3次随访时与基线比较,父亲:103vs106,母亲:71vs88,压力分数下降更为明显。
2 讨论
PMS(OMIM:606232)较罕见,在神经发育障碍患者中占0.2%~0.4%[2-4],呈常染色体显性遗传。大多数PMS患者由22号染色体长臂远端部分缺失导致SHANK3单倍剂量不足;PMS还常涉及其他基因的丢失(最高可达108个[5]);约20%是由非平衡易位或环状22号染色体所致[4-7]。PMS的临床表型和严重程度异质性较大,主要特征包括全面发育迟缓、智力障碍、语言缺失或发育迟缓、肌张力减退、轻度颜面部畸形(包括长头畸形、额头饱满、面中部平坦、眼睛深陷、眼睑饱满或浮肿、长睫毛、宽鼻梁、球状鼻、脸颊饱满、大耳、肉质手、肉质脚等)、ASD等[8-10]。由于PMS临床表现复杂多样,缺乏特异性,故易被误诊。目前尚未建立PMS的临床诊断标准,其诊断是基于基因检测确定是22q13缺失或SHANK3基因杂合致病性变异。临床上,当患儿有新生儿期肌张力减退、语言发育延迟、发育迟缓、轻度颜面部畸形时,应进一步完善相关遗传学检测[10]。PMS的临床症状与其他遗传学异常所致的神经发育障碍性疾病之间存在重叠,包括肌张力低下、全面发育迟缓、语言障碍、颜面部畸形等[11],鉴别要点见表1。
80%的PMS患儿由22q末端缺失所致,缺失片段从<100 kb到>9 Mb不等[12, 13]。既往基因型-表型研究表明,PMS的临床特征与22q末端缺失片段大小有关。Sarasua等[13]在一项纳入201例PMS患者的研究中发现, 语言等能区的发育迟缓和大头畸形与缺失片段大小相关。另一项纳入71例PMS患者的研究[14]也表明,PMS的许多特征(包括语言/言语延迟、发育迟缓严重程度、新生儿期肌张力减退、行走年龄延迟等)与缺失片段大小相关。语言发育障碍是PMS最突出的特征,无语言与大片段缺失有关。Sarasua 等[14]报告,无语言患者在43.17~46.73 Mb缺失。Tabet等[4]认为断点接近 46 Mb 的患者比远端缺失较小的患者更容易失语。22q末端缺失和不包括SHANK3基因的22q中间缺失型之间无明显表型差异,提示这些中间缺失型可能对PMS的共同特征也有重要贡献[5, 15]。
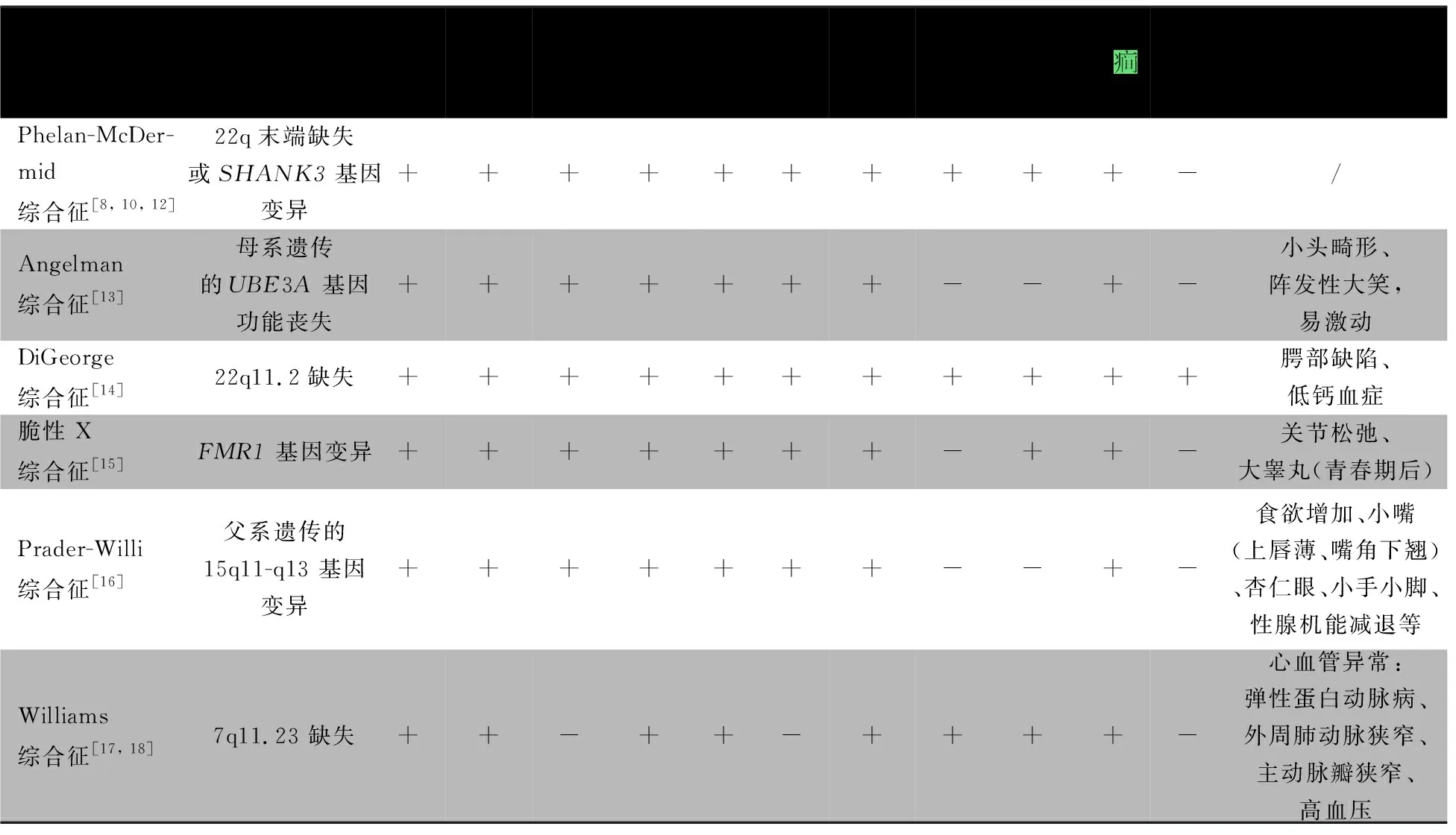
表1 PMS和其他综合征的鉴别诊断
SHANK3基因(OMIM:606230)变异已被确定为PMS神经学特征的关键候选基因[5, 16],其位于22q13.3,共包含22个外显子,编码谷氨酸能突触的突触后密度区的支架蛋白,在突触功能发挥中起关键作用(包括支架功能到调节树突棘形态和神经传递功能)[17, 18]。一般来说,相比22q13.3缺失的患者,点突变患者的语言障碍和运动障碍较轻微[19]。大多数SHANK3点突变的患者可说出单词,约41%的人至少能说短语。本文患儿为SHANK3缺失突变,末次随访时能说完整的句子,与既往的研究结论一致。
ASD是PMS最常见的行为合并症,占比>80%[9, 20, 21]。有研究发现,PMS患者中,合并ASD者的缺失片段明显小于不合并ASD者[13, 14],可能是由于更大的缺失会导致更严重的认知和行为障碍,从而掩盖ASD的表型[22]。越来越多的证据表明,人类SHANK3突变与 ASD之间具有强烈的因果关系[23, 24],是 ASD 最常见的单基因遗传原因之一[25]。SHANK3突变在 ASD 患者中占 0.69%,在进展到中-重度智力低下的ASD患者中高达 2.12%[8, 12]。尽管如此,SHANK3突变患者并非都能达到ASD诊断。既往研究表明,携带SHANK3突变的患者中,82%符合ADOS-2(ASD诊断的金标准)的ASD诊断标准,73%符合孤独症诊断访谈量表-修订版[27](ADI-R,也是ASD诊断的金标准)的ASD诊断标准,最终有73%达到ASD的共识诊断(包括基于DSM-5中ASD的标准化诊断标准[28]和临床诊断性评估:ADOS-2和ADI-R)[19]。本例患儿未诊断为ASD,提示携带SHANK3不同位点突变的患儿的临床表型存在一定的差异。SHANK3存在多个基因内启动子和选择性剪接[29],产生了多种类型的SHANK3转录本和异构体,从而增加了Shank3功能的复杂性。
对于SHANK3基因变异或PMS患者,目前尚无明确有效的针对遗传缺陷的治疗方法,仅予对症治疗[10],且对于治疗的有效性不甚明确,支持性证据来源于发育障碍和ASD的研究。行为干预有效且必要,必须针对患儿现有的发育年龄制定相应的个体化干预计划,并定期评估认知和行为特征,以达到最佳干预效果[6, 30]。
对本例SHANK3基因变异所致的PMS患儿,本课题组首次尝试在行为干预基础上予大剂量DHA口服,随访9个月,各能区的发育水平明显进步,血浆DHA水平显著上升,为此类患儿提供了一种新的干预思路。DHA是一种重要的营养性omega-3多不饱和脂肪酸[31],在突触膜中含量丰富,能够改变突触膜的流动性以及神经递质和受体的密度[32]。补充DHA对儿童和成人的认知发展很重要[33]。有证据表明,较高的DHA摄入可以减少精神分裂症、双相情感障碍、抑郁症、焦虑和行为障碍的风险,而DHA水平较低可能是精神类疾病潜在的危险因素[34]。近期研究表明,ASD患儿的红细胞、血清或血浆的DHA水平低于正常儿童[35, 36],且血浆DHA含量低与脑特异性自身抗体的血清水平升高存在关联[42]。服用DHA后,66%的ASD患儿有临床和生化指标方面有所改善[36]。动物模型提示,从出生起每天给小鼠补充 DHA 能够增加视觉皮层中兴奋性突触特化程度,促进突触连接和皮质成熟,增加神经网络的成熟度[37]。斑马鱼在出生前和整个生命过程中喂食富含 DHA 的食物不仅能减少惊厥发作,而且对神经有保护作用,这种保护作用会持续到下一代[38]。本课题组目前在SHANK3-KO斑马鱼模型[39, 40]中进行DHA药物干预的相关研究,以期获得DHA疗效更有力的证据,并进行机制探讨。
综上所述,本文报告的1例SHANK3基因新发变异患儿,丰富了SHANK3基因的变异谱,并显示行为干预训练结合大剂量DHA治疗可能成为一种新的干预思路。
本文患儿临床资料、照片等信息的使用均得到监护人的书面知情同意。 本研究通过复旦大学附属儿科医院科研伦理审批[复儿伦审(2020)446号]。

