DCE-MRI联合DWI在肾脏短T2信号肿瘤性病变定性诊断中的应用
胡海峰,王 影,刘 莹,张春宇,李国安,张天宇,董 波
(齐齐哈尔医学院附属第二医院影像科 黑龙江 齐齐哈尔 161006)
肾脏恶性肿瘤中透明细胞癌、乳头状肾癌、嫌色细胞癌占总体的95%以上。不同病理类型的肾脏肿瘤性病变的生物学特性差异很大,病变早期的精准诊断、合理治疗对患者的预后至关重要[1]。特别是对肾脏短T2信号肿瘤性病变良恶性的鉴别诊断,仍然是目前临床研究的难点[2]。常规的影像检查方法很难准确地鉴别病变的良恶性。磁共振具有高软组织分辨率、高空间分辨率等特点[3]。由于肾脏产生疾病后,组织内水分子的自由扩散受限及肿瘤微血管的不断生成,弥散加权成像(DWI)能够客观地反映肿瘤的水分子运动情况[4]。磁共振动态增强成像(DCE-MRI)能够有效反映组织血管分布及血流灌注情况[5],对肾脏短T2信号肿瘤性病变良恶性的定性诊断有很大帮助。因此,本研究探讨DCE-MRI联合DWI对肾脏短T2信号肿瘤性病变定性诊断的价值。
1 资料与方法
1.1 一般资料
选取2017年1月—2019年6月期间齐齐哈尔医学院附属第二医院收治的307例肾脏肿瘤患者,筛选出T2WI脂肪抑制序列显示为短T2信号肿瘤患者(病变短T2信号范围≥75%)137例,患者影像资料完整,并经手术或穿刺活检最终病理证实。137例患者中良性病变83例,包括男53例,女30例,年龄28~72岁,平均(45.77±4.16)岁,有嗜酸细胞腺瘤28例,乏脂肪血管平滑肌脂肪瘤55例;恶性病变54例,其中男38例,女16例,年龄22~74岁,平均(46.63±3.98)岁,包括肾透明细胞癌42例,乳头状细胞癌5例,嫌色细胞癌4例,尿路上皮癌3例。
纳入标准:①肾脏T2WI抑脂序列病灶最大横径≥75%区域为低信号;②无MR检查禁忌证,无钆造影剂过敏禁忌证,未治疗过;③经手术、活检病理最终证实病变;④具有完整影像资料者。排除标准:图像质量不佳,不能进行研究分析[6]。
1.2 方法
采用PHILIPS公司生产的ACHIEVA 1.5T超导型磁共振成像仪进行磁共振成像,扫描序列和参数:①T2WI采用脂肪抑制序列:TR 5 900~7 800 ms,TE 55~95 ms,层厚5 mm,间距1 mm,视野(FOV)38cm×38cm,矩阵320×224,回波链长度8。②DWI检 查:b值 为0、800 s/mm2,TR 5 800~9 800 ms,TE 50~80 ms;激励次数(NEX)1,FOV、层厚及间距同T2WI,后处理软件生成ADC图;手工勾勒感兴趣区(ROI),测量和计算表观扩散系数(ADC)、相对表观弥散系数(rADC)。③快速梯度回波序列,矩阵256×192,FOV、层厚及层间距同T2WI。④动态增强扫描:首先行T1WI抑脂序列预扫描TR 4.8 ms,TE 2.6 ms,42~48层,扫描每次屏气14~16s。造影剂选用钆喷酸葡胺,经高压注射器肘静脉团注,流率为2 mL/s,剂量0.1 mmol/kg[7]。造影剂注射后皮质期扫描时间为18~20 s,髓质期重复扫描3~5次,间隔时间5~10 s,5 min后扫描延迟期,并测量容量转移常数(Ktrans)、速率常数(Kep)、血管外细胞外间隙容积(Ve)。
1.3 统计学方法
采用SPSS 22.0统计软件进行数据分析,组间计量资料比较采用F检验,两两比较采用q检验,以()表示;计数资料以频数(n)、百分比(%)表示,行χ2检验。绘制受试者操作特征(receiver operator characteristic,ROC)曲线及测量曲线下面积(AUC),并计算相对应的特异度、敏感度及准确度;以P<0.05为差异有统计学意义。
2 结果
2.1 肾脏良、恶性病变组的ADC比较
恶性组的ADC值低于良性组,差异具有统计学意义(P<0.05),见表1。
表1 肾脏良性病变组和恶性病变组的ADC值比较(±s)
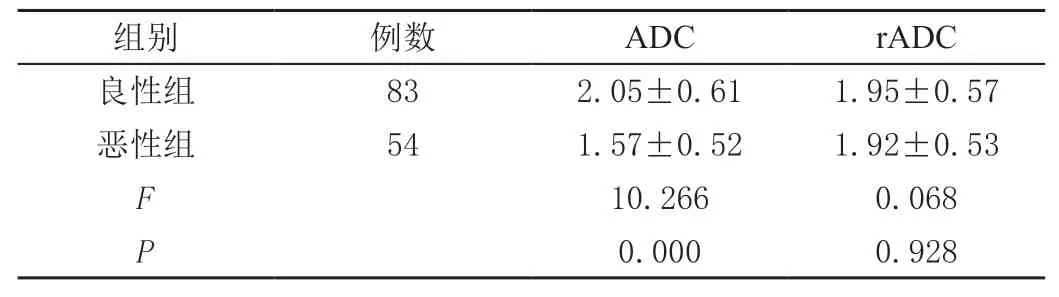
表1 肾脏良性病变组和恶性病变组的ADC值比较(±s)
组别 例数 ADC rADC良性组 83 2.05±0.61 1.95±0.57恶性组 54 1.57±0.52 1.92±0.53 F 10.266 0.068 P 0.000 0.928
2.2 肾脏良、恶性病变组的Ktrans、Ve、Kep比较
恶性组的Ktrans和Kep显著高于良性组(P<0.05);良性组和恶性组的Ve比较无显著差异(P>0.05),见表2。
表2 肾脏良性病变组、恶性病变组和对照组的Ktrans、Ve、Kep比较(±s)

表2 肾脏良性病变组、恶性病变组和对照组的Ktrans、Ve、Kep比较(±s)
组别 例数 Ktrans Ve Kep良性组 83 0.36±0.06 0.29±0.03 0.78±0.13 恶性组 54 0.69±0.11 0.28±0.04 0.89±0.18 F 159.386 9.876 16.328 P 0.000 0.000 0.000
2.3 DWI、DCE-MRI及两者联合诊断肾脏短T2信号肿瘤性病变的效能分析
对比ADC、Ktrans、Kep及联合诊断肾脏短T2信号肿瘤性病变的效能分析,见表3。
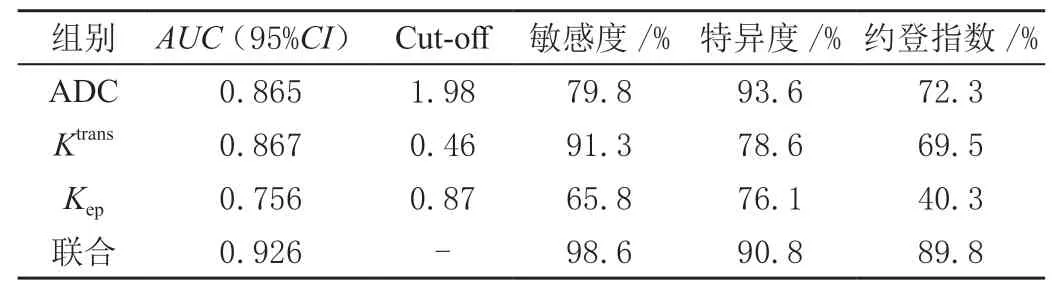
表3 DWI、DCE-MRI及两者联合诊断肾脏短T2信号肿瘤性病变的效能分析
3 讨论
早期肾癌通常无任何症状,当有症状时多数已处于疾病中晚期,所以,早期的精准诊断,对临床治疗方案的制定具有很大帮助[8]。近些年,保留肾脏的微创手术被逐步应用于临床当中,因此,精准的影像学诊断对手术方案的选择十分重要[9]。既往DCE-MRI在乳腺癌、前列腺癌的研究当中已被广泛应用,对肿瘤性病变的早期的定性诊断起到了重要的作用[10]。DWI是一种无创、可重复的检查方法,在中枢神经系统中应用广泛。而随着磁共振技术的不断发展,DWI序列现已广泛应用于腹部疾病当中[11]。
既往相关报道,肾脏的恶性肿瘤ADC值显著低于良性肿瘤[12],与本文的研究结果一致。ADC值反映组织内水分子扩散受限的程度,ADC值越低,代表扩散受限越明显[13]。本研究肾脏肿瘤所表现为短T2WI信号可能与细胞成分致密、细胞间隙较小、病灶出血等原因有关,水分子扩散明显受限,ADC值显著降低。针对ROC曲线结果分析,ADC值对肾脏短T2肿瘤病变鉴别诊断的灵敏度较高,但特异度较低。这可能与良性病变中的乏脂肪型血管平滑肌脂肪瘤中缺少脂肪成分,平滑肌成分较多,进而导致水分子扩散受限,使ADC值降低[14]。DCE-MRI扫描快速注入顺磁性造影剂后,造影剂可快速渗透到血管内、外细胞间隙,造影剂因电子偶极及质子自旋的作用,使附近质子弛豫增强,进而引起T1弛豫时间的变短[15]。通过Ktrans、Kep、Ve等参数的测量,从而来反映病变组织血管的通透性,进一步对病变的良恶性鉴别。目前,应用DCE-MRI联合DWI扫描对肾脏短T2信号肿瘤性病变良恶性的鉴别鲜有报道,本研究表明,恶性病变组的Ktrans和Kep显著高于良性病变组(P<0.05),ROC曲线分析则显示Ktrans、Kep对肾脏良、恶性病变的鉴别具有较高的诊断效能,而将Ktrans、Kep、ADC值三者联合应用,则具有更高的诊断效能。
综上所述,DCE-MRI联合DWI有助于肾脏短T2信号肿瘤性病变的准确诊断,通过ADC、Ktrans、Kep三者的联合,更有利于肾脏疾病良恶性的判定,值得在临床中广泛推广应用。

