8例宫颈淋巴上皮瘤样癌临床分析*
郭传家,王睿聪,冯 璐,孔繁斗,吕恽怡,修晓新,高 娜*
(大连医科大学附属第一医院 a.妇产科;b.病理科,大连 116011)
淋巴上皮瘤样癌(lymphoepithelioma-like carcinoma,LELC)是指发生在鼻咽部以外,形态学特点与鼻咽未分化癌相似的一类特殊类型肿瘤。发生于宫颈的LELC较为少见,占所有宫颈癌的比例不足1%[1]。目前关于宫颈LELC的病例报道仅百余例,且以个案为主,尚无统一治疗规范。本文通过回顾分析8例宫颈原发LELC的病例资料,探讨宫颈LELC的临床特征、诊治情况及预后。
1 资料与方法
1.1 研究对象 回顾分析大连医科大学附属第一医院妇产科于2017年1月至2018年12月收治的8例宫颈LELC的病例资料。采用2020年WHO发布的第5版《女性生殖器官肿瘤分类》的分类标准,所有病例均经2名副高级职称以上病理医师确诊。回顾分析肿瘤病理特征,包括肿瘤大小、位置、分化程度、浸润深度、手术切缘、宫旁受累、淋巴血管间隙、淋巴结转移等。
1.2 病理检查 标本经10%福尔马林固定,常规石蜡包埋,4μm切片及HE染色。免疫组化染色包括:p63、p16、CK5/6、Ki-67等。采取EBV编码小RNA探针原位杂交方法检测EBER。
1.3 术后随访 随访以手术时间为起点,通过门诊及电话等方式进行随访,截至2022年2月,无失访病例。术后2年内,每3个月复查1次,术后2年以上,每6个月复查1次。复查的项目包括妇科检查、液基细胞学、鳞癌抗原、超声及全腹增强CT检查。
2 结 果
2.1 临床特征 8例宫颈LELC病例均经病理确诊,占同期宫颈癌病例总数的3.8%。发病年龄33~71岁,中位年龄54.5岁。根据FIGO 2021临床分期,Ⅰa期2例(Ⅰa1期、Ⅰa2期各1例),Ⅰb期6例(Ⅰb1期、Ⅰb2期、Ⅰb3期各2例)。2例Ⅰa期为无症状体检发现,6例Ⅰb期以接触性出血或绝经后阴道出血为首发症状。
除2例Ⅰb3期外,其余6例术前均行TCT及HPV检测。其中TCT阳性者4例,包括ASCUS 2例,LSIL 1例,HSIL 1例。HPV阳性者5例,包括HPV16阳性3例,HPV18阳性1例,HPV16、HPV18混合感染1例,HPV阴性者1例。8例均行宫颈活检,2例Ⅰa期活检病理结果为HSIL,CIN 3级累及腺体。其余6例结果为低分化鳞状细胞癌,包含1例活检病理倾向宫颈LELC。
2.2 治疗经过 全部病例均行手术治疗。Ⅰa1期病例有生育要求,仅行宫颈锥形切除术。Ⅰa2期术前宫颈活检病理为HSIL,直接行腹腔镜下全子宫双附件切除术,因无淋巴脉管浸润、手术切缘及影像学均阴性、心内科合并症等因素,未补充手术及放疗。2例Ⅰb2期行腹腔镜下广泛性子宫切除术+双侧附件切除术+盆腔淋巴结清扫术,其余4例Ⅰb期行开腹广泛性子宫切除术+双侧附件切除术+盆腔淋巴结清扫术。根据Sedlis标准,2例Ⅰb3期术后需辅助放疗,但因个人原因均未放疗。
2.3 病理结果 手术标本:宫颈外观正常者1例,仅见肥大者1例,呈轻度“糜烂”1例,5例呈菜花状、膨胀性生长,宫颈肌层浸润性增厚。镜检:未分化的肿瘤细胞呈合胞体样生长,巢状或条索状分布,核分裂易见,周围见丰富的淋巴细胞及浆细胞浸润,间质少,缺少腺体分化、胞间桥、角化等分化表现。癌细胞体积大、形态较均一,核浆比值大,胞质淡染,细胞核深染、空泡状、核膜不规则、核仁明显。肿瘤局限在宫颈,无宫旁侵犯、淋巴脉管浸润及盆腔淋巴结转移。免疫组化:2例Ⅰa期病灶较小,未行免疫组化检查。其余6例主要免疫组化结果:p63(+),p16(+),CK5/6(+),Ki-67指数60%~70%。分子病理:EBER(原位杂交法)均阴性。见图1。
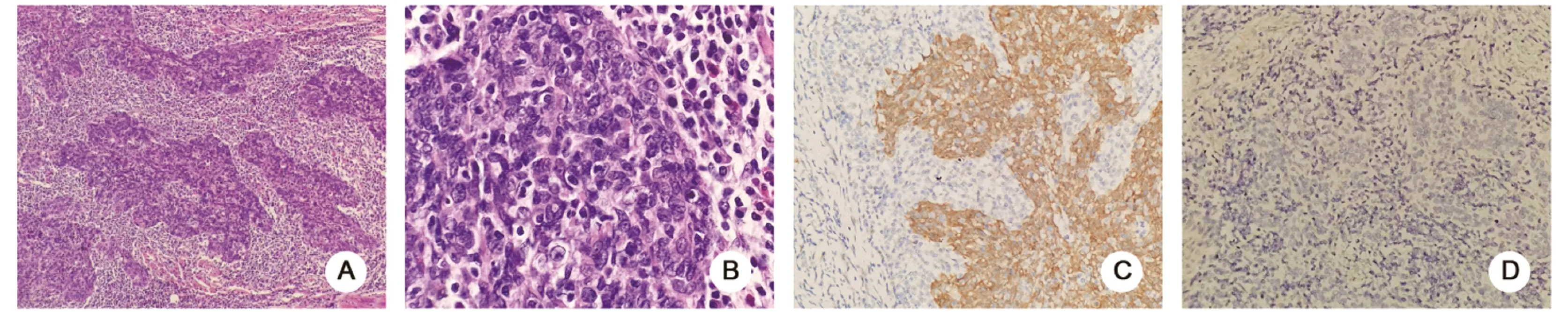
图1 病理检查A:癌细胞呈巢状或条索状分布,周围见丰富淋巴、浆细胞浸润(HE×10);B:癌细胞体积较大,胞质淡染,细胞界限不清,胞浆丰富,核膜清楚,嗜酸性核仁突出,呈合胞样(HE×40);C:免疫组化染色p16强阳性(IHC×20);D:EBER染色阴性(ISH×20)
2.4 随访结果 全部病例均在访,随诊38~50个月,平均43.1个月,无复发及死亡病例。
3 讨 论
3.1 流行病学 1968年,Hamazaki等首次报道了宫颈LELC,称其为“具有良好预后的富含淋巴细胞浸润的宫颈髓样癌”。其病理诊断标准与其他部位LELC一致,包括“合胞体样未分化细胞”及“间质内富含淋巴细胞、浆细胞浸润”,是宫颈鳞癌的一种少见亚型。文献报道,宫颈LELC发病率存在显著的种族和地理差异,在东亚人群中,宫颈LELC占全部宫颈癌的5.5%,而西方人群中仅占0.63%[2]。宫颈LELC与其他类型宫颈癌的平均发病年龄分别为43.5岁和48.6岁,低于40岁者占比分别为41.0%和28.2%,表明宫颈LELC发病具有年轻化的特点[3]。本文报道宫颈LELC占宫颈癌病例总数的3.8%,与我国台湾地区和日本报道结果相符,但中位发病年龄54.5岁,高于文献报道。
3.2 病因机制 鼻咽部、肺、胸腺、唾液腺、胃等部位LELC已被证实与EB病毒感染密切相关,但宫颈LELC病因尚不明确[1]。由于各项研究的人群、取材方法和检测技术存在差异,研究结论并不一致。亚洲人群中的一项回顾队列研究中,采用PCR检测肿瘤组织中EBV,宫颈LELC组EBV感染率为73.3%,而HPV感染率仅为26.7%,但在其他类型宫颈鳞癌中HPV感染常见而EBV感染少见,推断EBV可能为宫颈LELC的致病因子[4]。然而,多项西方人群宫颈LELC病例报道中,HPV感染常见,而EBV少见[5-6]。进一步研究表明,EBV主要存在于肿瘤周围的淋巴细胞中,但含量较低,故PCR检测EBV阳性率较高,而原位杂交法检测常为阴性。因此,宫颈LELC病因机制及其与EBV、HPV的关系有待进一步研究。
3.3 临床诊断 宫颈LELC的临床表现无特异性,与其他类型宫颈鳞癌相似,多以异常阴道出血就诊,或无症状体检发现。宫颈外观可有正常、“糜烂”、菜花状肿物等表现。肿瘤呈浸润性、膨胀性生长,质脆,易有接触性出血,晚期可发生淋巴结、骨及肝脏转移[7]。由于病例较少,经验不足,术前诊断困难,主要依赖术后病理诊断[6,8-9]。回顾分析宫颈LELC的巴氏及液基细胞学制片发现,其具有较典型的合胞样生长的未分化细胞簇,肿瘤细胞周围可见大量淋巴及浆细胞浸润的炎性改变及出血背景,为细胞学筛查发现宫颈LELC提供了新思路[8-10]。宫颈LELC病例HPV感染主要以HPV16、18型为主,亦有HPV31、33、35、45、58型及混合感染[2,6]。受取材限制,大多数活检报告为低分化鳞状细胞癌,本文仅1例活检报告LELC。因此,提高临床医生对本病的认识,重视术前病理诊断,有利于制定更科学合理的治疗方案。
3.4 治疗与预后 同其他部位LELC类似,尽管宫颈LELC分化差,但其具有分期早、淋巴结转移率低等特点,预后优于其他类型的宫颈癌[11]。据统计,Ⅰb期病例占病例总数的80.4%,而Ⅱa、Ⅱb期病例仅占8.7%和10.9%[5]。在已报道的病例中,淋巴结转移少见[2]。Takebayashi等报道的1例直径达6cm局部晚期宫颈LELC,病灶侵及宫颈肌层全层,仍无淋巴转移及术后复发[12]。Tseng等报道了15例宫颈LELC,包括9例Ⅰb期、2例Ⅱa期、4例Ⅱb期,采取手术或放疗,随访1.8~5.3年,未见转移及复发[4]。Chao等报道了9例Ⅰb期宫颈LELC和25例其他类型宫颈鳞癌,采取手术联合放疗的治疗方式,随访63~134个月,宫颈LELC组术后均未见复发,预后优于其他类型鳞癌[13]。Yun等总结了82例Ⅰb1~Ⅱa期宫颈LELC病例,行手术±放化疗治疗,随访3~112个月,仅1例Ⅰb1期病例于术后24个月出现盆腔淋巴结复发,余未见复发及死亡病例[2]。多数研究推测,肿瘤诱导的细胞免疫及体液免疫,可解释这一低分化类型的良好预后[5-6]。与以上观点不同的是,Yordanov等随访了17例宫颈LELC病例,包括14例Ⅰb1期和3例Ⅰb2期病例,采取手术±放疗的治疗方式,淋巴转移比例为17.6%,5年生存率仅为69.23%,2例术后出现骨转移及肝转移,与其他研究报道的较低淋巴转移率和较高生存期不符[7]。本文报告的8例Ⅰa1~Ⅰb3宫颈LELC病例,均行手术治疗,随诊3年以上,无复发病例,更加支持宫颈LELC预后优于其他类型宫颈鳞癌的结论。
综上所述,宫颈LELC是宫颈鳞癌的一种少见病理亚型,其病因尚不明确,发病存在显著的地域及种族差异。宫颈LELC临床表现无特异性,主要依靠组织病理确诊。由于病例数少,治疗多参照其他类型宫颈鳞癌,尽管其分化低,但淋巴结转移率低,总体预后通常较好。

