TLR2/4、NOD1/2受体在ETEC感染猪肠道上皮细胞炎性反应中作用的研究
李雪滢,韩阳春,黄 静,李 霞,曾 聪,肖 乐,刘峻源,曾雯玉,彭远义*,王自力
(1.西南大学动物医学院,重庆 北碚 400715;2.浙江大学动物科学学院,浙江 杭州 310030)
断奶仔猪生长速度较快、饲料转化率最高,处于快速生长发育时期[1]。然而,断奶后由于仔猪发育不全,肠道内微生态环境不够稳定,常因断奶应激造成产肠毒素大肠杆菌(ETEC)等病原菌感染而发生断奶腹泻(PWD)[2-4]。研究表明,ETEC 可黏附在猪小肠上皮,分泌肠毒素,使电解质和水分过多分泌到肠腔中造成严重腹泻,引起宿主一系列免疫反应,导致仔猪严重的肠道炎性反应和饲料转化率降低[5]。还有研究表明,携带F4+菌毛的ETEC 通过与受体结合可特异性黏附到猪肠道上皮细胞IPECJ2,并诱导细胞发生炎性反应[6-8]。同时,宿主细胞中的模式识别受体(Pattern recognition receptors,PRR)在抗感染和固有免疫过程中有重要作用,其中Toll 样受体(Toll-like receptors,TLR)和核苷酸结合寡聚结构域样受体(NOD 样受体也即Nucleotide binding oligomerization domain-like receptors,NLR)分别作为胞外和胞内模式受体在病原菌感染中发挥重要作用[9],如TLR2 和TLR4 均可通过特异性识别病原菌向细胞内传递信号,激活核因子,致促炎性细胞因子基因的转录,进而诱发一系列炎症反应;而NOD 样受体是一类胞浆内的免疫模式识别受体,如NOD1 和NOD2 可通过与配体结合后,与受体相互作用蛋白2(Receptor interacting protein 2,RIP2)作用磷酸化IκB,进而激活转录因子NF-κB,介导炎症介质的表达[10]。研究表明,ETEC 可诱导小鼠回肠细胞NOD2 受 体、RIP2、TGE-β 激 活 的 激 酶1(TAK1)mRNA 转录水平的升高,并可提高NF-κB p65 蛋白的表达水平[11]。
为了明确ETEC 感染IPEC-J2 后TLR2/4、NOD1/2 受体及其下游促炎性细胞因子的转录水平,并探究TLR2/4、NOD1/2 在ETEC 感 染IPEC-J2 中 的 作用,本研究采用F4+ETEC 感染IPEC-J2,检测ETEC感染IPEC-J2 后TLR2/4、NOD1/2 细胞受体及相关促炎性细胞因子mRNA 转录水平的变化,为ETEC 诱导的TLR2/4 及NOD1/2 受体的作用机制研究提供实验依据。
1 材料与方法
1.1 主要实验材料ETEC CVCC196 株、O8:H19:K88ac 购自中国兽医微生物菌种保藏管理中心。猪肠道上皮细胞(IPEC-J2)由本实验室保存。
DMEM/F12 培 养 基(11330-057)、胎 牛 血 清(1315148)、0.25%胰蛋白酶(1572281)均购自美国GIBCO 公司;PBS(BF-0011)购自北京鼎国昌盛生物公司;Total RNA Isolation Kit(RC101)、HiScript ⅢRT SuperMix for qPCR(R323-01)、ChamQ Universal SYBR qPCR Master Mix(Q711-02)均购自南京诺唯赞公司;MTT(Lot#2464C186)购自美国Sigma 公司;TLR2/4 受体混合抑制剂AMG-9810(S6934)、NOD1/2 受体混合抑制剂NOD-IN-1(S0004)购自Selleck公司。
1.2 ETEC 感染IPEC-J2 后细胞活力的检测将IPEC-J2 按5×104个/mL 铺 于96 孔 细 胞 培 养 板 中,于37 ℃、5% CO2过夜培养后,分别按MOI 0.1、0.02、0.01 比例向各孔内加入10 μL、50 μL、100 μL 1×107cfu/mL ETEC菌液,并加入100 μL无血清及双抗的DMEM/F12 基础培养基作为感染组,设不加ETEC菌液,只加100 μL无血清及双抗的DMEM/F12基础培养基的IPEC-J2 为阴性对照组;以含DMEM/F12 基础培养基,但不含细胞的培养孔为空白对照组。每组3 个重复。于37 ℃、5% CO2培养2 h 后,采用MTT法[12]检测ETEC感染IPEC-J2后的细胞活力。细胞活力(%)=(感染组OD490nm平均值-空白对照组OD490nm平均值)/(阴性对照组OD490nm平均值-空白对照组OD490nm平均值)×100%;利用Graphpad prism 7.0软件计算ETEC感染IPEC-J2 后的细胞活力,从而确定ETEC 感染IPEC-J2 细胞增殖的半数抑制浓度(IC50)(即ETEC 感染致IPEC-J2 细胞活力达到50%时的浓度)。
1.3 ETEC 感染对IPEC-J2 中的TLR2/4、NOD1/2及相关细胞因子转录水平影响的检测按照1.2 的方式将IPEC-J2 铺板、培养。根据1.2 的结果,感染组(ETEC 组)各孔按最优MOI 0.01 加入500 μL ETEC菌液(不含血清及双抗),对照组(CON 组)仅加入不含血清及双抗的DMEM/F12 基础培养基,每组3 个重复,于37 ℃、5% CO2中分别培养30 min、60 min、105 min 和120 min(预试验结果显示,这几个时间点IPEC-J2 中细胞因子转录水平差异较显著),之后弃掉上清液收集孔内细胞。根据GenBank 中猪TLR2、TLR4、NOD1、NOD2 基因序列,利用Primer 5 软件设计引物(表1)。采用Total RNA Isolation Kit 提取细胞总RNA,反转录为cDNA 后作为模板,采用表1中的引物,经荧光定量PCR(qPCR)检测上述各基因的转录水平,采用2ΔΔCt法计算各基因的相对转录水平。相对转录水平=2ΔΔCt,ΔΔCt=实验组(目的基因Ct 值-内参基因Ct 值)-对照组(目的基因Ct 值-内参基因Ct 值)。
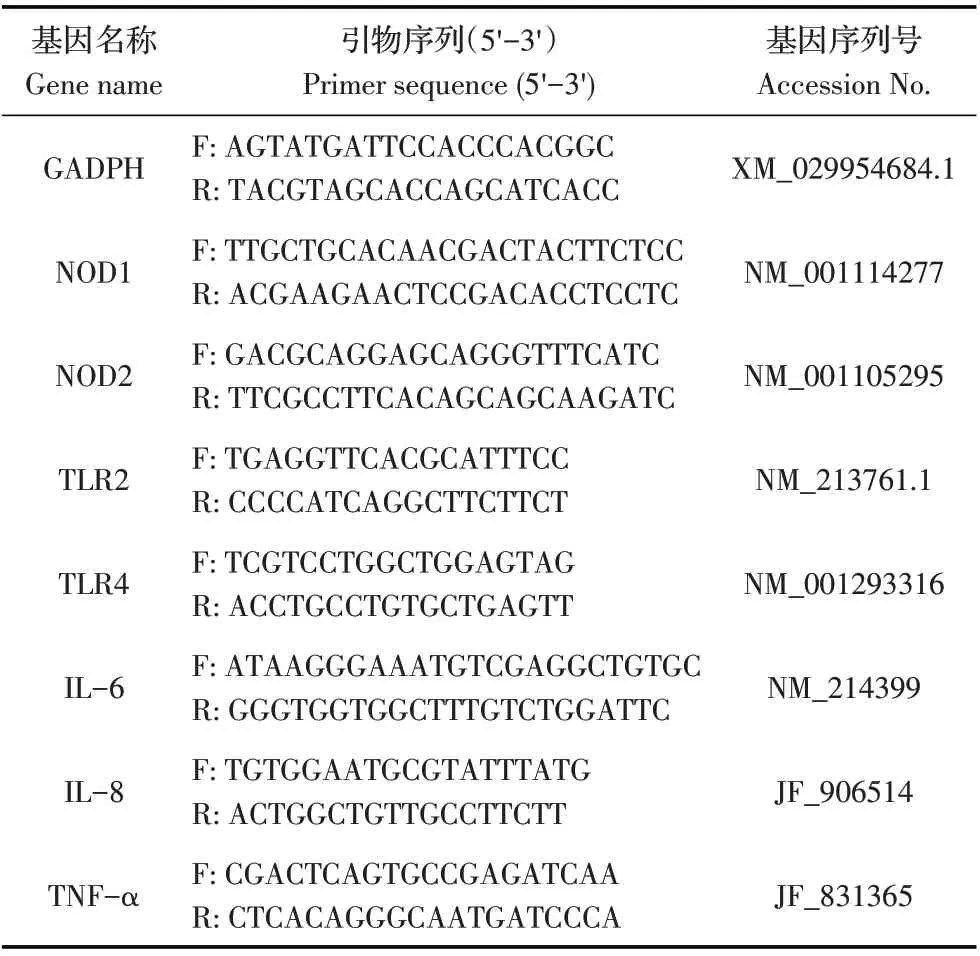
表1 目的基因扩增的引物信息Table 1 Primer sequence of target gene amplification
1.4 TLR2/4 及NOD1/2 受体抑制剂对ETEC 感染的IPEC-J2 中TLR2/4、NOD1/2 及相关细胞因子转录水平影响的检测向12 孔板培养的IPEC-J2 中分别加入500 μL 5 μmol/L TLR2/4 受体混合抑制剂AMG-9810、10 μmol/L NOD1/2 受体混合抑制剂NOD-IN-1,各6 个重复。置于37 ℃、5% CO2预先作用6 h,弃培养基后,从上述各组中各选3 个孔按照MOI 0.01加入1 mL(1×107cfu/mL)ETEC 菌悬液,于37 ℃、5%CO2培养2 h。设无抑制剂和ETEC 的细胞为对照组(CON 组),无抑制剂但感染ETEC 的细胞为感染组(ETEC 组),添加抑制剂但不感染ETEC 的细胞为对照+抑制剂组(CON+IN 组),既添加抑制剂又感染ETEC 的细胞为感染+抑制剂组(ETEC+IN 组)。之后收获各组细胞,参照1.3 方法,经qPCR 检测IPEC-J2 TLR2/4、NOD1/2、IL-6、IL-8 及TNF-α mRNA 的转录水平,采用2ΔΔCt法计算各基因的相对转录水平。
1.5 数据的分析及处理实验数据均以平均值±标准差(-x±s)形式表示,利用SPSS 19.0 软件进行单因素方差分析(One-way ANOVA)并对数据进行统计学分析,*:P<0.05 表示差异显著,**:P<0.01 及***:P<0.001 表示差异极显著;采用Graphpad prism 7.0 软件绘图。
2 结 果
2.1 不同浓度ETEC 感染对IPEC-J2 活力影响的检测结果分别按MOI 0.1、0.02 及0.01 的比例将ETEC 菌悬液加入IPEC-J2 2 h 后,通过MTT 法分析不同浓度ETEC 感染对IPEC-J2 活力的影响及测定IC50。结果显示,IPEC-J2 经不同MOI 的ETEC 感染2 h 后,根据测得的OD490nm值计算得到各组细胞的活力。结果显示,当ETEC 的MOI 为0.01 时,IPEC-J2的活力极显著低于CON组(P<0.001),可达到IPEC-J2的半数抑制浓度IC50(1×107cfu/mL 1 mL ETEC 菌悬液);而当MOI为0.1及0.02时,IPEC-J2的活力与CON组无显著差异(P>0.05)(图1)。因此采用MOI 0.01、感染时间为2 h作为ETEC 感染IPEC-J2 的最适条件。

图1 不同浓度ETEC感染对IPEC-J2活力影响的检测结果Fig.1 Effect of ETEC at different concentrations on porcine intestinal epithelial cells
2.2 ETEC 感 染 后 对IPEC-J2 中TLR2/4 及NOD1/2转录水平的检测结果按MOI 0.01 将ETEC 菌液加入IPEC-J2中分别作用不同时间后,经qPCR检测细胞中TLR2、TLR4、NOD1、NOD2 受体的转录水平。结果显示,与CON 组相比,ETEC 感染的IPEC-J2 TLR2 受体mRNA 转录水平在感染后30 min 和120 min 时均极显著升高(P<0.01、P<0.001),其余时间段二者无显著差异;IPEC-J2 TLR4 受体mRNA 转录水平在感染后105 min 及120 min 均极显著升高(P<0.01),其余时间段均与CON 组无显著差异。与CON 组相比,IPEC-J2 NOD1受体mRNA转录水平在感染后60 min开始极显著升高(P<0.001),于120 min 时达到峰值;NOD2 受体mRNA 转录水平在感染后30 min~120 min时均极显著升高(P<0.01)(图2)。上述结果表明,ETEC 感染IPEC-J2 后可分别于不同时间促进胞外受体TLR2/4 及胞内受体NOD1/2 mRNA 的转录水平。

图2 ETEC感染IPEC-J2后不同时间TLR2/4、NOD1/2受体mRNA转录水平的检测结果Fig.2 The transcription level of TLR2/4 and NOD1/2 in IPEC-J2 infected with ETEC at different times
2.3 ETEC 感染IPEC-J2 后促炎性细胞因子转录水平的检测结果按MOI 0.01 将ETEC 菌液感染IPECJ2 后30 min、60 min、105 min 和120 min,分 别 经qPCR 法检测其中的促炎性细胞因子IL-6、IL-8、TNF-α 的转录水平。结果显示,与CON 组相比,ETEC 感染后30 min~120 min,IPEC-J2 中TNF-α 的转录水平均极显著升高(P<0.001),而IL-6、IL-8的转录水平在感染后60 min、105 min、120 min时均极显著高于CON 组(P<0.01、P<0.001),感染30 min 时则与CON组无显著差异(P>0.05)(图3)。上述结果表明ETEC 诱导IPEC-J2 发生了炎性反应。

图3 ETEC感染IPEC-J2不同时间后IL-6、IL-8、TNF-α mRNA转录水平的检测结果Fig.3 The mRNA transcription levels of IL-6,IL-8 and TNF-α in IPEC-J2 infected with ETEC at different times
2.4 TLR2/4 受体抑制剂对ETEC 感染IPEC-J2 中的TLR2/4及细胞因子转录水平影响的检测结果IPECJ2 经TLR2/4 受体混合抑制剂AMG-9810 作用6 h 后 以MOI 0.01 感 染ETEC 菌 液,2 h 后经qPCR 检测细胞 中TLR2/4 受体及细胞因子的转录水平。结果显示,与CON组相比,与TLR2/4混合抑制剂AMG-9810作用6 h后,CON+IN 组IPEC-J2 中的TLR2 mRNA 转录水平显著降低(P<0.05),TLR4 mRNA 转录水平极显著降低(P<0.01);再经ETEC 感染2 h 后,与ETEC 组相比,ETEC+IN 组IPEC-J2 中的TLR2 转录水平极显著降低(P<0.01),TLR4转录水平显著降低(P<0.05)(图4)。
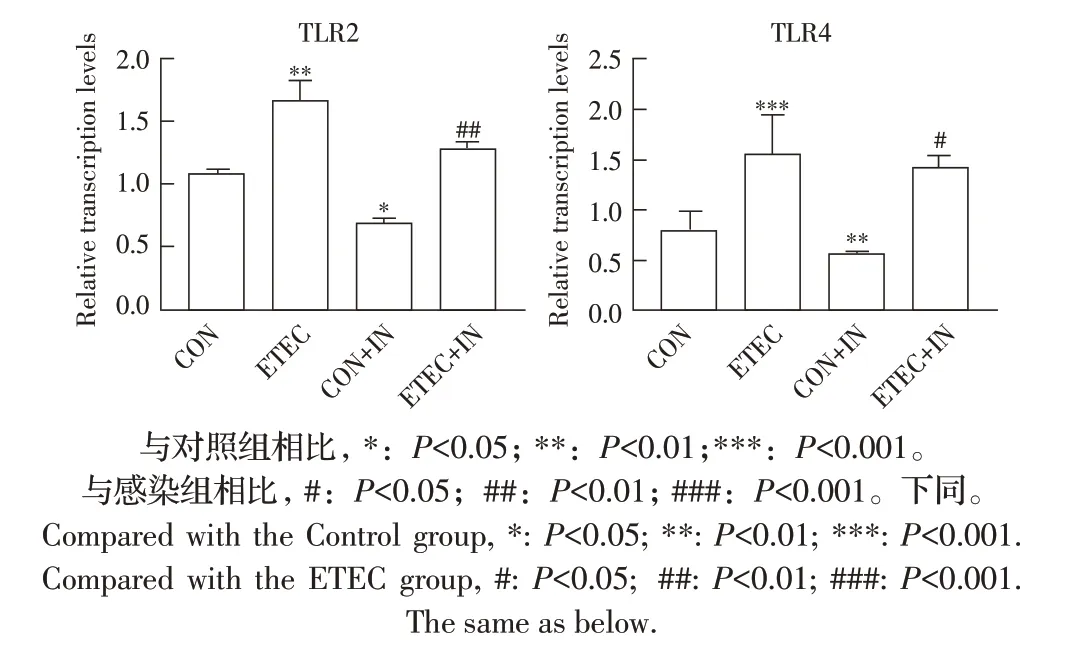
图4 AMG-9810抑制剂对IPEC-J2中TLR2/4 mRNA转录水平影响的检测结果Fig.4 Effect of inhibitor AMG-9810 on transcriptional level of TLR2/4 in porcine intestinal epithelial cells
细胞因子转录水平检测结果显示,TLR2/4转录水平显著降低后,ETEC+IN 组下游促炎性细胞因子IL-6、IL-8 和TNF-α 转录水平与ETEC 组相比均极显著降低(P<0.01、P<0.001)(图5)。

图5 AMG-9810抑制剂对IPEC-J2中细胞因子mRNA转录水平影响的检测结果Fig.5 Effect of inhibitor AMG-9810 on transcriptional level of some cytokines in porcine intestinal epithelial cells
上述结果进一步表明ETEC 感染IPEC-J2 后可以激活其胞外受体TLR2/4,从而诱导下游炎性细胞因子的转录。
2.5 NOD1/2 受体抑制剂对ETEC 感染IPEC-J2 中NOD1/2 及细胞因子转录水平影响的检测结果添加500 μL浓度为10 μmol/L的NOD1/2混合抑制剂NODIN-1与IPEC-J2作用6 h后,经qPCR检测NOD1/2的转录水平,结果显示,IPEC-J2 经抑制剂作用6 h 后,CON+IN组的NOD1 mRNA转录水平与CON组相比极显著降低(P<0.001),NOD2 mRNA 转录水平与CON 组相比显著降低(P<0.05);再经ETEC感染后,ETEC+IN组的NOD1 mRNA 转录水平与ETEC 组相比极显著降低(P<0.001),NOD2 mRNA 转录水平与ETEC 组相比显著降低(P<0.05)(图6)。

图6 NOD-IN-1抑制剂对IPEC-J2中NOD1/2 mRNA转录水平影响的检测结果Fig.6 Effect of inhibitor NOD-IN-1 on transcriptional level of NOD1/2 in porcine intestinal epithelial cells
细胞因子转录水平检测结果显示,NOD1/2受体转录水平被抑制后,ETEC+IN 组下游促炎性细胞因子IL-6、IL-8和TNF-α转录水平与ETEC组相比均极显著降低(P<0.001)(图7)。
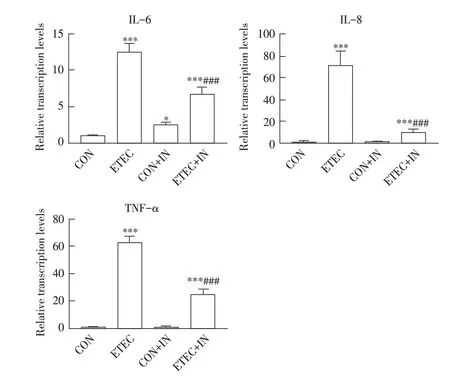
图7 NOD-IN-1抑制剂对IPEC-J2细胞中因子转录水平影响的检测结果Fig.7 Effect of inhibitor NOD-IN-1 on transcriptional level of some cytokines in porcine intestinal epithelial cells
上述结果进一步表明ETEC 感染IPEC-J2 后可以激活其胞内受体NOD1/2,进而诱导下游炎性细胞因子的转录。
3 讨 论
现有研究表明,IL-6、IL-8 及TNF-α 均为促炎性细胞因子,可诱导组织细胞严重的炎性反应。其中,IL-6 引起细胞的急性期反应,且通过终末期B细胞的分化,免疫球蛋白的分泌和T 细胞的活化而导致特异性细胞和体液免疫反应[13];IL-8 具有多种促炎作用,包括促进中性粒细胞粘附、趋化和溶酶体的排出[14-16];TNF-α 能够促进多种细胞增殖或发出凋亡信号,在炎症和免疫反应中起核心作用[17]。此外,ETEC 感染可引起猪肠道组织的促炎性细胞因子(如TNF-α 和IL-6)的过度产生,从而降低紧密连接蛋白(Tight junction,TJ)的表达并损害肠道的完整性[18]。本研究结果也显示,随着ETEC感染时间的延长,IPECJ2中的TNF-α、IL-6和IL-8 mRNA 转录水平均呈极显著升高,表明ETEC诱导细胞发生了炎性反应。
肠上皮细胞(IEC)存在病原体的专门模式受体(PRR),如膜结合的TLR 和NLR[19]。其中,TLR4 是巨噬细胞的重要PRR,在炎症过程中起关键作用[20-21]。有研究表明,经LPS作用后,TLR4随后激活其下游信号,包括细胞外信号调节激酶(ERK)1/2[22]、MyD88/NF-κB/MAPK[23]和PI3K/Akt,从而导致炎性细胞因子的产生;NODs 样受体N 端的半胱天冬酶募集结构域(CARD)也可结合并激活受体作用蛋白2(RIP2),使IκB 磷酸化,最终均激活转录因子NF-κB,通过NFκB和MAPK信号通路介导下游炎性细胞因子的表达[24]。
本研究结果显示,ETEC 感染IPEC-J2 后不同时间TLR2/4 受体转录水平均极显著升高;NOD1 受体转录水平在感染后60 min 也极显著升高,且于120 min时达峰值,而NOD2 受体转录水平于感染后30 min即达到峰值,但之后随感染时间延长其转录水平逐渐降低;另外,IPEC-J2 细胞中的IL-6、IL-8 及TNF-α转录水平随着感染时间的延长则显著升高。由此可知,ETEC 感染IPEC-J2 后,可分别激活细胞外受体TLR2/4,同时还激活细胞内NOD1/2 受体,分别通过TLR2/4-NF-κB 及NOD1/2-RIP2-NF-κB 信号通路进一步诱导猪肠道上皮细胞促炎性细胞因子的转录。在分别添加TLR2/4 混合抑制剂AMG-9810 及NOD1/2混合抑制剂NOD-IN-1 分别与IPEC-J2 共作用6 h后,细胞中的TLR2/4 及NOD1/2 mRNA 转录水平均显著下降,再经ETEC 感染后,IPEC-J2 中的TLR2/4、NOD1/2 转录水平同样显著或极显著低于ETEC 组,且下游促炎性细胞因子IL-6、IL-8 及TNF-α mRNA转录水平也受到抑制。由此表明,ETEC 感染IPECJ2 过程中,胞外受体TLR2/4 及胞内受体NOD1/2 被激活,进而诱导下游促炎性因子转录水平的提高。

