小黄鱼海豚链球菌的分离鉴定
徐 伟,施 慧,汪 玮*,张鼎元,许文军,柴学军
(1.浙江海洋大学水产学院,浙江 舟山 316022;2.浙江省海洋水产研究所浙江省海水增养殖重点实验室,浙江 舟山 316021)
小黄鱼(Larimichthys polyactis),隶属于石首鱼科(Sciaenidae)、黄鱼属(Larimichthys),暖温性近底层鱼类,广泛分布于黄海、渤海、东海以及朝鲜半岛西岸等海域,是我国四大海产之一[1]。随着其人工养殖规模的扩大,病害问题日益突出。本研究室近年来先后从网箱养殖小黄鱼中分离到杀香鱼假单胞菌(Pseudomonas plecoglossicida)、虹彩病毒(Iridoviruses)、淀粉卵甲藻(Amyloodinium ocellatum)、刺激隐核虫(Cryptocaryon irritans)、盾纤毛虫(Scuticociliatida ciliates)等石首鱼科常见病原。
海豚链球菌(Streptococcus iniae)是一种重要的水生动物病原菌,主要引起鱼类脑膜炎和败血症等[2]。海豚链球菌宿主广泛,现已报道的感染海豚链球菌的鱼类多达30 余种,其中包括罗非鱼(Tilapia)[3]、黄颡鱼(Pelteobagrus fulvidraco)[4]、牙鲆(Paralichthys olivaceus)[5]、尖 吻 鲈(Lates calcarifer)[6]、卵 形 鲳 鲹(Trachinotus ovatus)[7]、高首鲟(Acipenser transmontanus)[8]等重要的淡水及海水经济鱼类。但迄今为止,尚未见小黄鱼感染海豚链球菌的报道。
2020 年9 月,舟山地区网箱养殖小黄鱼出现持续性死亡,一周内累计死亡率达20%,发病鱼主要症状与海豚链球菌感染症状相似,表现为体色发黑,眼周充血或眼球突出,鳍条出血,解剖可见脑和肝脏部位严重充血。本研究对采集的小黄鱼发病样品进行病原学及组织病理学分析,以期查明该暴发性疾病的病因,为网箱养殖小黄鱼的病害防控提供参考依据。
1 材料与方法
1.1 主要实验材料50 余尾患病小黄鱼来自舟山登步岛小黄鱼网箱养殖点;健康小黄鱼由浙江省海洋水产研究所西轩实验基地育苗车间提供,体长15 cm~20 cm,平均体质量50 g~75 g,实验前随机取5 尾鱼进行细菌、病毒和寄生虫检测,确认无病原携带。
血琼脂培养基购自广东环凯生物科技有限公司;常规胰蛋白胨大豆琼脂(TSA)细菌培养基和药敏纸片购自杭州微生物试剂有限公司;10×ExTaqBuffer(2.5 mmol/L),ExTaq酶(5 U/μL)、DL2000 DNA Marker、细菌基因组提取试剂盒均购自TaKaRa 公司;API 20 Strep 试剂盒购自生物梅里埃法国股份有限公司;MS-222购自河南南华千牧生物科技有限公司。
1.2 发病小黄鱼的组织病理学观察取自然发病有典型病征的濒死小黄鱼的脑、肝、脾、肾组织,切成约0.5 cm×1 cm×0.5 cm 的小块,Bouin 氏液固定24 h,经75%乙醇冲洗数次后利用梯度浓度酒精脱水,移入二甲苯溶液中透明,石蜡包埋切片,HE 染色,中性树胶封片,显微镜下观察各组织病理变化。
1.3 病原菌的分离纯化将1.2 病变组织剪碎后于常规细菌培养基(TSA)和血琼脂培养基上划线,28 ℃培养24 h~48 h 后,选取优势单菌落进行纯化培养后接种于血琼脂培养基,28 ℃培养48 h,挑单菌落经革兰氏染色,显微镜下观察细菌的形态特征。
1.4 分离菌的生化鉴定用无菌生理盐水将血平板上培养的分离菌制成菌悬液,利用API 20 Strep 试剂盒对其进行生化鉴定。
1.5 动物回归试验将健康小黄鱼暂养于700 L 养殖桶中,水温为23 ℃±1 ℃,每日换水70%,连续充气,每日投饵1 次,驯化一周。利用麦氏比浊法将分离菌株分别调整至1×105cfu/mL~1×109cfu/mL。将实验鱼分为6 组,每组12 尾,1~5 组分别腹腔注射上述稀释度的菌液100 μL,第6 组为对照组,注射等量无菌生理盐水。观察统计一周内鱼的发病和死亡情况,用寇氏法计算半数致死剂量(LD50)。用渔用麻醉剂MS-222 对濒死鱼麻醉后剖杀观察剖检症状和细菌再分离。
1.6 分离菌的分子特征鉴定利用细菌基因组提取试剂盒提取分离菌的全基因组DNA 为模板,参照文献[9],采用细菌16S rRNA 基因通用引物27F/1492R进行PCR 扩增,PCR 产物由上海华大基因科技有限公司测序,利用NCBI 中BLAST 在线软件对测序结果进行同源性分析;同时参照GenBank 中相关基因序列,利用MEGA7.0 软件进行遗传进化分析,采用邻接法构建该基因的分子发育树。
另外,参照文献[10],利用PCR 方法扩增lctO基因。PCR 产物由上海华大基因科技有限公司测序后,利用DNAMAN 7 分析软件比对分析。
1.7 分离菌血清型及毒力基因检测以分离菌株全基因组DNA 为模板,采用文献[11]建立的随机扩增多态性DNA(RAPD)分型方法分析分离菌株血清型,采用文献[12,13]中PCR 方法检测分离菌株毒力基因pgmA、scpI、simA、cpsD、sagA、pdi、cfi。
1.8 分离菌的药物敏感性试验采用纸片琼脂扩散法,参考2020 年美国临床和实验室标准化协会(CLSI)推荐的操作标准及判定方法检测分离菌对25 种常见药物的敏感性。
2 结 果
2.1 自然发病小黄鱼脏器组织的病理变化制备自然发病典型病征小黄鱼脑及脏器组织的病理切片,观察可见,病鱼脑、肝、脾、肾组织出现严重病理变化:患病鱼肝窦淤血,肝细胞之间界限模糊,空泡化明显,伴随有炎性细胞浸润(图1A);脾脏淀粉样变性,间质淤血,大量炎性细胞浸润(图1C);肾脏淤血,肾小管上皮细胞崩解、脱落、管腔变窄;肾小球萎缩(图1E);脑组织疏松,毛细血管扩张淤血,伴随有炎性细胞浸润(图1G)。结果表明患病鱼脑及各脏器组织均呈现不同程度的出血及炎症病变。
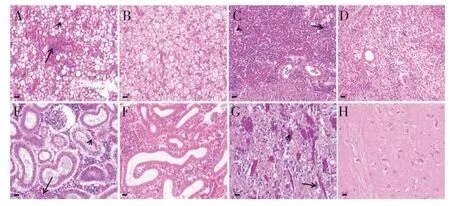
图1 自然感染小黄鱼的组织病变观察(标尺=10 μm)Fig.1 Histological observation for natural infection of small yellow croaker(bar=10 μm)
2.2 病原菌分离与形态学观察经纯化培养,从患病鱼肝脏、脑组织中均分离到优势菌株DB2009001,该菌株在绵羊血琼脂平板上培养24 h 长出表面光滑、乳白色隆起的菌落,呈β型溶血(图2A)。革兰氏染色可见菌体呈球形,链状排列,呈革兰氏阳性(图2B)。
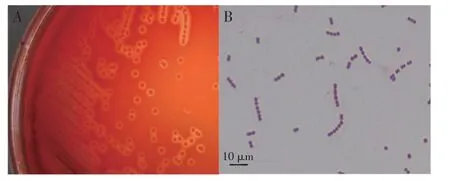
图2 分离菌表型特征Fig.2 Phenotype of isolated strain
2.3 病原菌的生化鉴定生化鉴定结果显示,菌株DB2009001 不能水解马尿酸;七叶灵、精氨酸等水解反应阳性,VP 试验阴性;阿拉伯糖、山梨醇、乳糖、菊糖、棉子糖等产酸反应阴性;核糖、甘露醇等产酸反应阳性,与S.iniae(ATCC29178)[14]基本一致。根据《伯杰氏系统细菌学手册》关于典型海豚链球菌的特征表述,综合分离菌株的形态学和生化鉴定,初步判定分离菌株为海豚链球菌。
2.4 动物回归试验结果将分离的菌株DB2009001以腹腔注射方式感染小黄鱼,结果显示从感染后第2 d 起,各浓度感染组陆续出现发病和死亡,感染前期(1 d~3 d),死亡鱼无明显体表症状,解剖见肝脏充血、脾脏肿大;感染后期(4 d~7 d),发病鱼表现出与自然发病鱼类似的病症,包括眼球充血或突出、腹鳍出血、内脏组织充血等。从发病濒死的鱼肝脏、脾脏、肾脏中均分离到单一的菌株DB2009001。生理盐水对照组鱼在7 d 实验期内均无发病症状。对7 d 内各组的死亡情况进行统计,并经寇氏法计算出菌株DB2009001对小黄鱼的LD50为8.3×104cfu/尾,即LD50为1.66×103cfu/g。结果表明,菌株DB2009001可引起健康小黄鱼发病及死亡,为该小黄鱼暴发性疾病的致病菌。
2.5 分离菌的分子特征鉴定分离菌株经PCR 扩增后获得约1 400 bp 的16S rRNA 基因片段,测序结果显示菌株DB2009001与GenBank中海豚链球菌(S.iniae)(ATCC29178)的16S rRNA 基因序列同源性最高,达99.5%。将该基因序列上传至NCBI,获得GenBank 登录号为MW455461。构建系统发育树结果显示,菌株DB2009001 与S.iniae(ATCC29178)聚为一支(图3)。对分离菌lctO基因的PCR 扩增结果显示,获得了约870 bp 的单一目的条带产物,与文献报道[12]的lctO基因大小一致,测序结果显示其与S.iniaeGX005 株(CP032401)lctO基因的同源性达99.6%。上述结果进一步表明,分离菌株DB2009001 为海豚链球菌。
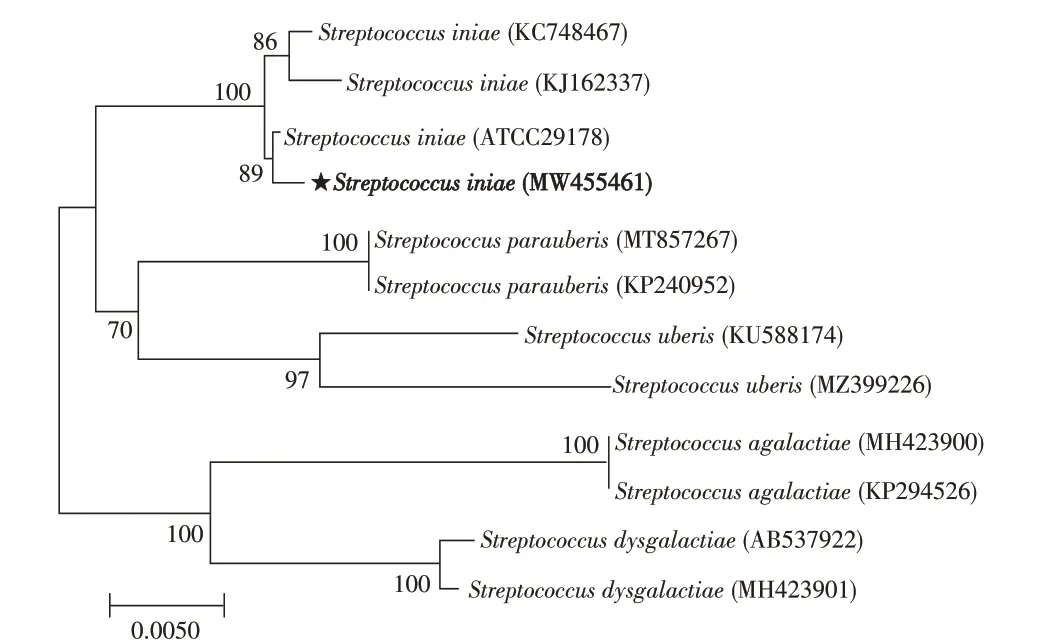
图3 基于菌株DB2009001 16S rRNA基因序列构建的系统发育树Fig.3 Phylogenetic tree analysis based on 16S rRNA gene sequence of DB2009001 strain
2.6 分离菌的血清型及毒力基因检测结果对分离菌株DB2009001 进行RAPD 的PCR 扩增,结果显示,从分离菌株提取的总DNA样本中扩增出约750 bp的目的片段,与Bachrach 等[15]报道的S.iniaeⅠ型特征一致;毒力基因检测结果显示,可扩增出S.iniae的7种主要毒力基因,分别为pgmA、scpI、simA、cpsD、sagA、pdi、cfi(图4)。上述结果表明,DB2009001 为S.iniaeⅠ型,且为携带多种毒力基因的强毒力株。

图4 分离菌DB2009001 RAPD及毒力基因的PCR扩增结果Fig.4 The PCR amplification results of RAPD and virulence genes of DB2009001
2.7 分离菌的药敏试验结果对菌株DB2009001 进行药敏检测,结果显示,分离菌株对氧氟沙星、新生霉素、四环素、阿莫西林、氟苯尼考等17 种抗生素敏感,对制霉菌素、庆大霉素、罗红霉素、妥布霉素等8 种抗生素耐药(表1)。
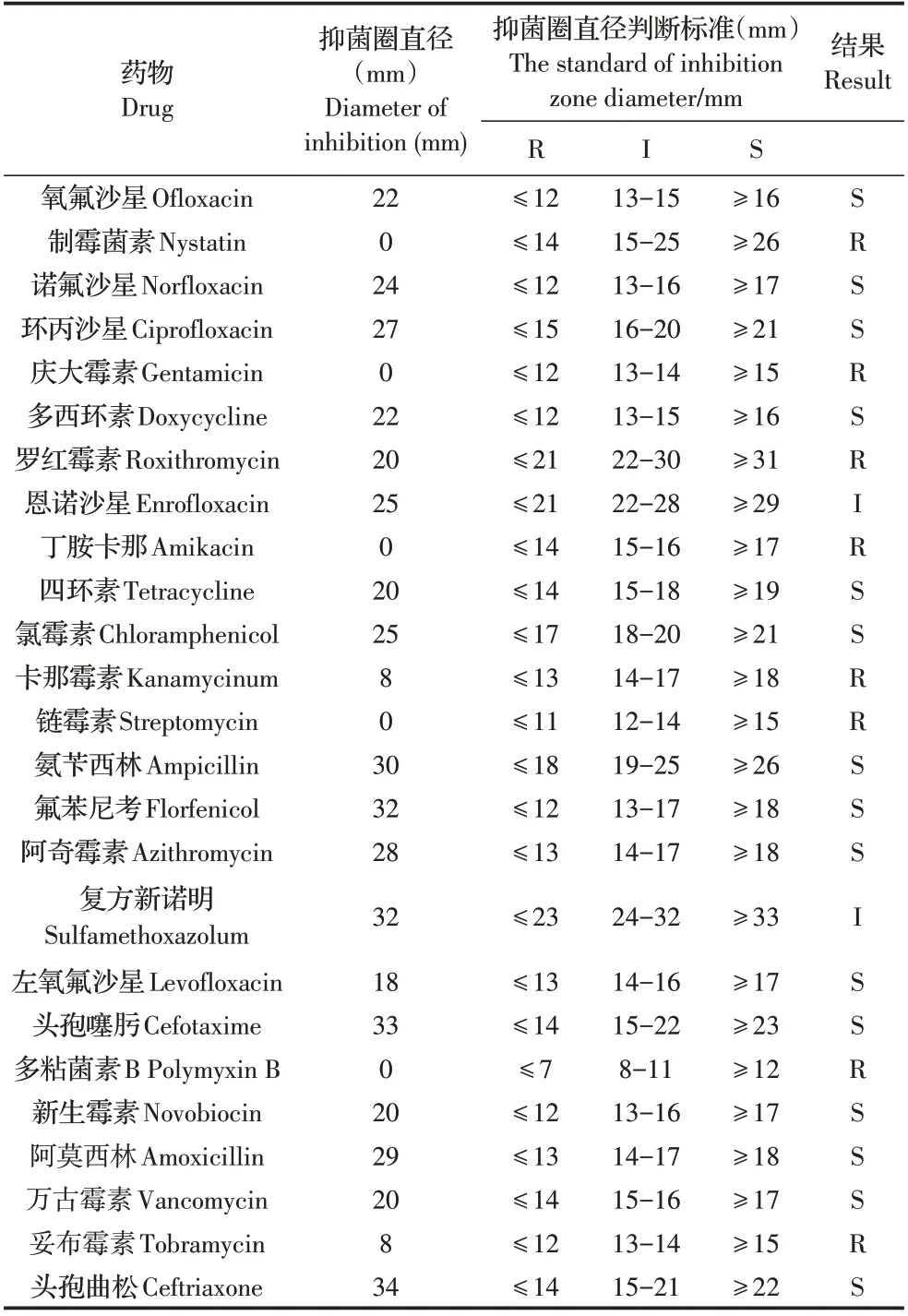
表1 分离菌药敏试验结果Table 1 Results for the drug sensitivity test of isolated strain
3 讨 论
本研究从患暴发性疾病的小黄鱼中分离到一株S.iniaeDB2009001,并对其病理学和致病性进行了初步研究,这是首例S.iniae感染小黄鱼并引起暴发性死亡的报道。分离到的菌株DB2009001各项特征均与S.iniae的典型特征吻合。16S rRNA和lctO基因检测结果也进一步确定菌株DB2009001为S.iniae。
现有研究表明,S.iniae各菌株之间分型较为复杂,Barnes 等根据精氨酸双水解酶(ADH)测试结果的不同将S.iniae分为2 种生物型,Ⅰ型为ADH 阳性,Ⅱ型为ADH 阴性[16]。随后Wang 等发现,ADH 阳性的菌株在RAPD 扩增中出现750 bp 大小的条带,而ADH阴性菌株则无法扩增出同样条带[11]。然而国内学者对分离自卵形鲳鲹、罗非鱼、鲟鱼的多株S.iniae的检测结果发现,ADH阴性的部分菌株也能通过RAPD 扩增出750 bp 条带,反之,也存在部分ADH 阳性的菌株无法扩增出该特征条带,因而ADH 属性与RAPD 检测结果之间并无必然联系[7,17-18]。本研究分离自小黄鱼的菌株DB2009001 经生化测试,呈ADH 阳性,同时RAPD 也扩增出750 bp 条带,这与Barnes 及Bachrach 等建议的S.iniaeⅠ型特征均吻合,综合上述分类方法判定DB2009001 应归为S.iniaeⅠ型。
S.iniae作为鱼类重要致病菌,宿主十分广泛,对淡水及海水鱼类均有侵染力。国内报道的感染S.iniae较为严重的养殖品种包括罗非鱼[3]、牙鲆[5]、卵形鲳鲹[7]、杂交鲟(Hybrid sturgeon)[19]等。值得注意的是,本研究分离的S.iniaeDB2009001与沈智华等[14]报道的菌株均来源于舟山海域养殖网箱,二者均感染石首鱼科品种,经过对比,二者的生理生化特性也完全相同,并且具有相似的抗菌谱,但该研究未提供完整菌株的16S rRNA信息,本研究无法对二者的进化关系作进一步比较分析。同时,分离自美国红鱼的S.iniae对美国红鱼、罗非鱼的LD50(1.9×107cfu/尾~4.8×108cfu/尾)均远高于本研究中DB2009001 对小黄鱼的LD50(8.3×104cfu/尾),这可能与不同宿主的抗病力差异有关,另一方面也可能与感染时的水温、以及菌株毒力的强弱(携带的毒力因子差异)有关。从美国红鱼分离的菌株暴发流行病的时间为12 月,海水温度较低(15 ℃左右),而感染小黄鱼的菌株暴发流行的时间则为9 月,海水温度较高(23 ℃~26 ℃),不同的为水温提示两种菌株可能具有不同的致病机制。本研究对菌株DB2009001 的毒力因子检测结果显示,该菌株同时仅携带7 种S.iniae重要毒力基因,这一特征与其对小黄鱼的低LD50相吻合。
S.iniae侵染不同宿主可表现出不同的临床症状及病理特征,典型的临床症状包括不规则泳动、食欲减退、体色发黑、眼球突出、眼角膜浑浊、鳍条及肛门出血,脾、肾肿大、出血,腹腔积液等。本研究发病小黄鱼表现为停食,体色发黑,眼球突出、眼周充血,解剖可见脑和肝脏出血,这些症状与报道的金鲳(Trachinotus ovatus)病症最为相似[20]。祝璟琳等对感染S.iniae的罗非鱼进行了组织病理学观察,结果显示主要病变表现为全身多组织、器官水肿,出血、变性、坏死以及炎症反应[21]。本研究对患病小黄鱼的脑、肝脏、脾脏、肾脏的切片观察发现类似的组织淤血、炎性细胞浸润等病变,其中,脑组织出现明显的毛细血管扩张、出血,提示该菌株可通过血液循环,穿透血—脑屏障,进入中枢神经系统,这与Amir 等报道的S.iniae侵染途径一致[22]。
目前,对S.iniae的防治仍以抗生素为主,恩诺沙星、阿莫西林、红霉素、呋喃唑酮和土霉素等被广泛用于控制S.iniae感染引起的疾病[2]。尽管不同来源的S.iniae表现出大致相同的抗菌谱,但抗生素等环境压力下也产生出具有不同耐药特性的菌株。本研究的分离菌DB2009001 对四环素类、β 内酰胺类、喹诺酮类、氟苯尼考等药物敏感,对多肽类、氨基糖苷类等药物耐药。针对本次舟山地区小黄鱼S.iniae暴发性疾病,养殖户使用了能穿过血脑屏障的氟苯尼考,使疫情得到了有效的控制。
本研究首次报道了S.iniae能够感染小黄鱼,并对其生化特征,耐药性等初步研究,为小黄鱼链球菌病的防治提供了参考依据。

