Xp11.2 易位/TFE3 基因融合相关性肾癌14例临床分析并文献复习
陈松茂 叶烈夫
1)福建医科大学省立临床医学院 福州 350004;2)福建省立医院泌尿外科 福州 350004
Xp11.2易位/TFE3 基因融合相关性肾癌(Xp11.2肾细胞癌)临床比较少见,目前国内外相关文献报道较少,术前影像学表现与其他类型肾癌不易区分。回顾2012年至今收治的14例患者的临床资料结合相关文献,从临床表现、病理特征、影像学改变及治疗预后等方面进行探讨总结。
1 资料与方法
1.1一般资料收集2012-12—2019-12福建省立医院及省立南院泌尿外科诊治的Xp11.2肾细胞癌患者14例的临床资料。男8 例,女6例;年龄32岁(范围:14~69岁)。右侧6例,左侧8例,肿瘤最大径平均值6.3 cm(范围:2.5~17 cm)。根据肾癌TNM分期,7例T1N0M0,1例T1N1M0,5例T2N0M0,1例T2N1M0。14例患者均接受手术治疗。腹膜后镜下肾部分切除术1例,肾根治性切除术5例;开放肾部分切除术2例,经腹膜后肾根治术3例,经腹腔肾根治术1例。腹腔镜中转开放肾根治性切除1例,中转开放肾部分切除1例。
1.2影像学资料术前行泌尿系CT平扫加增强检查患者12例,发现平扫时病灶呈混杂密度,等或稍高密度影。3例病灶见斑片状稍高密度影(图1A),3例病灶呈囊实性(图2),1例合并钙化(图3),强化扫描呈不均匀强化,动脉期强化程度低于肾皮质,坏死区不强化(图1B、C)。术前行MRI检查4例,发现MRI呈长或等T1、长T2信号,强化后呈轻中度不均匀强化(图4B、C,图5)。DWI高信号,ADC低信号。1例病灶内出现斑片状短T1、短或更长T2(图4A)。

图1 图A CT平扫可见右肾肿瘤内部斑片状高密度影,图B、C增强扫描右侧肾肿瘤呈现不均匀强化,动脉期强化程度低于肾皮质。
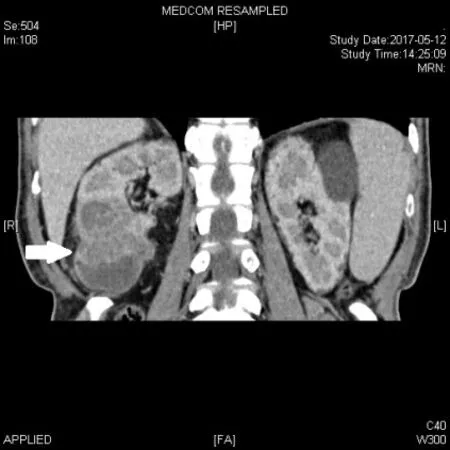
图2 右肾下极肿瘤呈囊实性改变

图4 图A MRI T1加权相见左肾肿瘤内斑片状改变,图B、C显示增强扫描后动脉期及静脉期病灶呈不均匀强化

图5 右肾肿瘤MRI T2加权相
2 结果
2.1病理结果14例患者术后病理学检查结果均为Xp11.2肾细胞癌。10例标本切面呈灰白或灰黄色,1例呈灰褐色,3例呈五彩状,伴囊性变3例。免疫组化结果均提示TFE3(++~+++)(图6)。4例行TFE-3分离探针免疫荧光原位杂交技术(FISH)检查,检测到TFE-3基因分离(图7)。

图6 图A、B镜下示透明细胞构成乳头状结构,嗜酸性颗粒胞浆的瘤细胞组成的巢状结构,大量胞浆透明核多少不等的嗜酸性肿瘤细胞,细胞周围边界清楚,染色质呈现囊泡状,核仁较明显。(HE×200)。图C示TFE3免疫组化染色:++ (×100),图D示CD10免疫组化染色阳性(×100)。

图7 分离探针免疫荧光原位杂交(FISH)监测到TFE3基因分离
2.2治疗随访情况14例患者均术后定期随访,最后随访时间为2019年12月。10例术后无复发或转移。4例分别于术后3、11、12、13个月发现复发,复发后均行靶向治疗。使用帕唑帕尼1例,治疗4个月后发现病灶较前缩小;使用舒尼替尼3例,其中2例因全身复发转移死亡,1例未进展。
3 讨论
2004年WHO首次将Xp11.2肾细胞癌列为肾癌的一种独立亚型[1],Xp11.2肾细胞癌与t(6;11) (p21;q12) /TFEB 基因融合相关性肾癌存在密切联系,所以2016年WHO新版肾肿瘤分类将二者统称为MIT家族异位性肾癌[2]。Xp11.2肾细胞癌比一般常见类型肾癌具有更强的侵袭性,国外学者分析发现50%~65%的病例在发现时已经进入Ⅲ~Ⅳ期[3]。Xp11.2肾细胞癌在儿童肾细胞癌中发病率高(20.0%~75.0%),而在成人肾细胞癌中仅占1.0%~1.6%,而且成年患者的预后更差[4-7]。女性的发病率高于男性,可能是因为该病基因异位发生在X染色体上,而女性有两条X染色体,所以病变的概率更大,本组患者男性多于女性,考虑病例数少所致。文献报道国内单个医疗中心统计发现Xp11.2肾细胞癌约占全部肾细胞癌的0.3%(6/2 000),并认为该类肾癌在成人中发病率被严重低估,原因是该病与常见的其他类型肾癌在临床症状、影像学表现甚至常规病理HE染色等方面类似,TFE3免疫组化染色及免疫荧光杂交(FISH)没有作为肾肿瘤的常规检查,容易导致漏诊[8]。
Xp11.2肾细胞癌常在体检时发现,以血尿、腹痛、腹部包块三联征为主诉就诊的患者很少,常为体检发现肾脏占位,临床表现与常见其他类型肾细胞癌类似,缺乏特异性临床表现。Xp11.2肾细胞癌超声下主要表现为肾脏肿物,难以与其他类型肾细胞癌或部分良性肾肿瘤(乏脂肪性错构瘤、嗜酸性细胞瘤等)相鉴别。动态增强CT及MRI检查发现该类肾癌多发生在肾髓质,常伴有钙化及囊性坏死灶。CT平扫常呈等密度或稍高密度,有学者[9]认为平扫高密度为瘤内出血所致。动态增强时强化程度较弱,明显弱于肾透明细胞癌,但与嫌色细胞癌及乳头状癌等强化弱的肾细胞癌亚型不容易鉴别。本组患者CT平扫发现肿物呈混杂密度,等或稍高密度影,常伴有斑片状高密度影的钙化灶,部分病灶呈囊实性,1例因呈肿瘤明显囊性变术前误诊为囊性肾瘤。本组病例CT扫描呈现不均匀强化,强化程度稍弱,动脉期强化程度低于肾皮质,部分坏死区不强化,与文献报道相似。Kato H等[9]认为Xp11.2肾细胞癌的影像表现与乳头状肾细胞癌相似,难以鉴别;但乳头状肾癌CT平扫常呈现均匀密度,而Xp11.2异位性肾癌CT平扫常呈混杂密度,可见到斑片状高密度,可作为二者鉴别的方法。Chen X等[10]对比21例Xp11.2肾细胞癌影像学表现,发现大部分发生在肾髓质(90.8%),少部分发生在肾皮质(9.5%),部分可出现钙化(23.8%)。有学者[11]研究发现在MRI上T1加权相上为等信号,T2加权相上为混合信号或者低信号(可区别T2高信号的肾透明细胞癌、囊性肾癌及肾囊肿等),增强后呈不均匀增强,弥散相呈高信号,可发现坏死及囊性改变。本组患者4例术前行MRI检查提示长T1长T2信号,强化后呈轻中度不均匀强化。DWI高信号,ADC低信号,与近期相关报道相似。相较其他常见肾癌亚型,Xp11.2肾细胞癌中淋巴结及器官转移更为常见,经常转移的部位包括肺、肝,以及腹膜后淋巴结等,其中腹膜后淋巴结为最常见转移部位[12-13]。
Xp11.2肾细胞癌具有肾透明细胞癌和乳头状细胞癌混合的组织学形态表现,所以容易误诊为透明细胞癌或乳头状细胞癌。邹泓等[14]收集116例肾上皮性肿瘤的病理资料,发现有10 例Xp11.2肾细胞癌的原诊断均为“透明细胞癌” 或“乳头状肾细胞癌”。He J等[15]的研究中也有16例Xp11.2肾细胞癌被诊断为“透明细胞癌”、“乳头状细胞癌”及“未分化癌”。
Xp11.2肾细胞癌的主要特征是在X染色体短臂上的TFE3基因发生断裂,并与相对应的基因发生了平衡易位而形成新的TFE3融合基因,新融合的TFE3基因表达量较前明显升高,从而使TFE3蛋白在肿瘤组织中增多,这种明显增多的 TFE3 蛋白会影响细胞内转录的调节,促进肿瘤形成。因此,TFE3蛋白免疫组化的方法常被作为Xp11.2肾细胞癌诊断的重要方法[4]。Argani 等[16]研究发现利用免疫组化检测TFE3蛋白的高表达对Xp11.2肾细胞癌诊断的敏感性及特异性分别高达97.5%、99.6%。目前也有新的观点认为TFE3免疫组化检法假阳性率及假阴性率偏高,TFE3裂解免疫荧光(FISH)法才是诊断Xp11.2肾细胞癌的最佳方法[6, 17]。
目前证实放疗及化疗对Xp11.2肾细胞癌无效,干扰素(INF-a)及白介素(IL-2)也无明显效果,尚缺乏明确有效的治疗方案。对于早期肿瘤,普遍建议行手术治疗,可根据患者身体情况及肿瘤位置行根治性肾切除术或保留肾单位肾部分切除术,大部分患者可获治愈。Xp11.2肾细胞癌侵袭性很强,被发现时多已出现淋巴结转移及远处器官转移。对相对晚期的患者可使用血管内皮生长因子抑制剂(VEGF-R)进行靶向治疗,目前证实舒尼替尼、索拉菲尼等多个血管内皮生长因子抑制剂可能有效。一项回顾性研究对接受VEGF-R靶向治疗的15例Xp11.2肾细胞癌患者进行分析,发现缓解率为20%,其中7例疾病稳定(stable disease,SD);该研究还对比使用舒尼替尼与其他VEGF-R靶向药物的生存曲线,发现PFS及OS无差别,但由于样本量少,该结论是否正确还有待进一步研究[18]。mTOR抑制剂可作为血管内皮生长因子抑制剂治疗失败后的二线方案,国外学者报道1例该病患者接受舒尼替尼治疗失败后使用依维莫司治疗并取得长达25个月的部分缓解[19]。本组患者4例分别于术后发现复发,复发后均行靶向治疗。1例使用帕唑帕尼,治疗4个月后发现病灶较前缩小;3例使用舒尼替尼,其中2例因全身复发转移死亡,1例未进展。Chang K等[20]研究36例Xp11.2肾细胞癌病例发现PD-L1表达阳性率为25%,并认为PD-1/PD-L1抑制剂可能是潜在的新的治疗方案。
Xp11.2肾细胞癌发病率低,相对罕见,目前尚无成熟治疗方案,治疗方法多参考于常见肾细胞癌的治疗方案。血管内皮生长因子抑制剂及mTOR抑制剂证实有效,PD-1/PD-L1抑制剂可能是一种新的治疗方案,目前的研究结果大多是基于小规模临床病例报道,缺乏RCT实验等较强依据,对Xp11.2肾细胞癌还需要更多的研究。

