红肉色素蛋白的生物学功能及对肠道健康影响的研究进展
李春保,姜帅,薛德奖,李茜,张淼
(南京农业大学肉类加工与质量控制教育部重点实验室/农业农村部肉品加工重点实验室/江苏省肉类生产与加工质量安全控制协同创新中心/食品科学技术学院,江苏 南京 210095)
肉中的呈色物质主要有色素蛋白和细胞色素C3[1],而色素蛋白可细分为肌红蛋白(myoglobin)和血红蛋白(hemoglobin)。血红蛋白主要存在于动物血液的红细胞中,而肌红蛋白主要来源于肉的肌细胞[2]。红肉通常是指肌红蛋白含量高而呈现红色的哺乳动物肉,肉中富含维生素B12、n-3脂肪酸、铁、锌、硒、硫胺、核黄素和磷[3]等营养物质,并且其蛋白为完全蛋白质,含有人体必需的各种氨基酸,其构成比例又接近人体,易被人体消化吸收[4],并且经加工和烹饪后具有优良的风味,是餐桌上必不可少的一类膳食。目前的饮食指南建议限制红肉的消费,其与健康的因果关系仍然存在不确定性,专家们也坦言“食用红肉相关的癌症风险较难预测,因为红肉引起癌症的证据还不清楚”[5-6]。如今针对过度食用红肉可能致癌的研究中,血红素似乎是一个最重要的诱导因素[7]。而色素蛋白中富含血红素及血红素铁,因此对其进行营养健康方面的研究十分必要。
色素蛋白中富含血红素,其包含机体所需的微量元素铁,而血红素铁是生物利用率较高的铁源,与常见的植物来源的非血红素铁相比,更容易被机体吸收利用[8]。但血红素作为细胞氧化应激发生的诱导者[9],过多的摄入会引起炎症反应甚至肠道损伤,所以控制膳食色素蛋白的摄入量对健康而言尤为重要。深入探讨色素蛋白的摄入对机体肠道健康的影响在一定程度上可给予膳食摄入上的建议。因此本文主要从肌红蛋白和血红蛋白的结构出发,对2种蛋白的消化情况、消化产物及生物学特性进行阐述,尤其是对其重要的分解产物血红素及血红素铁的生物学功能及在肠道消化吸收过程进行分析,归纳总结其对肠道健康的影响,以期为维护肠道健康提供参考依据。
1 色素蛋白及其生物学功能
1.1 血红蛋白及其消化性
血红蛋白是由2个α亚基和2个β亚基组成的具有一定空间结构的四聚体蛋白,每个亚基都是由 1个珠蛋白和1个血红素分子构成,肽链间相互缠绕、折叠,形成一个内含血红素的球状稳定结构[10]。具体结构见图1。在血红蛋白三级结构中,珠蛋白上的疏水非极性氨基酸形成疏水口袋包裹血红素,使其与水隔离。而亲水的极性氨基酸位于蛋白外部,使其具有高度的水溶性,在保持结构稳定性的同时更好地起到运输氧气的作用[11]。

图1 血红蛋白结构[10]Fig.1 Structure of hemoglobin[10]在晶体结构中,存在4个血红素,其为粉红色棒状结构,其中橘色中心部分为亚铁离子。In the crystal structure,there are four heme,which is a pink rod-like structure,in which the orange center part is ferrous ion.
血红蛋白作为血红素铁的载体之一,其血红素铁的释放与蛋白结构和蛋白消化特性密切相关。温度、pH值、离子强度和酶处理等变化会引起血红蛋白结构的改变,从而显著影响蛋白的功能特性和消化性能。Bhomia等[12]发现温度升高会导致血红蛋白多肽链间氢键断裂进而引起蛋白二级结构改变。但也有研究表明在一定温度范围内,血红蛋白经热处理后也可恢复到原来结构[13]。Kristinsson等[14]指出在pH值为 1.5~3.5时,pH值的降低与血红蛋白结构展开速度成正比,而pH值为10~12时,血红蛋白的构象变化比在酸性pH值时小得多;在血红蛋白展开的不同阶段将蛋白溶液调节至中性时,蛋白重新折叠时天然结构的恢复与重新调节pH值之前的展开程度成正比,并且蛋白质展开越多,天然结构的恢复程度就越低。同时,盐离子的存在也会导致天然结构的恢复程度降低。在血红蛋白的模拟消化中发现牛血红蛋白被胃蛋白酶或枯草杆菌蛋白酶水解,消化率为0%~15%[15]。在pH值为7.5的肠道环境中,血红蛋白水解程度与铁的吸收成正比,无论哪种酶,蛋白水解度最大值都在8%~11%[15]。比较2种酶的水解产物表明,血红素铁的吸收不仅取决于其溶解度,还取决于血红素肽的强度与血红素聚合速率之间的平衡关系。通过温度、pH值、离子强度和酶等处理,使血红蛋白结构和功能特性发生改变,提高蛋白消化率,从而使血红蛋白摄入后被机体更好吸收,在充分利用蛋白营养的同时增强铁的摄入。
1.2 血红蛋白的生物学功能
1.2.1 抗菌作用早在1957年,Hodson等[16]指出血红蛋白能够在不同pH值和浓度的缓冲体系中抑制大肠杆菌K12的生长,表明不同处理条件引起血红蛋白结构的改变,可能产生具有抗菌作用的片段。1986年以来,多项研究表明血红蛋白片段化可产生一系列生物活性肽[17],近年来这些从血红蛋白中提取的抗菌肽被称为血红蛋白源杀菌肽(Hemocindins)[18]。目前,Hemocindins主要是通过血红蛋白水解分离或者化学合成获得。Nakajima等[19]指出在肠腔中的某些蜱类通过碎裂宿主中的血红蛋白进而产生抗菌活性片段,而这些活性片段作为免疫因子在调节肠道菌群稳态方面可能起到一定作用。最近研究发现从泥蚶血液中分离纯化的2种血红蛋白,同源二聚体(TgHbⅠ)和异源四聚体(TgHbⅡ)具有一致的光谱抗菌活性,对大肠杆菌、恶臭假单孢球菌、枯草芽胞杆菌和坚强芽胞杆菌均具有良好的抗菌作用[20]。当富含血红蛋白膳食摄入体内后,蛋白可以通过酶解形成具有特定抗菌作用的肽段,对肠道微生物进行调节。
1.2.2 抗炎抗氧化作用通常炎症过程会导致渐进性损害,往往与过量的自由基释放和氧化应激有关[21]。血红蛋白作为机体内运输氧气的重要蛋白质,具有广泛的生物活性,其部分组分具有抗炎抗氧化作用[22]。Lueangsakulthai等[23]指出模拟胃肠体外消化得到的暹罗鳄鱼血红蛋白水解物具有一定的抗氧化和抗炎作用,可对白介素6、白介素1β和前列腺素E2等促炎因子和促炎介质进行调节。在小鼠体内发现暹罗鳄鱼血红蛋白能够保护成纤维细胞免受过氧化氢诱导的氧化损伤,在炎症阶段表现出抗炎活性,增强小鼠肝脏的抗氧化酶活性和降低脂质过氧化水平[24]。此外,其他动物的血红蛋白中也具有抗氧化活性。张凤英[25]指出在40 ℃、底物浓度8%、6 000 U·g-1、pH7.0的条件下,通过中性蛋白酶水解猪血红蛋白4 h可得到具有较好抗氧化性能的肽段,还原力可达到0.432。高义霞等[26]发现在10% 二甲基亚砜(DMSO)溶剂中,根皮苷和牛血红蛋白的相互作用可增强根皮苷对1,1-二苯基-2-三硝基苯肼(DPPH)和2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)自由基的清除率。但血红蛋白作为膳食摄入时是否具有抗炎抗氧化的作用还不清楚。
1.2.3 免疫调节血红蛋白不仅能在红细胞中表达,而且在肝细胞、肺泡细胞和神经元/胶质细胞等非红细胞中也有一定的表达[27],推测其在机体内具有除携氧外的特殊功能。在对猪源血红蛋白的研究中,Li等[28]证实猪血红蛋白β亚单位(PHB)能够通过调节维甲酸诱导型基因Ⅰ(RIG-Ⅰ)介导的Ⅰ型干扰素应答抑制猪瘟病毒(CSFV)的生长。近年来,针对人源血红蛋白抗病毒免疫调节机制的研究也取得了一定的进展。Yang等[29]发现人源血红蛋白β亚基(HHb)是RIG-l/黑色素瘤分化相关基因5(MDA-5)介导的抗病毒反应的多效调节因子。在胎盘保护胎儿免受病毒和细菌病原体侵袭的具体机制中,HHb的C末端片段可以抑制单纯孢疹病毒2型(HSV-2)感染,且呈剂量依赖性[30]。在对新冠病毒的抵抗中,促红细胞生成素诱导的血红蛋白亚基β可刺激天然免疫核糖核酸病毒模式识别,抑制活性氧,减少血管紧张素转换酶2病毒通道的开放,以及中性粒细胞对新冠肺炎的细胞外捕获[31]。这说明血红蛋白在抵抗病原体入侵和调节天然免疫方面也发挥着重要作用[31]。
1.3 肌红蛋白及其消化性
肌红蛋白是哺乳动物细胞(主要是肌细胞)储存和分配氧的蛋白质。它由1条多肽链和1个辅基血红素构成[32],具体结构见图2。除去血红素的脱辅基后的肌红蛋白称为球蛋白(Globin),其与血红蛋白的亚基(α珠蛋白链和P-珠蛋白链)在氨基酸序列上具有明显的同源性,二者的构象和功能也极其相似。肌红蛋白呈紧密球形,这导致其消化性较差。肌红蛋白多肽链氨基酸残基上的疏水侧链大都在分子内部,亲水侧链多位于分子表面,具有较好的水溶性。血红素辅基是卟啉环化合物,它由4个吡咯通过4个甲炔基相连成一个大环,Fe2+居于环中。血红素辅基位于肌红蛋白分子内部的口袋形空穴中,故血红素在蛋白结构中保持稳定[33]。
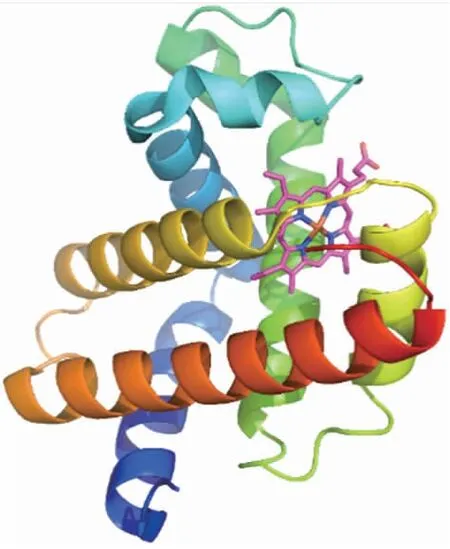
图2 肌红蛋白结构[32]Fig.2 Structure of myoglobin[32]在晶体结构中,存在1个血红素,其为粉红色棒状结构,其中橘色中心部分为亚铁离子。In the crystal structure,there are one heme,which is a pink rod-like structure,in which the orange center part is ferrous ion.
肌红蛋白作为血红素铁的载体可为人体提供微量元素铁,其血红素铁的释放与肌红蛋白的消化性有关。血红素的吸收主要集中在小肠上部[8],食用少量红肉后,血红素被吸收并且经过血红素氧合酶催化分解产生亚铁离子(Fe2+)、胆绿素和一氧化碳(CO)[8]。食用大量红肉后,摄入的血红素不能被小肠全部吸收,部分就成为游离血红素。温度、pH值等环境因素会改变肌红蛋白结构,进而影响其消化性能。当加热温度由60 ℃升高至80 ℃时,肌红蛋白的变性程度、血红素脱离程度、三级结构展开程度以及二级结构的无序化程度均呈增大趋势,即70 ℃以上的加热会严重影响肌红蛋白的结构[34]。此外,光谱学监测中发现pH值变化影响高铁肌红蛋白结构。当pH值为4.5~7.0时,高铁肌红蛋白没有明显的结构变化,而当pH值为4.0~4.3时,肌红蛋白经典结构中的Soret带显著降低,这说明卟啉环开始暴露在环境中;当pH值持续下降至3.0~3.8时,其吸收带与血红素的吸收带高度相似,推测近端组氨酸氮和铁中心间的结合可能被破坏[35]。此外,在肌红蛋白体外消化试验中发现,胃蛋白酶和胰蛋白酶对其的消化率分别为7.03%和33.00%。在分子动力学模拟中发现胃蛋白酶和肌红蛋白结合位点中氨基酸残基结合性差可能会降低肌红蛋白的消化率[36]。但目前有关肌红蛋白体内消化的研究还未见报道。基于肌红蛋白结构中含有血红素和珠蛋白,推测当机体摄入肌红蛋白后,珠蛋白逐渐被水解为小分子肽段或氨基酸等,而血红素从珠蛋白的包裹中暴露,在肠道中被肠细胞吸收进而参加机体内的各种代谢活动[37]。
1.4 肌红蛋白的生物学功能
肌红蛋白存在于哺乳动物Ⅰ型、Ⅱa型骨骼肌和心肌组织细胞质中,是一种重要的细胞内色素蛋白。1个肌红蛋白分子可以结合1分子O2,因此肌红蛋白的氧储存能力与其在肌细胞中的含量以及其氧饱和程度成正比关系。耗氧较高的肌肉组织,尤其是心肌中,肌红蛋白的含量也相对较高。Garry等[38]建立了肌红蛋白基因敲除(MBKO)小鼠模型来验证肌红蛋白的生物学功能,发现小鼠不仅能够正常繁殖,还可以在低氧甚至缺氧的环境下保持正常的运动能力。同时,由于肌红蛋白具有促进细胞内氧转运的功能,在肌红蛋白基因敲除后,心肌表现出多种复杂的能够弥补由肌红蛋白缺失引起功能缺失的代偿机制[39]。
在Meyer[40]对肌红蛋白功能的假设中,肌红蛋白除了具有氧储存和氧传递功能外,还具有细胞内催化剂的作用。肌红蛋白作为亚硝酸盐还原酶,在调节细胞内线粒体的呼吸作用和一氧化氮(NO)水平中起到重要的作用[41]。Hendgen-Cotta等[42]指出肌红蛋白可以清除心肌中的NO,进而改善心脏障碍。当机体缺乏肌红蛋白时,不仅会使心肌功能受损,还可促使内源性或者外源性氧化损伤水平提高。在机体心肌代谢过程中,肌红蛋白可能通过降低氧化应激反应,来保护心脏免受氧化损伤[39]。近期的研究也指出心肌中的肌红蛋白在调节脂肪酸(FA)代谢中具有重要作用,通过β氧化来确保生理能量的产生,防止心肌脂质堆积和保护心功能[43]。
肌红蛋白也可作为肌肉损伤的参考指标。肌肉组织代谢过程中会有微量肌红蛋白进入血液,进入肾小球基底膜自由滤过,通过肾小管上皮细胞分泌的蛋白分解酶分解后由尿液排出,而小部分由网状内皮系统进行代谢[44]。可以通过无创检测尿液中的肌红蛋白来判断人体是否出现运动性横纹肌溶解症、肌肉损伤等[45]。
2 色素蛋白对肠道健康的影响
2.1 肠道健康
目前,针对肠道健康还没有明确的定义。由于肠道具有消化、吸收、免疫、内分泌、代谢等功能,肠道健康可基本定义为具有完整的肠道黏膜结构,有效的消化吸收功能并起到屏障作用,平衡的肠道内微生态系统和肠道内稳定的多种化学组分,完善的肠道免疫系统功能和健全的神经内分泌功能[46]。就健康的肠道而言,这5个方面缺一不可。
2.2 膳食血红蛋白对肠道健康的影响
Angeli等[47]发现血红蛋白和亚油酸氢过氧化物共培养细胞时可引起DNA损伤,仅血红蛋白培养时,浓度需达到100 μmol·L-1才可引起细胞DNA损伤。Surya等[48]饲喂血红蛋白大鼠的粪便水对肿瘤前细胞核因子E2相关因子2(Nrf2)活性的诱导作用高于正常细胞,可导致细胞凋亡,正常细胞减少和癌前细胞差异凋亡。Bastide等[49]发现,饲喂血红蛋白(1%)导致大鼠粪便硫代巴比妥酸反应物(TBARS)、表观总亚硝基化合物(ATNC)和细胞毒性增加,血红蛋白(2.5%)显著增加Apc Min/+小鼠的小肠肿瘤负荷而非结肠,但正常小鼠未引起肿瘤。血红蛋白导致粪便中TBARS、细胞毒性和尿中4-羟基壬烯醛(4-HNE)的增加,亚硝基铁导致粪便中ATNC升高。尽管血红蛋白导致粪便中TBARS增加,但并不诱导结肠细胞增殖[50]。血红蛋白和牛肉导致粪便中TBARS显著升高,而粪水中碳捕获树脂的处理使TBARS显著降低[48]。
2.3 膳食肌红蛋白对肠道健康的影响
针对膳食肌红蛋白的摄入对肠道健康影响的研究较少,朱姝冉等[34]和Li等[36]研究发现肌红蛋白的天然结构较难被胃蛋白酶酶解,且具有一定的耐热性,即肌红蛋白体外消化性差。王超[51]研究发现,用 4种加工肉制品饲喂小鼠,结肠内容物中均含有未被消化的肌红蛋白,即肌红蛋白体内消化性较差。张敏[52]也发现不同来源的肉蛋白摄入后,肌红蛋白在结肠中大量残留,野生型和获得性免疫缺陷(Rag1-/-基因敲除)小鼠的细胞过渡金属离子稳态功能均受到了加工肉蛋白质的调控。其中涉及参与铁离子稳态和氧化应激的基因,包括血红素依赖的血红素加氧酶(Hmox1)、BTB 结构域和 CNC 同源物 1(Bach1)[53],也因为加工肉蛋白质摄入发生上调,推测是富含血红素的肌红蛋白未被消化酶消化最终残留在结肠中导致的。与此同时,铁离子稳态调节剂——铁调素(Hamp2)下调,推测由于免疫缺陷型小鼠进食含有肌红蛋白的肉类后,Hamp2被抑制从而导致铁的进一步积累和过载[54],导致肠上皮细胞摄取过量的铁。以上研究表明源于肌红蛋白分解产生的血红素及血红素铁可能在膳食调控中起到关键的作用。
2.4 血红素对肠道健康的影响
血红素属于铁卟啉化合物,铁(Fe)原子位于原卟啉环中心,通过 N—Fe 键与4个吡咯环结合。它存在 a、b、c 三种主要的变体,其中血红素 b 更容易释放出游离血红素,在哺乳动物中广泛存在,其分子结构为 1个大型疏水性四聚吡咯环连接2个垂直于卟啉环的丙酸侧链[55],具体结构见图3。血红素是细胞氧化应激发生的诱导者[9],但其也在许多细胞功能中发挥重要作用,例如其作为REV-ERB(α和β)家族核受体的配体,具有调节昼夜节律、新陈代谢和免疫功能等作用[56]。在体内分解血红素的酶是血红素加氧酶(HO),其有3种同工酶形式:血红素加氧酶1(HO-1)、血红素加氧酶2(HO-2)和血红素加氧酶3(HO-3),其中HO-1主导肠道内血红素的分解[57]。在肠道内肠细胞通过血红素反应基团1(HRG1)蛋白转运血红素,HO-1响应血红素的应激高度表达,血红素在HO-1的作用下被分解为胆绿素、Fe和CO[37]。

图3 血红素结构[55]Fig.3 Structure of heme[55]血红素为粉红色棒状结构,其中橘色中心部分为亚铁离子。Heme is a pink rod structure,in which the orange center part is ferrous ion.
针对膳食血红素的体内研究源于瓦赫宁根大学的Ijssennagger团队,他们在2012年发现饲喂血红素的小鼠,其粪便中的细胞毒性水平明显较高,结肠上皮表面损伤更为严重;血红素激活并上调表面上皮细胞中氧化应激敏感转录因子,下调上皮细胞增殖反馈抑制剂的表达[58]。随后,该团队研究膳食血红素改变小鼠结肠的微生物群和黏膜这一过程中宿主和微生物是否存在相互作用时发现,膳食血红素增加了结肠中的拟杆菌门含量而降低厚壁菌门含量,炎症途径和Toll样受体信号没有变化,而微生物群的变化与结肠上皮增生无关[59]。Ijssennagger等[60]继续研究发现膳食血红素通过肠腔细胞毒性和活性氧(ROS)来损伤结肠上皮细胞,这种损伤被过度补偿引起隐窝细胞增殖,脂质代谢相关的过氧化物酶体增殖物激活受体(PPARα)基因上调,在结肠抗氧化应激中起保护作用,证明细胞表面的氧化应激不是血红素诱导细胞增殖和增生的决定因素。
随后2013年,Ijssennagger等[61]发现膳食血红素诱导小鼠结肠急性氧化应激,但延迟细胞毒性和代偿性增殖;血红素摄入后,活性氧急性增加,从而引起脂质过氧化物增加,黏膜基因呈现急性抗氧化反应,但细胞更新无明显变化;4 d后结肠内容物细胞毒性增加,与差异信号和过度增生相一致,癌基因被激活,而抑癌基因P53被抑制,表明细胞毒性是引起表面隐窝信号差异致使黏膜增生、癌基因和抑癌基因差异表达的关键因素。2015年,Ijssennagger等[62]研究膳食血红素可诱导结肠细胞毒性,引起上皮损伤和代偿性增生;尽管血红素诱导的细胞毒性在小鼠中仍持续存在,但抗生素能完全消除其增生效应,抗生素通过消除产生硫化物的细菌和降解黏液的细菌(如Akkermansia)来加强黏液屏障,阻止血红素依赖性细胞毒性胶束到达上皮。肠道微生物由于具有降低黏膜屏障功能的作用,是血红素在诱导的结肠上皮细胞增殖中所必需的。
Winter等[63]研究发现,膳食血红素能够增加小鼠结肠内DNA加合物,促进细胞增殖和降低结肠内细胞凋亡率,并随着时间的推移增加结肠内的甲基鸟嘌呤(O6MeG)加合物,但这些变化并不会引发小鼠模型中的结肠肿瘤。抗性淀粉可以促进有益的细菌发酵,并在短时间内减少啮齿类动物结肠中的有毒蛋白质发酵,但与结合血红素摄入后短时间内短链脂肪酸(SCFA)并没有起到作用。Marco等[64]研究表明膳食血红素会导致肠道发育不良,加重结肠炎,并可能促进小鼠腺瘤的发展。膳食血红素可被某些结肠细菌用作生长因子吸收,从而影响微生物群落结构,其特征是α多样性降低,厚壁菌门降低而变形杆菌增加,这一变化与右旋糖酐硫酸钠(DSS)处理诱导结肠炎相似。有研究表明,肠腔血红素[主要源于炎症性肠病(IBD)中的饮食成分或胃肠道出血,而在结直肠癌中较少]直接导致微生物群失调,可能会催化ROS的产生并促进细胞死亡。由于血红素中FLVCR1a(feline leukemia virus subgroup C cellular receptor 1a)基因的丢失,内皮细胞中血红素稳态的改变会引起血管生成受损。此外,将体外内皮细胞中的FLVCR1a基因沉默后,会造成细胞内血红素积累,从而导致肾小管生成缺陷和生存能力下降[65]。
2.5 血红素铁对肠道健康的影响
肠道通常可以吸收2种类型的铁:血红素铁和非血红素铁[66]。非血红素铁主要来源于植物中,但生物利用率较低,而血红素铁主要以血红蛋白和肌红蛋白形式存在[67],通过血红素载体蛋白1(HCP1)完全被十二指肠和空肠上的肠细胞吸收[68]。血红素铁生物利用率高,可以通过膳食中的红肉、肝脏、血液进行补充。Zhao等[69]研究血红素和非血红素铁对断奶仔猪生长性能、血液参数、组织矿物质含量和肠道形态的影响,发现大部分铁的吸收发生在小肠的上部,特别是十二指肠和近端空肠[70]。越来越多的研究表明铁对肠道功能有重大影响,缺铁和铁过量都会引起肠道炎症,增加肠道通透性和离子转运,维持肠道屏障健康和功能[71]。不同铁源的饲粮补充剂均可以促进仔猪的生长性能,显著提高猪十二指肠和空肠的绒毛高度,同时,良好的肠道形态也会增加铁的吸收,血红素具有促进肉质发红的优势,通过相关的血液参数和组织矿物沉积结果说明,铁、锗和血红素作为有机铁源比传统的FeSO4添加剂具有高的生物利用度[69,71]。
膳食中的铁和血红素,可能通过它们对肠道共生细菌和结肠屏障功能的影响,影响肠道病变。Martin等[72]指出血红素铁通过醛类形成对黏膜动态平衡和肠道微生物群造成影响,进而达到重塑结肠腔环境的作用。Khalili等[73]对美国女性的全基因组进行关联研究,利用已建立的克罗恩病风险(CD)和溃疡性结肠炎(UC)易感性位点,根据基因-环境间相互作用来确定总铁、血红素铁与CD、UC风险之间的关系,为了解铁或血红素铁等环境因素可能参与IBD发病的潜在生物学途径提供了线索。
2.6 胆红素对肠道健康的影响
胆红素作为一种内源性代谢产物,长期以来一直被认为具有抗氧化和抗炎的特性[74]。已有研究表明血清总胆红素(serum total bilirubin,STB)对代谢综合征和糖尿病有一定的保护作用[75],其在体内水平的高低可能与IBD存在相关性[76]。Tian等[77]指出血清胆红素水平的降低和尿酸水平升高与溃疡性结肠炎有关。膳食摄入色素蛋白,在HO-1的作用下血红素分解成胆绿素,胆绿素在胆绿素还原酶的作用下转化为胆红素[40]。目前,关于胆红素对肠道保护的作用已有深入研究,Zhou等[78]发现未结合胆红素(UCB)可改善三硝基苯磺酸(TNBS)诱导的结肠炎炎症和消化蛋白酶活性升高,UCB减轻结肠炎的症状可能是通过调节肠屏障功能和免疫炎症来实现[79]。有关结肠炎的靶向药物研究发现,透明质酸-胆红素纳米药物(HABN)可积聚在急性结肠炎小鼠的结肠上,并通过影响促炎性巨噬细胞,调节先天免疫反应,恢复上皮屏障从而治疗结肠炎;同时,还可以增强肠道菌群丰富度和多样性[80]。在体外细胞试验中,Gundamaraju等[81]发现胆红素可以减轻内质网应激介导的炎症反应,促进LS174T结肠上皮细胞凋亡并抑制其增殖。虽然目前针对胆红素对肠道疾病尤其是结肠炎的改善已有较多报道,但是膳食源胆红素对肠道健康的维护及其可能引起的肠道微生物变化还鲜有报道。
3 展望
关于肌红蛋白和血红蛋白,在结构功能和消化方面已有大量研究,在膳食摄入方面,其经过消化后蛋白结构中的珠蛋白会逐渐被水解,形成具有特定生理功能的肽段,对机体的健康造成影响。血红素作为氧化应激的诱导者,虽然具有一定的生理毒性,但在低剂量条件下其具有的抗氧化抗炎等特性对肠道健康大有帮助,且其携带的铁元素则对体内铁稳态的维持至关重要。现阶段对肌红蛋白和血红蛋白膳食摄入的研究较少,在体内消化过程中,具有特定功能的血红素是如何被释放,吸收效率如何还不得而知。通过其在体内消化吸收路径的探究,明确各个组分对机体健康的影响,进而寻找合适的膳食摄入量,将为肉产品的健康膳食摄入提供理论指导。

