miR-138-5p调控SIRT1抑制结肠癌细胞增殖及迁移的研究
罗云春 胡 军 许 俊
(三峡大学 第一临床医学院[宜昌市中心人民医院] 肛肠科, 湖北 宜昌 443003)
结肠癌是最常见的消化系统恶性肿瘤之一,其在我国的发病率和死亡率均较高,且呈逐年上升趋势[1]。随着近年来靶向药物的临床应用及外科手术的不断进步,结肠癌的临床治疗效果显著改善,但患者的5年生存率仍保持在较低水平,其原因在于大部分患者确诊时已处于晚期阶段或肿瘤发生了转移[2]。因此,深入研究结肠癌发生的分子机制,寻找新的结肠癌诊治标志物,对于提高结肠患者的生存周期和生活质量具有重要的临床意义。
微小RNA(microRNA,miRNA)是一类非编码单链RNA分子,长度约为18~25个核苷酸,具有高度保守性[1]。通常情况下,miRNA可与特定基因mRNA的3’UTR区域进行配对结合,抑制靶mRNA的翻译过程或直接降解mRNA,从而实现对靶基因表达的调控。此外也有研究报道miRNA可与某些mRNA的5’UTR区域进行结合[2]。研究表明,miRNA参与了多种肿瘤细胞的增殖、凋亡和侵袭等生物学过程,并与肿瘤的诊断、治疗及患者预后密切相关。miR-138-5p是近年来发现在多种恶性肿瘤中存在差异性表达的一种miRNA,并起到重要调控作用。已有研究证实,miR-138-5p参与肺癌[3]、宫颈癌[4]、乳腺癌[5]及胰腺癌[6]等恶性肿瘤的发生和发展过程。但在结肠癌中,关于miR-138-5p调控作用及机制的研究少有报道。
本研究检测了结肠癌组织和细胞系中miR-138-5p的表达水平,并分析miR-138-5p与患者临床病理特征的相关性,并观察miR-138-5p对结肠癌细胞增殖、迁移和侵袭能力的影响,探讨其可能的分子作用机制。
1 材料与方法
1.1 一般资料
收集我院2018年1月~2019年6月收治的结肠癌患者72例,所有患者均行根治性切除手术,术中获取新鲜肿瘤组织及癌旁正常组织(>5 cm),取出后立即放入液氮保存,组织标本均经病理确诊。纳入标准:①患者未接受放化疗等其他抗肿瘤治疗;②患者均经细胞学和病理学确诊。排除标准:①患者合并有其他严重肝肾部位疾病;②患者临床分期无法确定;③患者伴随有其他肿瘤;④患者存在传染性疾病。本研究经我院伦理委员会批准,所有患者均签署知情同意书。
1.2 细胞培养及转染
人结肠癌细胞株(SW480、SW620、LOVO和HT29)及正常人结肠上皮细胞(FHC细胞)均购自于中国医学科学院基础医学研究所。所有细胞培养于含10%胎牛血清(Gibco,美国)的RMPI 1640培养基(含双抗)(Thermo,美国)中,置于37℃、5%CO2的培养箱中培养,每2~3天更换1次培养基。采用LipofectamineTM 2000转染试剂盒(Thermo,美国)进行细胞转染,根据转染物质的不同,将结肠癌细胞分为miR-138-5p组、阴性对照组(miR-NC组)及空白对照组(Blank组),通过RT-PCR检测转染效率。
1.3 RT-PCR检测
Trizol提取组织样本及细胞中总RNA,采用逆转录试剂盒(Takara,日本)进行逆转录反应获得cDNA。以cDNA为模板,后进行RT-PCR反应,反应条件为95℃、5 min;再40个循环的95℃、30 s,60℃、30 s,72℃、1 min。采用2-ΔΔCt法分析目的基因相对表达量。
miR-138-5p上游:5’-GGAGCTTCGGGAAGTTCA-3’,下游:5’-CAGTGCAGTGGTATTAGT-3’;U6上游:5’-CTCCAGGTAAGTGCACA-3’,下游:5’-AACCACACGTTGCGTGT-3’。SIRT1上游:5’-TAGGTCAAGCCTAGTGGACGGGA-3’,下游:5’-ACATTGCAGGGTACGTTCGTGT-3’;GAPDH上游:5’-ACCGACGTTACCGTCAACAC-3’,下游:5’-TCCAACGTACCGTTGGAGTA-3’。每个样本设置3个复孔。
1.4 CCK-8法检测细胞增殖能力
取生长状态良好的细胞,胰蛋白酶消化后制成单细胞悬液,以2×103/孔接种于96孔板,放入CO2培养箱进行培养。待细胞贴壁生长后,于检测前1 h加入10 μL/孔的CCK-8试剂,酶标仪检测各组细胞在0 h、24 h、48 h、72 h和96 h时450 nm波长下的OD值,每孔设置6个复孔。
1.5 细胞克隆形成实验
各组细胞用胰蛋白酶消化并制成单细胞悬液,以1×103/孔接种至6孔板,轻轻摇晃混匀后放入CO2培养箱中培养。约14天后肉眼可见克隆时终止培养,PBS缓冲液清洗,4%多聚甲醛固定10 min,再用1%结晶紫染色10 min,晾干后采集细胞克隆形成情况图片,每组设置3个复孔。
1.6 Transwell法检测细胞迁移和侵袭能力
细胞迁移实验:收集各组生长状态良好的细胞,用不含血清的RPMI培养液调整细胞浓度为3×105个/mL,取100 μL加入Transwell小室的上室,下室中加入500 μL含10%胎牛血清的RPMI培养液,常规培养24 h。用棉签擦拭上室的细胞,PBS缓冲液清洗,再用0.1%的结晶紫进行染色,置于倒置显微镜下观察并拍照,随机观察5个视野,计数穿膜细胞数,实验重复3次。
细胞侵袭实验:将Matrigel胶用无血清的RPMI 1640培养基在冰上按1∶8比例稀释,取25 μL Matrigel胶均匀铺设于Transwell上室,37℃无菌过夜晾干,加入100 μL细胞悬液,剩余步骤同细胞迁移实验。
1.7 双荧光素酶验证miR-138-5p与沉默信息调节因子1的靶向作用关系
构建沉默信息调节因子1(silent information regulator 1,SIRT1) 3’UTR野生型(WT)和突变型(MUT)质粒,将细胞悬液密度调整为3×105个/mL,接种于24孔板中,再将SIRT1野生型和突变型质粒与miR-138-5p和miR-NC共转染,24 h后采用双荧光素酶活性检测试剂盒对每组的荧光素酶活性进行检测,每个样本设置3个复孔。
1.8 Western blot
采用RIPA细胞裂解液提取各组细胞总蛋白,BCA试剂盒检测蛋白浓度。取20 μg蛋白样品进行SDS-PAGE电泳将蛋白分离,再经转PVDF膜、封闭后,加入鼠抗人SIRT1单抗(1∶1 000),4℃孵育过夜,以GAPDH作为内参,再加入辣根过氧化物歧化酶标记的二抗(1∶5 000),室温孵育2 h,经显色后采用化学发光仪检测,Quantity One软件进行图像分析。
1.9 统计学分析
采用SPSS 22.0软件对数据进行统计分析,所有数据均以均数±标准差表示,两组间比较采用独立样本t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 miR-138-5p在结肠癌组织和结肠癌细胞株中表达
RT-PCR检测结果显示,miR-138-5p在结肠癌组织中的表达水平显著低于癌旁正常组织,差异有统计学意义(P<0.01);与FHC细胞相比,miR-138-5p在4种结肠癌细胞株中表达均显著降低(均P<0.05),其中在SW480细胞的下调程度最大,如图1所示。

注:A:miR-138-5p在肿瘤组织和癌旁正常组织中表达情况; B:miR-138-5p在结肠癌细胞株中表达情况。与Normal组或FHC组相比,*P<0.05,**P<0.01
2.2 miR-138-5p与结肠癌患者临床病理参数相关性分析
根据miR-138-5p在72例肿瘤组织中相对表达量的平均值,将结肠癌患者分为miR-138-5p高表达组和miR-138-5p低表达组。分析发现,miR-138-5p与患者的肿瘤浸润深度、TNM分期和有无淋巴结转移具有显著相关性(均P<0.05),而与性别、年龄、肿瘤大小、肿瘤分化程度无明显相关性(均P>0.05),如表1所示。
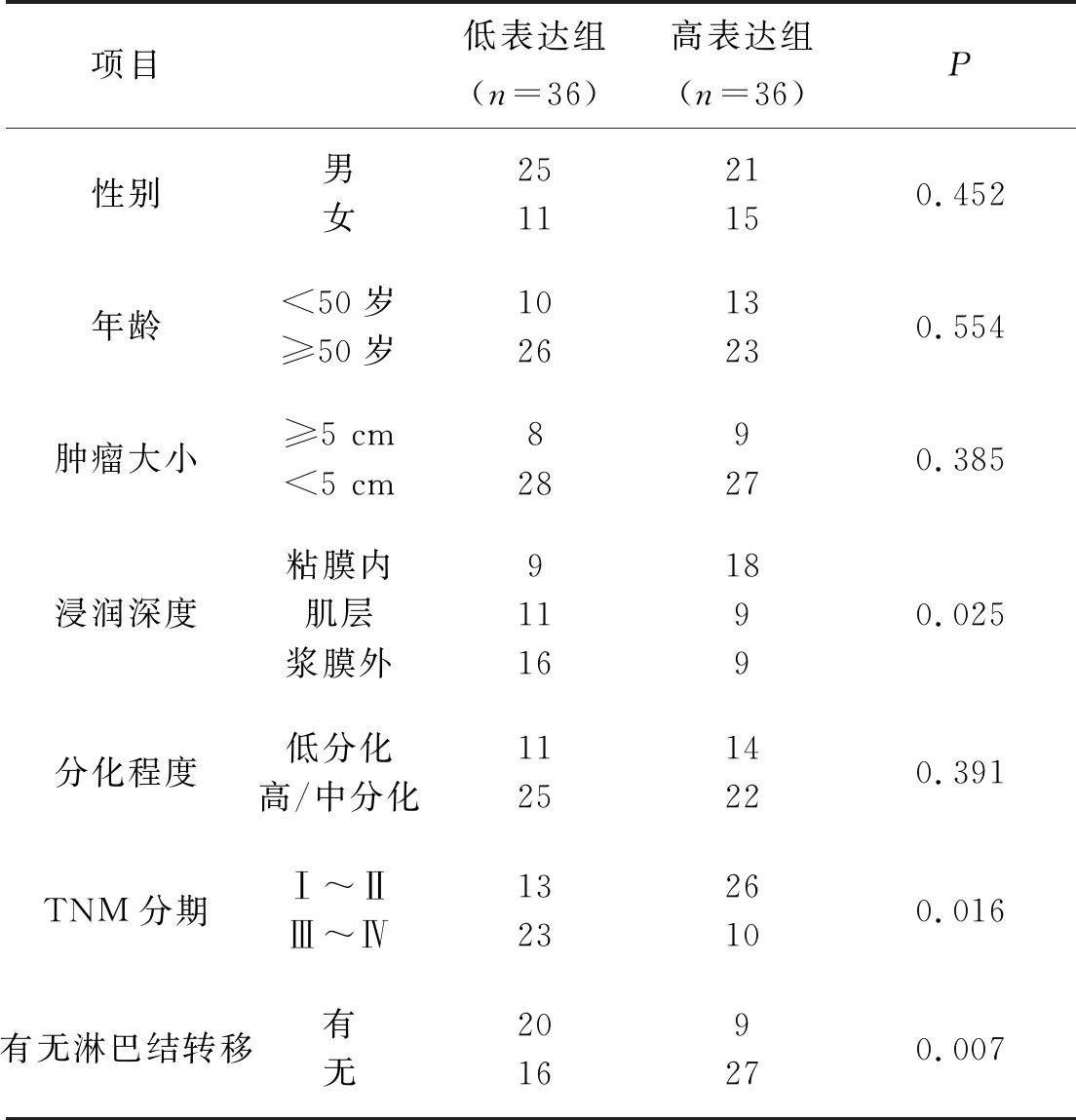
表1 miR-138-5p与结肠癌患者临床病理参数的相关性
2.3 miR-138-5p对结肠癌SW480细胞增殖活性的影响
RT-PCR检测结果显示,miR-138-5p组miR-138-5p的表达水平显著高于miR-NC组,而miR-NC组与Blank组的miR-138-5p表达水平无显著性差异(P>0.05),表明转染成功,如图2A所示。采用CCK-8法检测各组细胞不同时间点的增殖活力,并根据检测结果绘制生长曲线,结果显示,从48 h开始,miR-138-5p组细胞的增殖活性显著低于Blank和miR-NC组(均P<0.05),如图2B所示。细胞克隆形成实验结果显示,过表达miR-138-5p可抑制结肠癌SW480细胞克隆的形成数量(P<0.05),如图2C和2D所示。表明miR-138-5p可抑制结肠癌细胞的增殖能力。
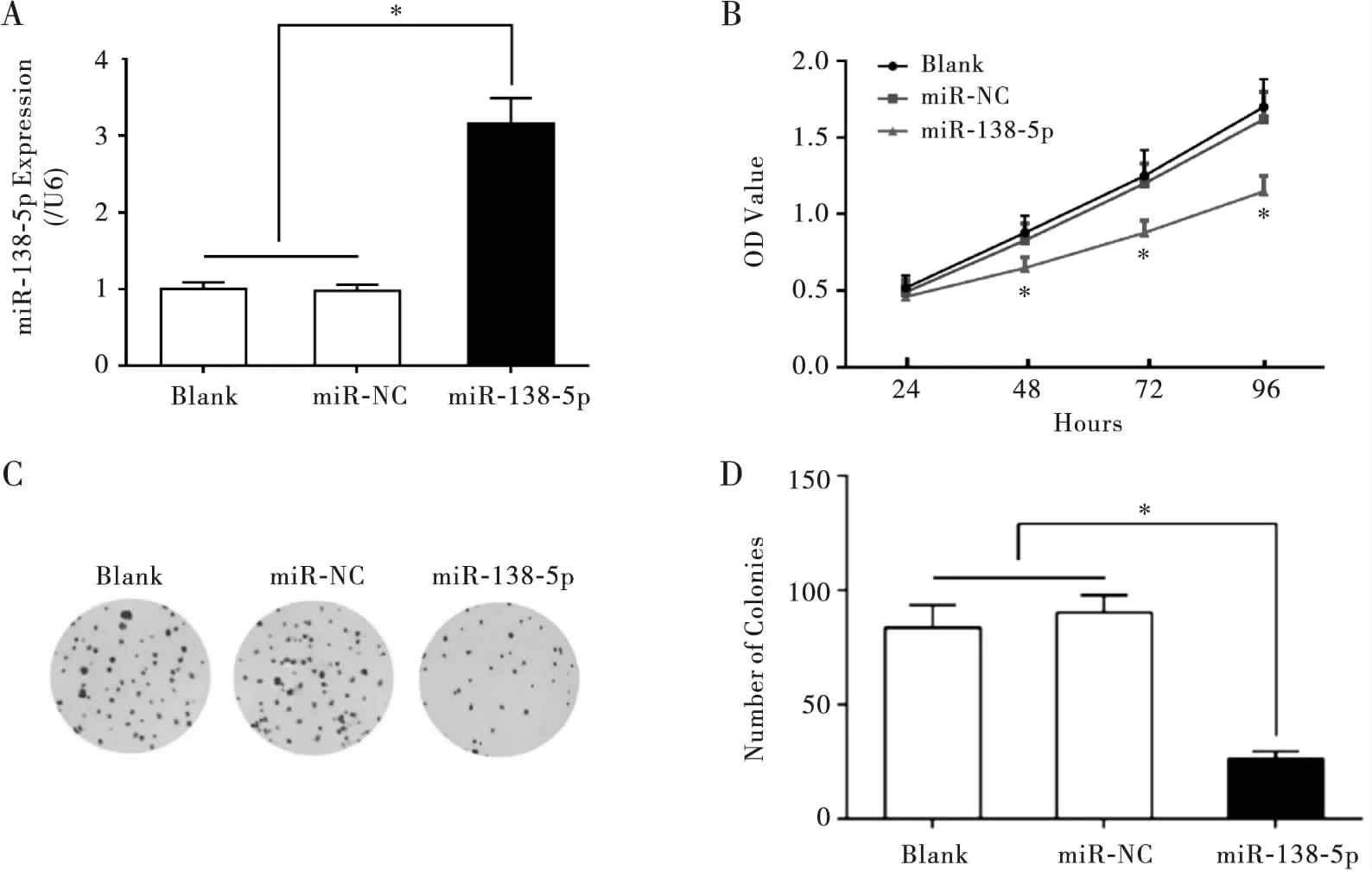
注:A:不同转染组细胞miR-138-5p的相对表达量,以U6为内参; B:CCK-8检测各组细胞增殖活性; C、D:各组细胞克隆形成数量对比。与Blank或miR-NC组相比,*P<0.05
2.4 miR-138-5p对结肠癌细胞迁移和侵袭能力的影响
Transwell实验结果表明,miR-138-5p组发生迁移和侵袭的细胞数量显著低于miR-NC组,差异均有统计学意义(均P<0.05),表明miR-138-5p可抑制结肠癌细胞的迁移和侵袭能力,如图3所示。

注:A上半部分、B:Transwell法检测SW480细胞的迁移能力; A下半部分、C:Transwell法检测SW480细胞的侵袭能力。与miR-NC组相比,*P<0.05
2.5 miR-138-5p与SIRT1的靶向作用关系
采用生物信息学网站TargetScan和miRanda预测发现SIRT1的3’UTR区与miR-138-5p存在结合位点。双荧光素酶检测结果显示,miR-138-5p可降低共转染SIRT1野生型的SW480细胞荧光素酶活性(P<0.05),而对SIRT1突变型细胞的荧光素酶活性无显著影响(P>0.05)。RT-PCR及Western blot结果显示,过表达miR-138-5p后,结肠癌细胞中SIRT1 mRNA及蛋白的表达水平均显著降低(均P<0.05),表明miR-138-5p可直接作用于SIRT1 mRNA的3’UTR从而抑制SIRT1的表达,如图4所示。

注:A:miR-138-5p与SIRT1存在直接结合位点; B:双荧光素酶验证miR-138-5p对SIRT1的直接靶向作用,WT为SIRT1野生型,Mut为SIRT1突变型; C、D:miR-138-5p对SIRT1 mRNA和蛋白表达的影响。与miR-NC组相比,*P<0.05
2.6 过表达SIRT1可逆转miR-138-5p的调控作用
为进一步证实miR-138-5p是通过靶向作用SIRT1发挥其对结肠癌细胞的调控作用,我们对miR-138-5p组细胞共转染SIRT1过表达质粒。CCK-8及Transwell检测结果显示,SW480细胞的增殖、迁移和侵袭能力均得到显著增强,差异有统计学意义(均P<0.05),表明SIRT1可在一定程度上逆转miR-138-5p对结肠癌细胞的调控作用,如图5所示。

注:A:CCK-8法检测各组细胞增殖活性; B~D:Transwell法检测各组细胞迁移和侵袭能力。与miR-138-5p组相比,*P<0.05
3 讨论
结肠癌的发生是一个涉及多因素、多步骤的复杂过程,常伴随多种基因的表达失调,深入研究结肠癌发生发展的分子机制,对于提高结肠癌患者的早期诊断和改善预后具有重要意义。研究发现,大部分miRNAs作用于与肿瘤进展相关的染色体区域,这些miRNAs可对肿瘤相关基因的转录表达发挥调控作用,进而影响肿瘤细胞的细胞周期、增殖、凋亡及上皮细胞间质转化(epithelial mesenchymal transition, EMT)等过程[7]。在结肠癌细胞中,存在多种差异性表达的miRNAs,有研究发现,miR-143在结肠癌组织中表达水平显著低于癌旁正常组织,过表达miR-143可抑制细胞的增殖并促进其凋亡[8]。Zhang等[9]研究发现,miR-185在结肠癌细胞中可通过靶向抑制Wnt1的表达,从而发挥对结肠癌细胞粘附、侵袭、迁移能力的抑制作用。另有研究报道,miR-139-3p可靶向结合IGF1R,从而抑制结肠癌的浸润和转移,并提高结肠癌细胞的化疗敏感性[10]。以上研究表明miRNA在结肠癌的发生发展过程中发挥了重要调控作用。
miRNA的表达具有组织特异性、保守性和时序性,这使得miRNA用于临床结肠癌的诊断、治疗评估、预后判断上具有巨大的潜力。miR-138-5p是miR-138家族成员之一,定位于第16号染色体上[11],在多种恶性肿瘤中表达下调,发挥类似抑癌基因的功能。赵军华等[12]研究发现,miR-138-5p可靶向抑制HIF-1α的表达,从而阻滞肾癌细胞周期,抑制肾癌细胞的增殖。原伟伟等[13]发现,miR-138-5p在胃癌中表达下调,过表达miR-138-5p可通过作用TCF3抑制胃癌细胞的增殖和迁移能力,并促进其凋亡。另有研究报道,miR-138-5p在膀胱癌中可靶向作用于Survivin基因,抑制膀胱癌细胞的EMT过程及侵袭能力[14]。在本研究中,我们发现miR-138-5p在结肠癌组织和结肠癌细胞系中表达均显著下调,且其表达水平与患者浸润深度、TNM分期和淋巴结转移具有显著相关性,表明miR-138-5p参与了结肠癌的发生且影响肿瘤进展程度。同时,过表达miR-138-5p后结肠癌细胞SW480的增殖、迁移和侵袭能力均显著降低,表明miR-138-5p可抑制结肠癌细胞的增殖、迁移和侵袭能力。
SIRT1属于去乙酰化酶组蛋白家族,其在哺乳动物体内主要定位于细胞核,在早期胚胎组织中含量丰富,是调节组织发育、代谢和衰老的重要蛋白[15-16]。近年来研究发现,SIRT1可通过去乙酰化参与多种恶性肿瘤的发生发展。多项研究证实,SIRT1可通过抑制p53及某些DNA修复蛋白的表达,促进结肠癌[17]、前列腺癌[18]和乳腺癌[19]等肿瘤的发生和进展。为明确miR-138-5p在结肠癌中的调控机制,我们首先通过生物信息学预测,发现SIRT1可能是miR-138-5p的下游靶基因,进而采用双荧光素酶实验进行验证,发现miR-138-5p可降低共转染SIRT1野生型SW480细胞的荧光素酶活性,而对SIRT1突变型细胞的荧光素酶活性无显著影响,表明miR-138-5p对SIRT1具有直接靶向作用。且过表达miR-138-5p可显著抑制结肠癌细胞中SIRT1 mRNA和蛋白水平,进一步证实了miR-138-5p对SIRT1表达的抑制作用。我们在miR-138-5p组细胞进一步转染SIRT1过表达质粒后,结肠癌细胞SW480的增殖、迁移和侵袭能力均得到显著增强,表明过表达SIRT1可在一定程度上逆转miR-138-5p对结肠癌细胞的调控作用,进一步证实了miR-138-5p是通过靶向作用SIRT1来发挥其对结肠癌细胞的调控作用。
综上所述,我们发现miR-138-5p在结肠癌中低表达,且其表达水平与肿瘤进展程度密切相关。miR-138-5p可通过靶向作用SIRT1发挥对结肠癌细胞增殖、迁移和侵袭能力的抑制作用。

