房室间隔缺损封堵器治疗气管食管瘘
张浩宇 宋新宇 熊晓琦 滕 林 李思佳
(1. 三峡大学 第一临床医学院[宜昌市中心人民医院] 呼吸与危重症医学科, 湖北 宜昌 443003; 2. 三峡大学 第一临床医学院[宜昌市中心人民医院] 心血管内科, 湖北 宜昌 443003)
气管食管瘘(tracheoesophageal fistula, TEF)是连接气管后壁和食道前壁的瘘管,由多种原因导致气管后壁发生坏死,并向后穿透气管壁,形成气管后壁与食管前壁间的异常通道[1]。TEF在临床上为一种罕见疾病,死亡率高。除传统的外科手术、内镜下介入治疗外,房室间隔缺损(atrial/ventricular septal defect, ASD/VSD)封堵也成为TEF治疗的新选择。ASD/VSD封堵器为一种自膨胀性的双盘结构,由镍钛合金丝编制而成,两盘之间通过腰部相连,在瘘道中提供支撑、封堵的作用,且边缘稍内凹,释放后可以相互扣住,从而进一步加强封堵作用[2]。正因为ASD/VSD封堵器自身具有以上特点,为治疗良恶性TEF提供了一种微创和安全的治疗选择。
1 手术适应证
ASD/VSD封堵器原用于先天性心脏病的封堵治疗。近年,随着大量新技术的开展,也成为了TEF最重要的治疗手段之一。2006年,国外就陆续开始有ASD/VSD封堵器治疗TEF的报道,并且成功率高达90%[3-4]。ASD/VSD封堵器用于TEF的治疗逐渐被临床医生广泛接受,技术逐渐成熟,适应证也逐步扩大。目前,除要求气管腔无明显狭窄外,对各种原因导致的TEF均可考虑[2]。TEF不再仅依靠单纯外科手术干预,对无外科手术指征或拒绝外科手术的患者,ASD/VSD封堵器治疗是较为理想的选择。当然, ASD/VSD封堵器治疗时仍需严格把握适应证,对严重心肺功能不全、有危及生命的基础疾病、瘘口周围存在感染等也需要临床医生谨慎考虑。
2 手术过程(扫码观看视频,D014138-2)
封堵器的选择:参照治疗先心病所选的尺寸[5],应与ASD/VSD封堵器伸展后的实际尺寸相当或大于1~2 mm,若封堵器过大容易影响周围组织循环,造成组织损伤、坏死等,而过小可能造成封堵器的移位、脱落[5]。
封堵方法:在局部麻醉、深度镇静镇痛或全麻下,经口插入硬质支气管导管或喉罩,连接呼吸机辅助通气,确认气管端瘘口位置(图1A~1B),将导丝通过支气管镜钳子管通道进入气管,穿过瘘口送入食管;退镜后重新进入气管,直视下经导丝引导将带芯的鞘管(9F)送入气管(图1C),其远端穿过瘘口进入食道,退出鞘芯和导丝,将输送钢缆穿过输送短鞘,通过螺纹连接系统将封堵器顺时针旋转连在输送钢缆上;将VSD封堵器和输送短鞘浸泡在生理盐水中,然后把封堵器拉入输送短鞘;将短鞘载入长鞘,输送钢缆将VSD封堵器推入长鞘内径瘘口到达食道(图1D);从食道入镜,直视下展开远盘和腰部,并轻轻将封堵器牵拉至紧贴食道壁(图1E);再经气管入镜,拉紧钢缆,直视下缓慢撤出外鞘管,释放近盘(图1F),用钢缆轻轻来回推拉封堵器,确保已固定在食道气管瘘口处,瘘口被完全封闭,气管、食管通畅。逆时针旋转钢缆使之与封堵器分离,撤出钢缆和鞘管,术毕。术后复查胸部CT,封堵器位置理想(图1G~1I)。
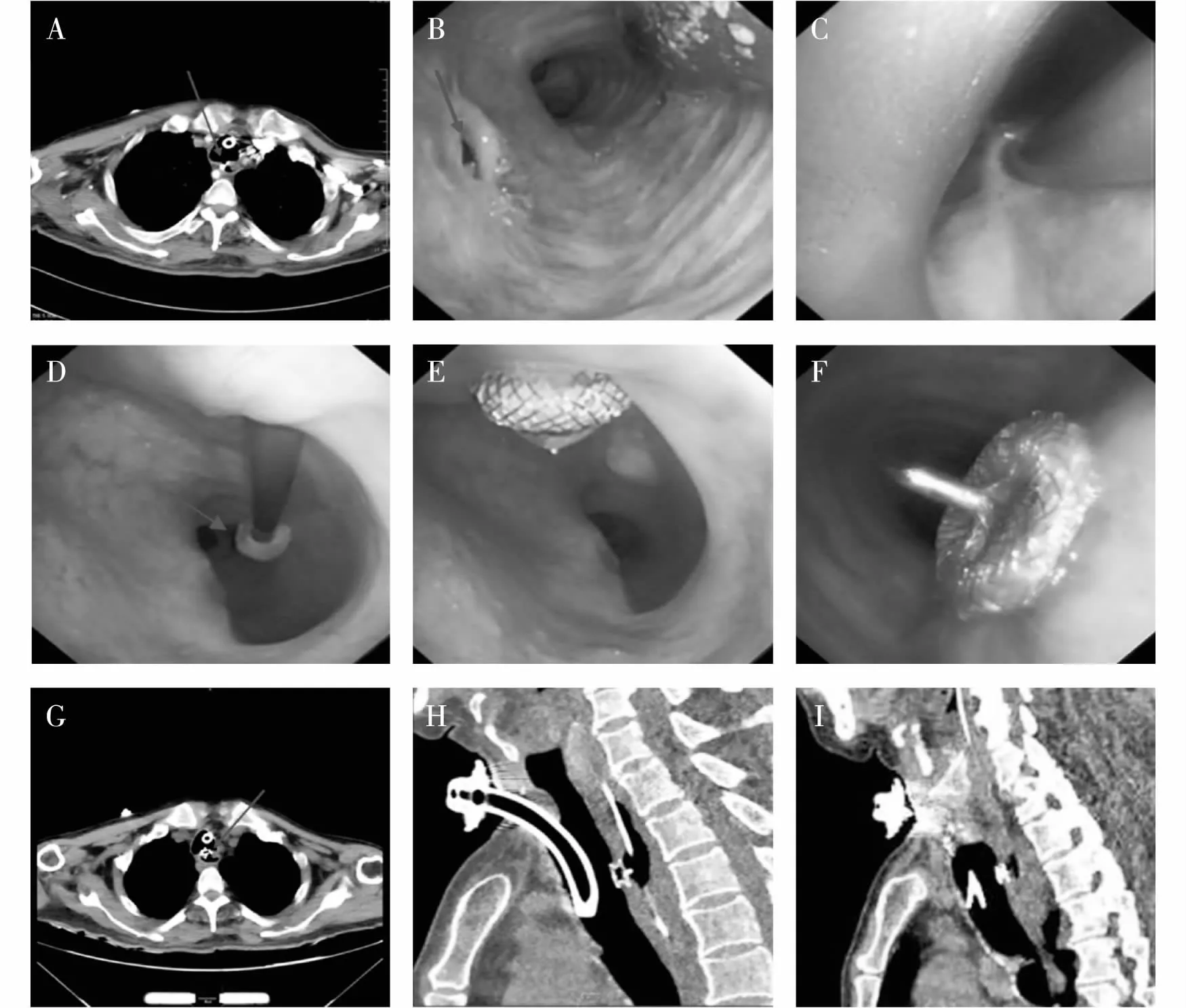
注:A、B:胸部CT和气管镜下确认气管端瘘口位置(红色箭头示);C:置入鞘管;D:顺鞘管置入VSD封堵器从瘘口到达食道(红色箭头示);E:食管端封堵器远盘贴壁良好;F:气管端封堵器近盘贴壁良好;G:CT示术后封堵器横断面(红色箭头示); H、I:CT示术后封堵器矢状面
3 回顾与展望
文献报道在良性疾病导致TEF的病例中,47%的患者是由于长时间机械通气引起的;在恶性疾病病例中,74%的食管肿瘤患者可并发TEF[6]。临床上TEF发生率虽不高,但是一旦形成瘘管,若治疗不及时,病死率极高。目前,TEF主要治疗方式包括外科手术、内镜下介入治疗及ASD/VSD封堵器治疗。外科手术治疗TEF虽然能够根治气管食管瘘口,但创伤面积大,胸腔感染机会增加,且存在二次复发率高、术后恢复时间长等缺点[7]。内镜下介入治疗,是指将支架置入术应用于TEF治疗中,具有高效、微创及成功率高等特点。但内镜治疗可能发生严重并发症,如支架碎裂、脱落或移位、支架压迫或侵蚀气管引起致命性气管狭窄、并发出血、穿孔、食物嵌顿、分泌物潴留和再次发生瘘等风险[8]。ASD/VSD成功应用于TEF治疗,不仅操作过程简单,而且短期有效性及安全性已在多项研究中证实[3-4,9]。另外,ASD/VSD封堵器能避免支架管腔覆盖导致痰液潴留的问题[7]。此外,ASD/VSD封堵器放置后可形成上皮化,诱导局部肉芽组织形成,最终加强瘘管的封堵效果[10]。然而,近年来报道的不良事件,如封堵器移位、脱落及气道狭窄等,成为了临床上亟待解决的难题[4]。此外,当前VSD/ASD封堵器治疗TEF在病例选择、疗效评价标准等方面无指南或专家共识指导,其器械的优化、远期预后的评估等仍有待进一步探究。

