Notch2在子痫前期患者胎盘中的表达及其对滋养细胞功能的影响
冯 祥 谭艳玲 许梦梵 熊呈凤 朱弘宇 叶 红 李 华
(1. 三峡大学 第一临床医学院[宜昌市中心人民医院] 产科, 湖北 宜昌 443003; 2. 三峡大学 人民医院[宜昌市第一人民医院] 骨科, 湖北 宜昌 443000)
子痫前期(preeclampsia,PE)为妊娠期特有并发症,其病因和发病机制尚不明确。目前研究表明,PE的发病与胎盘滋养层细胞侵袭和迁移能力降低进而导致胎盘浅着床及子宫螺旋动脉重塑不良有着重要联系[1-3],但有关滋养细胞侵袭、迁移功能的调控机制尚不清楚。研究表明,Notch2信号通路在胎盘滋养细胞上广泛表达,与滋养细胞增殖、分化、迁移等多个过程相关,可能对胎盘的功能产生重要影响[4-7]。本研究拟探讨Notch2对胎盘滋养细胞功能的影响,及其与PE发病产生的联系,为阐明PE的发病机制和寻找可能的临床解决方案提供依据。
1 实验材料及方法
1.1 组织实验
1.1.1 胎盘组织的收集
孕早期绒毛标本:2020年7月~2020年8月在我院要求行人工流产的孕6~8周的患者,无不良孕产史和家族史,选取活胚胎绒毛5例。胎盘:选取2020年1月~2020年10月在我院产科分娩的孕晚期正常产妇胎盘10例,PE患者胎盘6例。标本收集后用无菌生理盐水漂洗,并立即用4%的甲醛液固定待用。PE的诊断标准依据谢幸教授主编的第9版《妇产科学》。所有研究对象均为单胎,既往无肾脏疾病、心脏病、高血压、甲状腺功能亢进、糖尿病及导致血管病变和缺氧改变的其它合并症,且孕期无急、慢性感染性疾病。该研究获得我院伦理委员会批准,所有受试者均知情并同意。
1.1.2 免疫组化
将蜡块包埋后的绒毛及胎盘组织切片,进行免疫组化实验。具体操作步骤按照辣根酶标记链酶卵白素免疫组化试剂盒说明书(凯基生物)进行。CK7一抗浓度为1∶300,Notch2一抗浓度1∶250(下同)。
1.2 细胞实验
1.2.1 主要试剂
RIPM1640培养基和胎牛血清(Gibco)、多克隆兔抗cytokeratin7(CK7)抗体(Abcam)、Notch2多克隆抗体(Cell Signal Technology)、MTT试剂盒(博奥拓达)、基质胶(BD Matrigel)。
1.2.2 细胞培养及分组
人绒毛膜滋养层细胞株HTR8/SVneo购自美国模式菌种收集中心,用含10%胎牛血清的RIPM1640培养基培养。细胞实验分组:Control组细胞无任何干预;空白慢病毒载体作为阴性对照组(Notch2 Negative Control, Notch2-NC);Notch2 siRNA慢病毒转染为Notch2 siRNA实验组。
1.2.3 免疫荧光染色法
HTR8/SVneo株处理后经过爬片,在4℃条件下用4%多聚甲醛固定10 min;PBS漂洗3次,常温下山羊血清封闭1.5 h;滴入浓度为1∶250的兔抗人Notch2多克隆一抗抗体,4℃孵育48 h;PBS漂洗3次,用浓度为1∶50的异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的二抗37℃避光孵育2 h;碘化丙啶(propidium iodide,PI)荧光染核1.5 min;PBS漂洗封片。激光扫描共聚焦显微镜观察目标蛋白的表达情况及位置。
1.2.4 慢病毒载体构建与细胞病毒转染
干扰慢病毒由上海吉玛公司包装。Notch2小干扰RNA序列(5’-GCAGGTAGCTCAGACCATTCT-3’)克隆入慢病毒载体产生Notch2 siRNA慢病毒。将处于对数生长期的细胞消化重悬后,接种于6孔板,生长过夜;按照病毒滴度加入稀释后的慢病毒载体液。空白慢病毒载体转染的细胞作为对照组Notch2-NC,Notch2 siRNA慢病毒转染细胞作为实验组。混合均匀后放置培养箱培养至相应时间点,检测Notch2 mRNA下调效果,挑选最佳孵育时间的细胞作为实验对象。
1.2.5 MTT实验
用含10%胎牛血清培养液配置单细胞悬液,以每孔1×104细胞接种到96孔板,每孔体积200 μL。Notch2-NC对照组和Notch2 siRNA实验组按照病毒滴度加入Notch2空白慢病毒和干扰慢病毒,分别培养24 h、48 h、72 h;每孔加200 μL MTT溶液(0.5 mg/mL,PBS配制),37℃孵育4 h,小心吸出孔内上清,每孔加入200 μL DMSO,振荡混匀10 min,使结晶物融解充分。酶标仪上选取560 nm波长,测定OD值,分析计算结果。
1.2.6 Real time PCR检测Notch2 mRNA的表达
PCR引物由上海生物工程技术有限公司合成,Notch2上游引物:5’-CCTTCCACTGTGAGTGTC-TGA-3’,下游引物:5’-AGGTAGCATCATTCTGGCAGG-3’。GAPDH上游引物;5’-GAAGGTGAAGGTCGGAGTC-3’,下游引物:5’-GAAGATGGTGATGGGATTTC-3’[8]。根据总RNA提取试剂盒(TaKaRa)说明书提取HTR8/SVneo细胞的总RNA,取1 μg mRNA样本逆转录为cDNA,按PCR试剂盒说明步骤加入反应体系,使用荧光定量PCR仪进行扩增,反应总体系为20 μL,内参为GAPDH,检测Notch2 mRNA水平。PCR循环为:95℃预变性10 min,95℃变性15 s, 60℃退火20 s,72℃延伸15 s,45个循环。使用2-ΔΔCt法统计mRNA的相对表达量。
1.2.7 Transwell侵袭及迁移实验
(1)细胞迁移实验
将病毒载体感染的细胞用胰酶消化,上室中加入200 μL无血清培养基重悬的细胞悬液(1.5×105个细胞),在Transwell下室加入600~800 μL含10%胎牛血清的培养基。置培养箱孵育24 h,小心取出Transwell小室,去除上室液体,用湿棉棒轻柔擦去上室内底部滤膜表面的细胞,滤膜外表面的细胞为实验有效细胞,用多聚甲醛固定10 min,甲醇通透10 min,PBS液洗涤3次,结晶紫染色3~5 min。随机选择10个视野,细胞计数后进行统计比较。
(2)细胞侵袭实验
基质胶在4℃过夜融化,基质胶与提前预冷的无血清培养基按1∶5比例稀释混匀,冰上操作。在Transwell小室底部中央垂直均匀加入稀释好的基质胶60 μL,37℃孵育40 min,固化成胶状后待用;再加入50 μL无血清培养基孵育30 min使基膜水化。其余步骤同细胞迁移实验。
1.3 统计学方法

2 结果
2.1 Notch2在绒毛和胎盘组织的表达
通过免疫组化检测Notch2蛋白在孕早期绒毛、孕晚期正常胎盘和PE胎盘上的表达情况。早期绒毛组化切片观察到了绒毛上滋养细胞侵袭进入到母体蜕膜层的过程(图1A),与Zhao等[9]研究中滋养细胞侵袭迁移到蜕膜过程的示意图相同(图1B)。

注: A:免疫组化检测Notch2蛋白(棕色)在孕早期绒毛的滋养细胞和基质细胞上都有表达,但在滋养细胞表达水平较高,同时功能细胞(EVT、CC、CT、ST)上也有Notch2蛋白的表达;B:Zhao等[9]研究中孕早期绒毛滋养细胞侵袭到蜕膜层示意图,早期绒毛锚定附着在母体蜕膜(MD)上,滋养细胞(CT)增殖形成细胞柱(CC),粘附在母体蜕膜(转化的子宫内膜)上,绒毛外滋养细胞(EVTs)侵入母体蜕膜和肌层;C:正常胎盘组织上的Notch2表达,可见Notch2在胎盘的滋养细胞和基质细胞上均有表达,但主要在滋养细胞上表达;D:PE胎盘上Notch2蛋白的表达,其表达水平低于正常组胎盘;E:未加一抗的胎盘组织为空白对照组;F:CK7标记的胎盘滋养细胞位置。CT:滋养细胞;EVT:绒毛外滋养细胞;CC:细胞柱;MD:母体蜕膜;ST:合胞体滋养层;VS:绒毛基质;IVS:绒毛间隙;ET:血管内滋养层细胞
免疫组化结果显示,Notch2蛋白在孕早期绒毛、孕晚期正常和PE胎盘上都有表达,表达位置主要在滋养细胞上(图1)。通过分析Notch2蛋白免疫组化结果的吸光度来评估其表达水平,发现在孕早期绒毛上Notch2蛋白相对表达量与孕晚期正常胎盘组织表达量相比,差异无统计学意义(P>0.05);PE组的Notch2蛋白相对表达量与孕早期绒毛及正常组相比明显下调(均P<0.05,图2)。
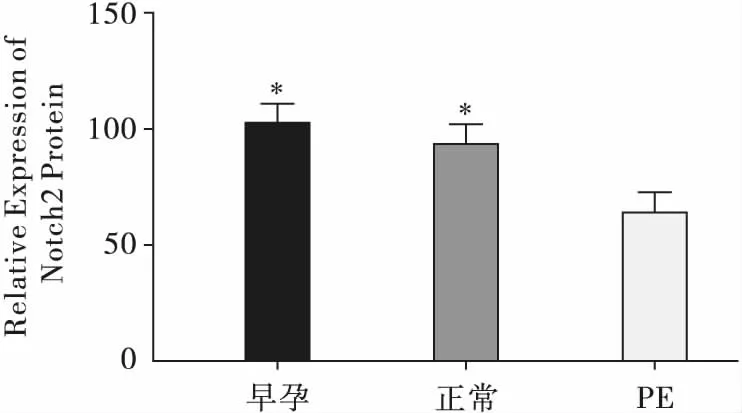
注:与PE组相比,*P<0.001
2.2 Notch2蛋白在滋养细胞株HTR8/SVneo的表达
细胞免疫荧光结果提示,Notch2蛋白在HTR8/SVneo细胞有丰富的表达(图3),表达的主要位置为胞膜。

注:Notch2蛋白在HTR8/SVneo细胞上均有表达,FITC染色绿色荧光为目标蛋白,PI红色荧光为细胞核
2.3 Notch2 siRNA转染对HTR8/SVneo细胞侵袭和迁移能力的影响
Notch2 siRNA转染HTR8/SVneo细胞24 h、48 h、72 h后,与Notch2-NC组相比,Notch2 mRNA的表达水平均明显下调(均P<0.001,图4A)。MTT检测结果显示,Notch2 siRNA组的HTR8/SVneo细胞生存率与Control组或Notch2-NC组比较,差异均无统计学意义(均P>0.05,图4B)。Transwell检测结果显示,Notch2 siRNA转染组HTR8/SVneo细胞的侵袭和迁移能力与Notch2-NC组相比均呈下降趋势,差异均有统计学统意义(均P<0.001,图5)。

注:A:Notch2 siRNA转染HTR8/SVneo细胞后Notch2 mRNA表达水平;与Notch2-NC组相比,*P<0.001; B:Notch2 siRNA转染对HTR8/SVneo细胞生存率的影响

注:A:具有代表性的细胞侵袭和迁移实验图像; B:细胞迁移实验中HTR8/SVneo细胞的个数定量后的统计结果; C:细胞侵袭实验中HTR8/SVneo细胞的个数定量后的统计结果。与Notch2-NC组相比,*P<0.001
3 讨论
PE是妊娠期特有并发症,严重威胁孕产妇及胎儿的生命安全,已经成为孕产妇和围产儿疾病率和死亡率升高的主要原因之一,但是其病因和发病机制至今尚未完全阐明。临床资料显示,随着胎盘的娩出,PE的临床症状可迅速消失,可见胎盘在PE的发生发展中起着重要作用[10-11]。目前研究表明,在妊娠阶段,胎盘滋养细胞作为一种特殊的细胞,其侵入母体的子宫蜕膜层和肌层,重塑子宫螺旋动脉,是胎盘形成和发挥功能的重要结构。胎盘滋养细胞侵袭迁移能力不足可导致螺旋动脉重塑不足和胎盘植入过浅,进而产生多种妊娠期并发症,如PE、胎儿宫内发育迟缓、胎儿宫内缺氧等[12-13],但至今有关滋养细胞侵袭迁移功能的调控机制尚不清。
Notch信号通路广泛存在于脊椎动物和无脊椎动物中,在进化上高度保守,对细胞、组织和器官的分化、发育及凋亡等生物过程的调控至关重要。哺乳动物Notch信号通路有4个受体(Notch1-4)和5个配体(Jag1、2和Dll1、3、4)[14-15]。越来越多的证据表明,Notch信号通路也广泛存在于哺乳动物胚胎和胎盘中,可能对胚胎和胎盘发育起着重要的调控作用。目前对Notch信号通路在哺乳动物胚胎和胎盘中的具体作用研究有限。前期研究提示,Notch2蛋白与小鼠滋养细胞的侵袭和迁移有关[16]。同时有研究证据显示,Notch2蛋白在人类胎盘上也有表达[6,17],但是对于人类滋养细胞的侵袭迁移能力的影响尚不明确。
孕早期绒毛主要由具有侵袭和迁移能力的滋养细胞构成。本结果显示,Notch2蛋白在人类早期绒毛滋养细胞上有很高的表达水平,提示Notch2有可能与孕早期滋养细胞的侵袭迁移功能有关。孕晚期胎盘组织的滋养细胞也维持着一定水平的侵袭迁移性,我们在孕晚期正常胎盘组织上也检测到了较高水平的Notch2蛋白表达,表达部位主要是滋养细胞。而在PE患者的胎盘上,Notch2表达水平低于正常胎盘组织。且既往研究也显示,在PE患者的胎盘组织中Notch2 mRNA的表达水平也明显降低[6,8],这一结果提示Notch2表达降低与PE发病可能有相关性。但是在Notch2蛋白对滋养细胞侵袭和迁移能力的影响上,前期研究结果不尽相同[7,18-19]。本研究结果显示,Notch2表达下调后,HTR8/SVneo细胞的侵袭和迁移功能均明显下降。赵卫秀等[18]研究显示,Notch2仅对BeWo细胞的迁移功能有显著影响,对BeWo细胞的侵袭及JAR细胞的迁移、侵袭功能均无影响,这与本研究使用HTR8/SVneo细胞株得到的实验结论不一致。细胞株之间基础Notch蛋白表达量存在差异、细胞株之间的侵袭迁移能力存在差异,可能是导致实验结果不一致的原因。
本研究也存在一定的局限性,实验采用的细胞材料为HTR8/SVneo滋养细胞株,而非原代滋养细胞,其功能变化不能完全代表原代滋养细胞;再者,没有进行动物实验进一步验证结论,也未深入探索Notch2对细胞株迁移及侵袭影响的分子机制和信号通路。
综上所述,Notch2表达差异影响滋养细胞的迁移和侵袭功能,其表达水平下降,导致滋养细胞侵袭迁移能力下降,该过程可能与PE发病相关。
——婴儿纸尿裤是绒毛浆最大的应用市场

