晚期胆囊癌肝转移转化治疗后R0切除一例
费佳伟,冯文明,王耀
(湖州师范学院附属第一医院/湖州市第一人民医院 肝胆胰外科,浙江 湖州 313000)
胆囊癌(GBC)是胆道系统常见的恶性肿瘤,占胆道系统恶性肿瘤的80%~95%,居消化道肿瘤第6位[1],其发病率和病死率近年呈上升趋势[2]。目前针对GBC有手术治疗、化疗、放疗、免疫抑制剂治疗等方法,这其中手术切除仍被认为是最佳治疗方法[3]。由于GBC发病隐匿、进展快、早期无症状等特点,大多数患者在确诊时已经是中晚期,仅约19%的患者有根治性手术机会,治疗效果较差[4]。GBC患者的中位生存时间不到1 年,总生存率约为17.8%~21.7%[5]。有研究显示,T1期的GBC患者5年生存率可达85.9%,然而T3 期和T4 期患者的5年生存率分别仅为19.2%和14.1%[6]。因此,对于晚期GBC如果能成功转化降期,达到R0手术切除,就能明显改善患者生存状况。针对晚期GBC患者成功转换并进行手术的案例较少,我科近期通过循证医学方法对1例晚期GBC患者行转化治疗,最终行R0根治性切除,治疗效果显著,现报道如下。
1 病例资料
1.1 一般资料
患者女性,49岁,因“右上腹疼痛7 d”于2021年8月入我院,既往无基础疾病,腹部查体未见阳性,化验项目:血常规、血生化、凝血功能、术前病毒均未见明显异常,肿瘤标志物CA125 60 U/mL,其余肿瘤标志物均在正常范围内。检查项目:CT提示患者GBC侵犯肝脏,肝门部及胰头后方淋巴结转移(图1)。诊断:GBC伴肝转移、肝门部及胰头后方淋巴结转移(晚期GBC)。多学科MDT讨论:该患者CT和MRI提示肿瘤存在肝转移,肿大淋巴结包绕门静脉主干、肝动脉。笔者通过检索文献,寻找循证医学证据,发现即使联合血管重建的扩大GBC根治手术,能实现R0切除的可能性仍很小,况且扩大的根治术风险大,术后并发症风险高[7];另外,肝十二指肠韧带侵犯、淋巴结受累和血管切除是重要的预后因素,尽管采用扩大根治术进行R0切除,这类GBC患者的预后也相对更差[8]。综合考虑,本病例不适合直接手术。结合最新的有关化疗、免疫、靶向治疗等综合治疗的研究报道,本病例的治疗方案是:行综合转化治疗,使肿瘤降期;达到R0 切除后,再行手术治疗,以此提高治疗效果,延长患者生存时间。
1.2 转化治疗
鉴于免疫治疗的良好应答率,我们对患者的穿刺标本进行了基因检测,化疗药物位点检测提示:顺铂疗效可能较差,毒副作用风险可能较高;而奥沙利铂疗效可能较好;基因检测分析发现了3 个与免疫抑制剂疗效相关的基因发生变异:BRCA2突变、MSH6突变、TERT突变。结合循证医学证据和患者本人意愿,多学科MTD讨论后,决定给予GEMOX化疗联合免疫抑制剂治疗的转化治疗方案。
自2021 年8 月起对患者实施GEMOX化疗方案(吉西他滨1 000 mg/m2,d1、d8静脉给药+奥沙利铂100 mg/m2,d1静脉给药,21 d/周期)+PD1免疫治疗(特瑞普利单抗240 mg,d1静脉给药,21 d/周期),化疗期间曾有发热1次,对症治疗后未曾出现,其余无明显化疗副作用。给予3个周期化疗+免疫治疗后评估效果。腹部增强CT提示:胆囊肿块明显缩小,肝脏未见明显转移灶,肝门部、门静脉后方淋巴结明显缩小(图1),根据mRECIST评估标准,达部分缓解(PR),具备R0切除手术机会。

图1 腹部CT检查
1.3 手术治疗
在全麻下行GBC根治:胆囊切除+肝方叶切除+淋巴结清扫。术中探查肝脏、腹膜未见转移结节,肝门部、门静脉后方可触及数枚质硬肿大淋巴结,行完整切除(图2)。

图2 术中手术视野,行胆囊切除+肝方叶切除+淋巴结清扫
术后病理(图3):肿瘤床约4.0 cm×3.5 cm×2.5 cm,侵及外膜,肿瘤大片坏死退变、纤维化、组织细胞反应,残留肿瘤为低分化鳞状细胞癌,病灶约1.3 cm×1.0 cm×1.0 cm,位于黏膜固有层,向胆囊腔内生长,周围黏膜腺上皮异型增生,(切片内)神经、脉管未见癌累及,胆囊管切缘阴性,肝切缘阴性;淋巴结:“7、8、9组”0/18、“12、13组”0/4,未见癌转移/残留,其中“7、8、9组”1颗、“12、13组”1颗,见纤维化及组织细胞反应,符合转移癌治疗后反应。免疫组化:p53(-),p63(+),p40(+),CK5/6(+),CK7(灶性+),CK19(+),CEA(-),CK20(-),HepPar-1(-),Glypican3(-),CD56(-),Ki-67(+,80%)。
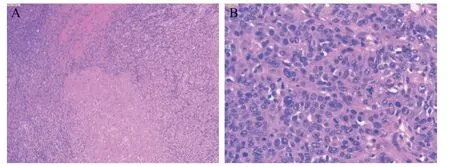
图3 术后病理
1.4 术后随访
患者术后1周顺利出院,无并发症发生。术后继续2 周期原方案化疗联合免疫抑制剂治疗。术后随访至2022年6月30日,无复发转移征象。
2 讨论
2.1 转化治疗依据
转化治疗(conversion therapy)也称转化手术(conversion surgery),最开始是由Bismuth等[9]提出,该理念最早用于结直肠癌肝转移的治疗,其目的通过全身性系统药物治疗达到肿瘤降级降期,最终进行根治性手术。在GBC转化治疗方面,吴向嵩等[10]曾报道1例GBC术后复发,通过转化治疗后行R0切除,随访6个月内未见复发。Okumura等[11]报道1例62岁女性晚期GBC(伴S4、S8段肝转移),经过4个周期的吉西他滨+口服替吉奥方案化疗后,发现主要病灶明显减小,肝转移灶消失,6个周期后1个月行手术治疗,术后病理提示S8段肝脏未见肿瘤细胞,且随访1 年半内未出现复发。虽然转化和新辅助治疗定义上存在一定区别,但二者都是在术前进行综合治疗,提升外科手术效果,进而提高患者术后生存率。Creasy等[12]回顾性分析74例因局部晚期或淋巴结阳性的GBC患者,在进行吉西他滨为基础的化疗后,最终10例(14%)成功切除,手术切除患者的中位OS为51个月,而不可切除患者的中位OS为11个月(P=0.003)。Hakeem等[13]对8项GBC新辅助治疗研究进行Meta分析,474例患者中398例(84.0%)接受新辅助化疗,76 例(16.0%)接受新辅助放化疗,最终纳入统计的434 例行新辅助治疗的患者中有133例(30.6%)出现疾病进展,总体临床获益率为66.6%;接受根治性手术的191例(40.3%)中R0切除率为35.4%,患者OS为18.5~50.1个月,而未接受手术的患者OS仅为5.0~10.8个月(P<0.01)。由此可见,通过术前的系统转换和新辅助治疗,可以对肿瘤降期,使病灶缩小后达到手术切除条件,最终延长患者OS。
2.2 转化治疗的方案选择
目前晚期GBC的一线治疗标准仍是以ABC-02研究[14]为基础的吉西他滨+顺铂化疗方案,吉西他滨+顺铂、吉西他滨单药治疗的GBC中位生存时间分别为11.7个月和8.1个月(P<0.001),联合用药的疾病控制率达到81.4%。Chaudhari等[15]对160 例局部进展期或交界可切除GBC患者行新辅助化疗,采用GP(吉西他滨+顺铂)或者GEMOX(吉西他滨+奥沙利铂)化疗方案,结果显示临床获益率70%,16例(10%)完全缓解,68例(42.5%)部分缓解,28例(17.5%)病情稳定,其中达到完全病理缓解的患者有7例(10.6%),对比GP/GEMOX两种化疗方案的反应率无统计学差异(P=0.068);最终完成手术切除的患者有66例(R0切除的有63例),接受手术治疗的患者比未手术的患者OS明显延长(49 个月vs7 个月,P=0.0001),无病生存期明显延长(25个月vs5个月,P=0.0001)。
随着免疫治疗的发展,研究发现多种肿瘤中的程序性细胞死亡蛋白(programmed cell death protein 1,PD-1)与其配体PD-L1 结合的免疫检查点途径,在肿瘤细胞引起的免疫抑制中起主要作用。Kim等[16]发布了一项54 例晚期胆道肿瘤患者使用纳武单抗单药治疗的Ⅱ期研究报告,结果显示患者治疗后客观缓解率11%,疾病控制率50%;患者中位无进展生存期和中位OS分别是3.68 个月和14.24 个月,并且患者毒性反应发生率低、耐受性良好。免疫检查点抑制剂卡瑞利珠单抗或纳武单抗对有高度微卫星不稳定或dMMR的不可切除或复发的GBC患者有效[17]。国内一项Ⅱ期研究结果显示,该项免疫治疗联合GEMOX化疗方案可使晚期胆道肿瘤(含GBC)客观有效率达54%,中位总生存期达11.8个月[18]。
随着系统治疗的发展,化疗联合放疗、靶向治疗、免疫治疗等综合治疗模式,是当今转化治疗的发展方向[19-20]。国内有报道GEMOX方案联合靶向治疗(西妥昔单抗、曲妥珠单抗和阿帕替尼),能使晚期GBC患者中位OS达15.5 个月,部分缓解率达19.0%,疾病控制率达61.9%[21]。目前,以GBC为代表的胆道恶性肿瘤仍缺乏特别高效的转化治疗方案,需结合患者实际情况、肿瘤高通量测序、免疫组化等,有选择性地进行联合或续贯化疗、靶向药物及免疫治疗,尽可能提高抗肿瘤治疗的客观反应率,从而为根治性手术提供机会。
2.3 小结
本例患者因发现胆囊占位收治住院,无明显特异性临床症状,住院行CT、MRI进一步评估后,考虑GBC伴肝转移、伴肝门部多发淋巴结转移、伴门静脉后方淋巴结转移。综合循证医学证据,该患者不适合直接手术。我们选择GEMOX化疗联合免疫抑制剂的转化治疗方案,患者转化效果显著,从病理结果得知患者肿瘤大片坏死退变,残留肿瘤为低分化鳞状细胞癌,达到主要病理缓解(MPR)。
本团队根据循证医学证据,多学科协作,结合患者实际,制定个体转化治疗方案,顺利手术切除病灶,让患者获益,延长生存时间。