蛋白激酶C-θ在免疫中的研究进展①
孙明珠 赵龙昊 徐扬(辽宁师范大学生命科学学院,七鳃鳗研究中心,大连 116081)
1 PKC-θ简介
蛋白激酶C(protein kinase C,PKC)家族是一类依赖磷脂和钙离子的丝氨酸/苏氨酸蛋白激酶。通常,PKC分子中含有4个相对保守区(C1、C2、C3、C4)和5个可变区(V1、V2、V3、V4、V5)。根据PKC分子结构和所需辅助因子的不同可分为:经典的PKC(conventional PKC,cPKC),新型PKC(novel PKC,nPKC)和非典型的PKC(atypical PKC,aPKC)[1-2]。有关PKC家族分子成员及其分类,见表1。

表1 PKC家族分子成员的分类Tab.1 Classification of molecular members of PKC family
PKC-θ是一种不依赖于钙离子激活的nPKC亚型,最初是在白血病红细胞中被分离鉴定的[3]。PKC-θ基因定位于人类10号染色体短臂,主要在T细胞、骨骼肌细胞和造血系统中表达。其中,骨骼肌和淋巴器官中表达最高,胸腺和淋巴结中次之,脾脏中较少,骨髓中不表达[4]。PKC-θ蛋白的C1结构域有2个锌指状Cys富集区,可以与二酰甘油(diacylglycerol,DAG)结合,C2结构域主要调节PKC-θ与膜之间的相互作用,自身假底物序列(pseudosubstrate sequence,PS)通过抑制催化酶结构域来调节其激酶活性,C3结构域为与ATP结合提供能量,C4结构域具有激酶活性[5]。在PKC-θ中,只有C1b结构域能够有效结合佛波酯,有研究解释了PKC-θ的C1a结构域与配体结合力较弱的原因,通过共聚焦实验观察发现,PKC-θ中C1a和C1b结构域之间有12个不同的氨基酸残基对配体的结合力存在着一定差异,C1a结构域中P168残基和C1b结构域中K240残基起关键作用[6]。研究发现,PKC-θ独特的V3结构域内富含脯氨酸的基序,对于定位并固定其免疫突触是必不可少的[7]。PKC-θ的活性是通过自身变构实现的,不同的磷酸化位点对于调节构象进而改变激酶活性的作用不同。例如,Y90是淋巴细胞蛋白酪氨酸激酶(lymphocyte protein tyrosine kinase,LCK)的结合部位;T219是参与其下游信号通路必需的自磷酸化位点;T538是受磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)调节的磷酸肌醇依赖激酶-1(phosphoinositide-dependent kinase 1,PDK1)的磷酸化位点,参与调节PKC-θ的催化功能;S676/S695是自磷酸化位点,参与调节PKC-θ的激酶活性[1]。PKC-θ的结构示意图如图1所示。

图1 PKC-θ的结构示意图[1]Fig.1 Structure diagram of PKC-θ[1]
2 PKC-θ在TCR信号通路中的作用
TCR是T细胞表面的受体,可识别抗原呈递细胞(antigen-presenting cells,APC)表面的主要组织相容性复合物(major histocompatibility complex,MHC),两者形成复合物后引起下游通路的一系列信号传递。结合磷酸酪氨酸的PKC-θ是TCR诱导的T细胞活化、增殖和辅助型T细胞2(T helper 2 cell,Th2)分化所必需的,PKC-θ在调节TCR近端信号的正反馈调节回路中起着重要作用[8]。
2.1PKC-θ对转录因子的调控作用核因子κB(nuclear factor-κB,NF-κB)在TCR中的激活,对T细胞的活化至关重要。SUN等[9]发现,敲除PKC-θ基因小鼠的T细胞在NF-κB活化中表现出功能上的严重缺陷,证实了PKC-θ在NF-κB活化中的选择性作用。KANG等[10]对比分析人源野生型PKC-θ和失活PKC-θ的质谱结果后发现,PKC-θ诱导了PDK-1在Ser-64处的磷酸化,进而促进T细胞活化和TCR诱导的NF-κB激活。
研究发现,含半胱氨酸的天冬氨酸蛋白水解酶-9(cysteinyl aspartate specific proteinase,caspase-9)以caspase-3依赖性方式诱导PKC-θ活化和NF-κB活化。此外,在T细胞活化过程中,caspase-8位于caspase-9的上游。因此,TCR会引发一个涉及caspase-8、caspase-9和caspase-3的caspase级 联 反应,从而启动PKC-θ依赖性途径导致NF-κB活化和PKC-θ依 赖性Bcl10(B-cell lymphoma/leukemia 10)磷酸化,进而改变NF-κB活性[11]。SIEGMUND等[12]通过酵母双杂交筛选和免疫共沉淀实验证实,冠蛋白1A(coronin 1A,coro1A)作为一种新型的PKC-θ相互作用蛋白,其N端WD40结构域和PKC-θ的类C2结构域相互作用,以此调节对PKC-θ的募集,并激活TCR下游的NF-κB。
激活蛋白1(activating protein-1,AP-1)是存在于细胞内的一种转录激活因子,是由c-Fos和c-Jun组成的异二聚体。研究发现,PKC-θ是T细胞中激活AP-1信号通路的重要分子。BAIER等[13]发现,有活性的PKC-θ能激活T细胞中AP-1活性,而在缺乏PKC-θ的原代T细胞中,AP-1表达与活性均受到抑制[8]。LI等[14]的研究表明,PKC-θ通过与Ste20相关的脯氨酸/丙氨酸激酶(Ste20-related proline/alaninerich kinase,SPAK)通路调节AP-1的激活,SPAK是PKC-θ的一种特异性底物,PKC-θ在体外通过磷酸化S311这个主要位点与SPAK直接相互作用。当过表达突变型SPAK或敲除SPAK时,PKC-θ介导的AP-1激活减少。
活化T细胞核因子(nuclear factor of activated T cells,NFAT)受Ca2+/钙调神经磷酸酶(calcineurin,Cn)依赖的信号通路调节,对T细胞的活化、增殖和分化至关重要[15-16]。研究表明,PKC-θ通过刺激Ca2+内流增强NFAT激活[17-19]。燃煤的砷可以引起人群的T细胞免疫抑制,研究表明,PKC-θ介导的Ca2+/NFAT信号通路可能参与了燃煤砷中毒人群的T细胞免疫抑制[20]。有关PKC-θ对转录因子的调控作用如图2所示。
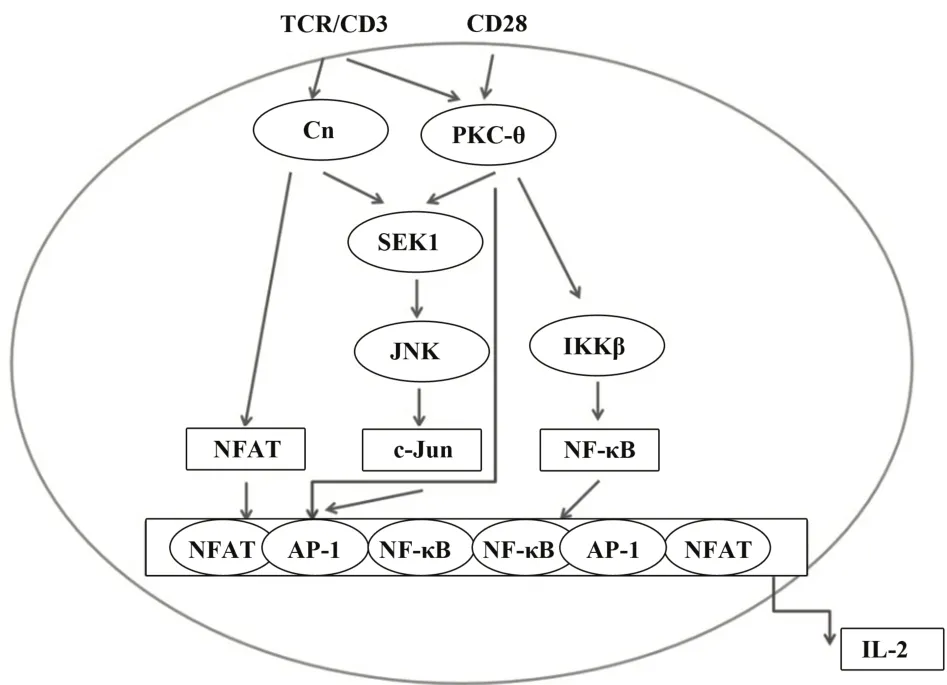
图2 PKC-θ对转录因子的调控[21]Fig.2 Regulation of transcription factors by PKC-θ[21]
2.2PKC-θ对Th细胞分化方向的调控作用辅助型T细胞(T helper cell,Th)漂移是一种免疫抑制现象,在TCR介导下,活化的CD4+T细胞分化为辅助型T细胞1(T helper 1 cell,Th1)和Th2两个不同的亚群。MAO等[21]发现,吗啡可以通过PI3K/AKT途径抑制Th1淋巴细胞的分化并降低Th1/Th2,韩超等[22]进一步发现,当吗啡浓度在50 ng/ml时,诱导CD4+T细胞向Th2漂移的分化效能最高,在此过程中,PKC-θ磷酸化水平增高,证实了PKC-θ在吗啡诱导Th2细胞漂移信号通路中所起的关键作用。
3 PKC-θ在淋巴细胞中的作用
3.1PKC-θ在T细胞中的作用PKC-θ是介导T细胞在体内和体外活化所需的关键分子,可参与调节T细胞免疫反应过程中的多个阶段。T细胞的活化是由TCR和共刺激分子启动的众多信号通路控制[23]。免疫突触(immunological synapse,IS)是T细胞与APC表面黏附分子在受体-配体作用下形成的特殊接触面。在PKC家族中,PKC-θ只有通过T细胞活化时被招募才聚集到免疫突触上,作用后传递T细胞活化的信号[24]。在T细胞和APC相互作用期间,利用数字三维成像分析确定了IS 3个不同的子区域:中央超分子活化簇(central supramolecular activation cluster,cSMAC)、外周SMAC(peripheral supramolecular activation cluster,pSMAC)、远端SMAC(distal supramolecular activation cluster,dSMAC)。WANG等[25]发现来自TCR/CD28刺激的最初信号传导诱导DAG在质膜上积累,DAG通过与C1结构域结合将PKC-θ募集至IS。但DAG-C1结构域相互作用本身似乎不足以将PKC-θ选择性转运至cSMAC,选择性PKC-θ募集到cSMAC还需要其他协同效应参与[1]。
另有研究表明,SUMO化修饰(smallubiquitinlike modifier)影响PKC-θ凝聚到免疫突触的cSMAC上,推测SUMO化修饰对成熟免疫突触的形成起到关键作用[26]。对原代小鼠和人类T细胞的分析表明,PKC-θ的磺酰化对于T细胞的激活至关重要。脱磺酰化作用不影响PKC-θ的催化活性,但是抑制了CD28与PKC-θ和纤维蛋白A的缔合,并损害了成熟的免疫突触的组装以及PKC-θ和CD28的中央共积累。因此,PKC-θ的SUMO化对于形成成熟的IS和T细胞活化至关重要[27]。
激活诱导的T细胞死亡(activation-induced Tcell death,AICD)是限制激活抗原特异性T细胞扩增和确保清除特异性病原体后免疫反应终止的重要过程,包括TCR诱导Fas配体(fas ligand,Fasl)的表达及其与相应受体Fas的结合,最终导致T细胞凋亡[27]。研究表明,PKC-θ在T细胞凋亡中起着双重调节作用:一方面通过诱导Fasl表达来促进细胞凋亡,另一方面通过提供一个BAD/p90Rsk依赖的生存信号来起到对细胞的保护作用[28]。
3.2PKC-θ在B细胞中的作用尽管T细胞受体诱导的NF-κB活化关键取决于PKC-θ,但尚未阐明nPKC在B细胞刺激中的作用。已有研究发现,在原代小鼠脾脏B细胞中PKC-θ的表达很弱。KRAPPMANN等[29]的测定数据表明,PKC-θ在原代B细胞NF-κB信号传导中起着关键作用。对原代B细胞和T细胞中PKC同工酶表达的分析表明,PKC-θ水平在T细胞中最高。尽管如此,在原代B细胞中也确实观察到了PKC-θ表达较弱。
BCR参与启动细胞内钙的动员,对于激活包括NF-κB和NFAT在内的多种转录因子至关重要。ANTONY等[30]的研究表明,BCR采用独特的依赖性分子机制来调节NF-κB与NFAT的激活。
YAN等[31]研究发现,PKC-θ-/-T细胞介导的和B细胞辅助的同种异体移植排斥依赖于CD28分子。B细胞辅助PKC-θ-/-T细胞通过Ⅱ类MHC分子引发急性同种异体移植排斥反应,PKC-θ在T细胞和B细胞中的双重控制可为防止同种异体移植排斥提供新的治疗方向。
4 PKC-θ与免疫相关疾病的关系
从免疫疾病的角度来看,PKC-θ表达的微调及其在免疫突触中的定位与免疫缺陷病和自身免疫病等关系密切,PKC-θ已成为人们研究疾病治疗的潜在靶点,其活性强弱与疾病发生发展程度也逐渐明晰。
4.1PKC-θ与免疫缺陷病的关系脓毒症,即由感染可引发全身性炎症反应综合征,进一步发展会导致脓毒性休克以及多器官功能不全综合征。庄 明 峰 等[32]发 现,可 通 过 调 控 血 小 板PKC-θ/Muncl8a信号途径进一步降低血小板α颗粒的释放,减轻脓毒症的损伤。Muncl8a是PKC-θ关键的下游信号分子,活化后的PKC-θ可磷酸化Muncl8a的S313来增强其活性,以促进血小板颗粒的释放[33-34]。
慢性肌肉发炎,是杜氏肌营养不良症的关键特征。研究表明,营养不良坏死前的早期阶段是基于T细胞干预的相关时限;PKC-θ作为效应T细胞活化的关键调节因子,是抑制营养不良性肌肉中T细胞活性的潜在靶标;缺乏PKC-θ时,浸润性T细胞的频率和数量下降,肌肉中先天免疫细胞浸润的数量和质量也随之变化[35]。在疾病过程的早期用PKC-θ抑制剂可明显减少炎症细胞浸润的大小,并减少肌肉的损伤。
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是胃肠道最常见的间叶性肿瘤,占胃肠道肿瘤的1%~4%[36]。研究表明,PKC-θ可作为胃肠间质瘤的诊断指标之一[37]。PKC-θ过表达与肿瘤高度恶性、复发/转移频率高、患者生存率低等临床病理参数密切相关,通过研究PKC-θ介导基因过表达,可为胃癌治疗提供理论依据[38]。
化疗诱导淋巴样细胞凋亡的早期,血影蛋白发生聚集,而在聚集体的形成中则涉及到PKC-θ或其他凋亡相关蛋白。MICHALCZYK等[39]通过测试在肿瘤坏死因子相关的凋亡诱导配体(TRAIL)诱导的凋亡过程中PKC-θ和Fas相关的死亡域蛋白(FADD)对细胞中血影蛋白聚集的影响,发现了PKC-θ负调控TRAIL诱导和FADD介导的细胞凋亡蛋白聚集过程。
PHETSOUPHANH等[40]发现了PKC-θ在CD4+T细胞和HIV感染中的作用:到达细胞核并再次返回。因此,PKC-θ可能帮助增强HIV-1复制,而HIV-1诱导了受感染CD4+T细胞中PKC-θ的更高活化,从而形成了一个正向反馈环。使用抑制剂rottlerin抑制PKC-θ的活性,发现HIV-1的复制在CD4+T细胞中减少。因此,对PKC-θ的活性进行特异性抑制,可能会有助于控制HIV-1的复制[41]。
4.2PKC-θ与自身免疫病的关系自身免疫性肝炎是由于免疫细胞错误地攻击自己的肝细胞从而导致严重的肝损伤。在小鼠中,伴刀豆球蛋白A处理可诱发急性肝炎,导致CD1d阳性自然杀伤(CD1d-positive natural killer,NK)T细胞迅速激活。这些被激活的NKT细胞会产生大量的细胞因子,如IFN-γ、IL-6和TNF-α,介导炎症反应导致肝损伤。此类细胞因子在PKC-θ-/-小鼠中显著降低。PKC-θ-/-小鼠外周NKT细胞在胸腺发育早期存在发育缺陷,其频率和数量明显减少。由于PKC-θ是激活NKT细胞诱发肝炎所必需的基本分子,因此PKC-θ是预防自身免疫性肝炎的潜在药物靶点[42]。
在炎症性自身免疫性疾病中,PKC-θ消融对T细胞功能的体内影响尚未得到彻底检查。TAN等[43]使用PKC-θ缺陷小鼠来研究PKC-θ在实验性自身免疫性脑脊髓炎(一种由T细胞介导的中枢神经系统自身免疫性疾病模型)发展中的潜在参与。免疫的PKC-θ-/-小鼠的脾T淋巴细胞的离体刺激显示,尽管IL-2水平相当,但Th1细胞因子IFN-γ以及T细胞效应细胞因子IL-17的产量显著降低。此外,在疾病过程中,与野生型小鼠相比,PKC-θ-/-小鼠中枢神经系统的IL-17表达显著降低。以上结果强调了PKC-θ在调节自身免疫性疾病的发展中所必需的多种T细胞功能的重要性。
在干燥综合征中,健康对照组小鼠的腺泡上皮细胞含有两种传统的PKC亚型α和β,腺泡和导管上皮细胞也含有非典型的PKC同工型λ,找不到PKC亚型γ、δ、ε和θ。炎症小鼠含有相同的常规和非典型PKC亚型。结果表明,常规和非典型的PKC同工型都参与唾液上皮细胞生物学变化,并且表达中存在与小鼠品系相关和疾病状态相关的变化,且在干燥症群体中未发现干燥综合征中缺乏的α和β亚型[44]。
T细胞受体(TCR)依赖性调节性T细胞(Treg)活性控制效应T细胞(Teff)的功能,并被炎症细胞因子TNF-α抑制。完全的Teff激活需要PKC-θ募集到IS。此外,PKC-θ阻断增强了Treg功能,表明PKC-θ抑制了Treg介导的抑制作用。抑制PKC-θ可保护Treg免受TNF-α的灭活,恢复类风湿关节炎患者缺陷Treg的活性,并增强小鼠免受炎症结肠炎的保护[45]。
在TCR信号传导过程中,TCR信号通过诱导GLK与上游适配器的直接相互作用激活了GLK。GLK缺陷的小鼠免疫反应受损,对实验性自身免疫性脑脊髓炎有抵抗力。与此相一致的是,系统性红斑狼疮患者的T细胞中GLK表达明显增强,PKC-θ活化GLK在T细胞中的过表达发生频率与疾病的严重程度直接相关[46]。
5 PKC-θ与免疫抑制剂
PKC-θ控制T细 胞 的基本过 程 整合了TCR和CD28信号,激活NF-κB、AP-1和NFAT等转录因子,这对T细胞的激活和分化至关重要。PKC-θ在体内调节T细胞介导的免疫反应,因此选择性PKC-θ抑制剂被认为在治疗自身免疫和预防同种异体移植排斥方面具有潜在的临床应用[47]。
免疫抑制剂是一类具有抑制机体免疫功能的生物制剂,可应用于控制器官移植排斥反应和治疗自身免疫性疾病方面。目前PKC-θ抑制剂主要来源于人工合成和天然产物。人工合成的PKC-θ抑制剂有很多种,如AS2521780(5-腈基嘧啶类化合物)、2,4-二氨基-5-氟嘧啶衍生物、二氢喹唑啉类化合物、三环吡唑并吡啶类化合物等[48-51]。最新发现的2,6-二氨基-3-氨基甲酰基-5-氰基吡嗪衍生物2表现出中等的PKC-θ抑制活性。优化确定的2,4-二氨基-5-氰基嘧啶衍生物16c表现出有效的PKC-θ抑制活性,并且对其他PKC同工酶表现出良好的选择性。在体内大鼠异位心脏移植模型中,其衍生物16c延长了移植物的存活[52]。此类抑制剂大多具有较好的选择性,抑制PKC-θ激酶活性比其他PKC亚型高出几十倍到几百倍,在安全性、溶解性、渗透性、稳定性、有效性上占据不同优势,在提高移植心脏存活率、结肠炎治疗、抵抗移植物抗宿主反应等方面体现出良好的应用前景。天然产物来源的PKC-θ抑制剂也有很多种,如4-羟基-3-甲氧基肉桂醛、单紫杉烯、C21甾体化合物等[53-55]。此类抑制剂主要抑制PKC磷酸化以及下游NFAT、NF-κB和丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)通路的激活,对T细胞介导的免疫反应有较好的抑制作用。
6 总结与展望
综上所述,PKC-θ可在TCR等信号通路中发挥作用,与免疫疾病关系密切。因此,研制与PKC-θ相关的免疫抑制剂来控制器官移植排斥反应和治疗自身免疫病,已成为当前治疗免疫疾病的主要控制方法和有效手段。PKC-θ在TCR通路及淋巴细胞中的作用机制仍有很多疑问,尚需深入研究PKC-θ的调控机制,探明PKC-θ在不同免疫疾病中的作用。这对于研究免疫疾病的防治,具有重要和深远的意义。参考文献:
[1]BREZAR V,TU W J,SEDDIKI N.PKC-theta in regulatory and effector T-cell functions[J].Front Immunol,2015,6:530.DOI:10.3389/fimmu.2015.00530.
[2]CHAND S,MEHTA N,BAHIA M S,et al.Protein kinase C-theta inhibitors:a novel therapy for inflammatory disorders[J].Curr Pharm Des,2012,18(30):4725-4746.DOI:10.2174/138161212802651625.
[3]BAIER G,TELFORD D,GIAMPA L,et al.Molecular cloning and characterization of PKC theta,a novel member of the protein kinase C(PKC)gene family expressed predominantly in hematopoietic cells[J].J Biol Chem,1993,268:4997-5004.DOI:10.1016/S0021-9258(18)53494-3.
[4]MELLER N,ALTMAN A,ISAKOV N.New perspectives on PKCtheta,a member of the novel subfamily of protein kinase C[J].Stem Cells,1998,16(3):178-192.DOI:10.1002/stem.160178.
[5]ARENDT C W,ALBRECHT B,SOOS T J,et al.Protein kinase C-theta:signaling from the center of the T-cell synapse[J].Curr Opin Immunol,2002,14:323-330.DOI:10.10 16/s0952-7915(02)00346-1.
[6]CZIKORA A,PANY S,YOU Y,et al.Structural determinants of phorbol ester binding activity of the C1a and C1b domains of protein kinase C theta[J].Biochim Biophys Acta Biomembr,2018,1860(5):1046-1056.DOI:10.1016/j.bbamem.2018.01.007.
[7]ISAKOV N,ALTMAN A.PKC-theta-mediated signal delivery from the TCR/CD28 surface receptors[J].Front Immunol,2012,3:273.DOI:10.3389/fimmu.2012.00273.
[8]XIE J,HAN X,ZHAO C,et al.Phosphotyrosine-dependent interaction between the kinases PKCθ and Zap70 promotes proximal TCR signaling[J].Sci Signal,2019,12(577):eaar3349.DOI:10.1126/scisignal.aar3349.
[9]SUN Z,ARENDT C W,ELLMEIER W,et al.PKC-theta is required for TCR-induced NF-kappaB activation in mature but not immature T lymphocytes[J].Nature,2000,404(6776):402-407.DOI:10.1038/35006090.
[10]KANG J A,CHOI H,YANG T,et al.PKCθ-mediated PDK1phosphorylation enhances T Cell activation by increasing PDK1 stability[J].Mol Cells,2017,40(1):37-44.DOI:10.14348/molcells.2017.2236.
[11]ZHAO Y,LEI M,WANG Z,et al.TCR-induced,PKC-θ-mediated NF-κB activation is regulated by a caspase-8-caspase-9-caspase-3 cascade[J].Biochem Biophys Res Commun,2014,450(1):526-531.DOI:10.1016/j.bbrc.2014.06.010.
[12]SIEGMUND K,THUILLE N,POSCH N,et al.Novel protein kinase C θ:coronin 1A complex in T lymphocytes[J].Cell Commun Signal,2015,13:22.DOI:10.1186/s12 964-015-0100-3.
[13]BAIER-BITTERLICH G,UBERALL F,BAUER B,et al.Protein kinase C-theta isoenzyme selective stimulation of the transcription factor complex AP-1 in T lymphocytes[J].Mol Cell Biol,1996,16(4):1842-1850.DOI:10.1128/mcb.16.4.1842.
[14]LI Y,HU J,VITA R,SUN B,et al.SPAK kinase is a substrate and target of PKCθ in T-cell receptor-induced AP-1 activation pathway[J].EMBO J,2004,23:1112-1122.DOI:10.1038/sj.emboj.7600125.
[15]CRABTREE G R.Generic signals and specific outcomes:signaling through Ca2+,calcineurin,and NF-AT[J].Cell,1999,96:611-614.DOI:10.1016/s0092-8674(00)80571-1.
[16]RAO A,LUO C,HOGAN P G.Transcription factors of the NFAT family:regulation and function[J].Annu Rev Immunol,1997,15:707-747.DOI:10.1146/annurev.immunol.15.1.707.
[17]JONES R G,PARSONS M,BONNARD M,et al.Protein kinase B regulates T lymphocyte survival,nuclear factor κB activation,and Bcl-XL levels in vivo[J].J Exp Med,2000,191:1721-1734.DOI:10.1084/jem.191.10.1721.
[18]ALTMAN A,KAMINSKI S,BUSUTTIL V,et al.Positive feedback regulation of PLCγ1/Ca2+signaling by PKCθ in restimulated T cells via a Tec kinase-dependent pathway[J].Eur J Immunol,2004,34:2001-2011.DOI:10.1002/eji.200324625.
[19]MANICASSAMY S,SADIM M,YE R D,et al.Differential roles of PKC-θ in the regulation of intracellular calcium concentration in primary T cells[J].J Mol Biol,2006,355:347-359.DOI:10.1016/j.jmb.2005.10.043.
[20]ZENG Q,LUO P,GU J,et al.PKC θ-mediated Ca2+/NF-AT signalling pathway may be involved in T-cell immunosuppression in coal-burning arsenic-poisoned population[J].Environ Toxicol Pharmacol,2017,55:44-50.DOI:10.1016/j.etap.2017.08.005.
[21]MAO M,QIAN Y,SUN J.Morphine Suppresses T helper lymphocyte differentiation to Th1 type through PI3K/AKT pathway[J].Inflammation,2016,39(2):813-821.DOI:10.1007/s10753-016-0310-x.
[22]韩超.吗啡通过PKC-θ-GATA3信号通路促进Th2细胞漂移的机制研究[D].南京:南京医科大学,2019.
[23]WEISS A,LITTMAN D R.Signal transduction by lymphocyte antigen receptors[J].Cell,1994,76:263-274.DOI:10.1016/0092-8674(94)90334-4.
[24]龚宇.PKCθ的SUMO化修饰及其在TCR信号通路中的作用[D].广州:中山大学,2010.
[25]WANG X,CHUANG H C,LI J P,et al.Regulation of PKC-θ function by phosphorylati on in T cell receptor signaling[J].Front Immunol,2012,3:197.DOI:10.3389/fimmu.2012.00197.
[26]DUSTIN M L,COLMAN D R.Neural and immunological synaptic relations[J].Science,2002,298(5594):785-789.DOI:10.1126/science.1076386.
[27]WANG X D,GONG Y,CHEN Z L,et al.TCR-induced sumoylation of the kinase PKC-θ controls T cell synapse organization and T cell activation[J].Nat Immunol,2015,16(11):1195-1203.DOI:10.1038/ni.3259.
[28]CAPLAN S,BANIYASH M.Searching for significance in TCRcytoskeleton interactions[J].Immunol Today,2000,21(5):223-228.DOI:10.1016/s016 7-5699(00)0 1604-2.
[29]KRAPPMANN D,PATKE A,HEISSMEYER V,et al.B-cell receptor-and phorbol ester-induced NF-kappaB and c-Jun N-terminal kinase activation in B cells requires novel protein kinase C's[J].Mol Cell Biol,2001,21(19):6640-6650.DOI:10.1128/mcb.21.19.6640-6650.2001.
[30]ANTONY P,PETRO J B,CARLESSO G,et al.B cell receptor directs the activation of NFAT and NF-kappaB via distinct molecular mechanisms[J].Exp Cell Res,2003,291(1):11-24.DOI:10.1016/s0014-4827(03)00338-0.
[31]YAN W,XU R,MA L L,et al.B cells assist allograft rejection in the deficiency of protein kinase c-theta[J].Transpl Int,2013,26(9):919-927.DOI:10.1111/tri.12143.
[32]庄明峰,徐晓涵,刘大东.CORM-2通过PKCθ/Muncl8a信号途径抑制脓毒症血小板OL颗粒的释放[J].江苏大学学报(医学版),2016,26(1):35-39,44.DOI:10.13312/j.issn.1671-7783.y150243.
[33]BURKHARDT P,HATTENDOFF D A,WEIS W I,et a1.Muncl8a controls SNARE assembly through its interaction with the syntaxin N-peptid[J].EMBO J,2008,27(7):923-933.DOI:10.1038/emboj.2008.37.
[34]CHU Y X,FIORAVANTE D,LEITGES M,et al.Calcium-dependent PKC isoforms have specialized roles in shortterm synaptie plasticity[J].Neuron,2014,82(4):859-871.DOI:10.1016/j.neuron.2014.04.003.
[35]LOZANOSKA-OCHSER B,BENEDETTI A,RIZZO G,et al.Targeting early PKCθ-dependent T-cell infiltration of dystrophic muscle reduces disease severity in a mouse model of muscular dystrophy[J].J Pathol,2018,244(3):323-333.DOI:10.1002/path.5016.
[36]GRAADT VAN ROGGEN J F,VAN VELTHUYSEN M L,HOGENDOORN P C.The histopathological differential diagnosis of gastrointestinal stromal tumours[J].J Clin Pathol,2001,54(2):96-102.DOI:10.1136/jcp.54.2.96.
[37]张宁宁.PKC-θ对胃肠间质瘤的诊断意义[D].沈阳:中国医科大学,2012.
[38]KIM W K,YUN S,PARK C K,et al.Sustained mutant KIT activation in the golgi complex is mediated by PKC-θ in gastrointestinal stromal tumors[J].Clin Cancer Res,2017,23(3):845-856.DOI:10.1158/1078-0432.CCR-16-0521.
[39]MICHALCZYK I,TOPORKIEWICZ M,DUBIELECKA P M,et al.PKC-θ is a negative regulator of TRAIL-induced and FADD-mediated apoptotic spectrin aggregation[J].Folia Histochem Cytobiol,2016,54(1):1-13.DOI:10.5603/FHC.a2016.0006.
[40]PHETSOUPHANH C,KELLEHER A D.The role of PKC-θ in CD4+T cells and HIV infection:to the nucleus and back again[J].Front Immunol,2015,6:391.DOI:10.3389/fimmu.2015.00391.
[41]BERMEJO M,LÓPEZ-HUERTAS M R,HEDGPETH J,et al.Analysis of protein kinase C theta inhibitors for the control of HIV-1 replication in human CD4+T cells reveals an effect on retrotranscription in addition to viral transcription[J].Biochem Pharmacol,2015,94(4):241-256.DOI:10.1016/j.bcp.2015.02.009.
[42]FANG X,WANG R,MA J,et al.Ameliorated ConA-induced hepatitis in the absence of PKC-theta[J].PLoS One,2012,7(2):e31174.DOI:10.1371/jour nal.po ne.0031174.
[43]TAN S L,ZHAO J,BI C,et al.Resistance to experimental autoimmune encephalomyelitis and impaired IL-17 production in protein kinase C theta-deficient mice[J].J Immunol,2006,176(5):2872-2879.DOI:10.4049/jimmunol.176.5.2872.
[44]TENSING E K,MA J,HUKKANEN M,et al.Protein kinase C expression in salivary gland acinar epithelial cells in non-obese diabetic mice,an experimental model for Sjögren's syndrome[J].Rheumatol Int,2005,25(1):28-32.DOI:10.1007/s 00296-0 03-0386-0.
[45]ZANIN-ZHOROV A,DING Y,KUMARI S,et al.Protein kinase C-theta mediates negative feedback on regulatory T cell function[J].Science,2010,328(5976):372-376.DOI:10.1126/science.1186068.
[46]CHUANG H C,LAN J L,CHEN D Y,et al.The kinase GLK controls autoimmunity and NF-κB signaling by activating the kinase PKC-θ in T cells[J].Nat Immunol,2011,12(11):1113-1118.DOI:10.1038/ni.2121.
[47]KWON M J,WANG R,MA J,et al.PKC-θ is a drug target for prevention of T cell-mediated autoimmunity and allograft rejection[J].Endocr Metab Immune Disord Drug Targets,2010,10(4):367-372.DOI:10.2174/1871530311006040367.
[48]FUKAHORI H,CHIDA N,MAEDA M,et al.Effect of AS2521780,a novel PKCθ selective inhibitor,on T cell-mediated immunity[J].Eur J Pharmacol,2014(745):217-222.DOI:10.1016/j.ejphar.2014.10.045.
[49]KUNIKAWA S,TANAKA A,MUKOYOSHI K,et al.Optimization of 2,4-diamino-5-fluoropyrimidine derivatives as protein kinase C theta inhibitors with mitigated time-dependent drugdrug interactions and P-gp liability[J].Bioorg Med Chem,2015,23(13):3269-3277.DOI:10.1016/j.bmc.2015.04.050.
[50]KATOH T,TAKAI T,YUKAWA T,et al.Discovery and optimization of 1,7-disubstituted-2,2-dimethyl-2,3-dihydro-quinazolin-4(1H)-ones as potent and selective PKCθ inhibitors[J].Bioorg Med Chem,2016,24(11):2466-2475.DOI:10.1016/j.bmc.2016.04.008.
[51]JIMENEZ J M,STUDLEY J.Tri-cyclic pyrazolopyridine kinase inhibitors:US patent,WO2010/011772 A2[P]:2010.
[52]KUNIKAWA S,TANAKA A,TAKASUNA Y,et al.A novel 2,4-diaminopyrimidine derivative as selective inhibitor of protein kinase C theta prevents allograft rejection in a rat heart transplant model[J].Bioorg Med Chem,2018,26(20):5499-5509.DOI:10.1016/j.bmc.2018.09.029.
[53]AKBER U,NA B R,KO Y S,et al.Phytocomponent 4-hydro xy-3-methoxycinnamal dehyde ablates T-cell activation by targeting protein kinase C-θ and its downstream pathways[J].Int Immunopharmacol,2015,25(1):130-140.DOI:10.1016/j.inti mp.20 15.01.020.
[54]NA B R,KIM H R,KWON M S,et al.Aplotaxene blocks T cell activation by modulation of protein kinase C-θ-dependent pathway[J].Food Chem Toxicol,2013,62:23-31.DOI:10.1016/j.fct.2013.08.016.
[55]CHEN F Y,ZHOU L F,LI X Y,et al.Stephanthraniline A suppressed CD4(+)T cell-mediated immunological hepatitis through impairing PKCθ function[J].Eur J Pharmacol,2016,789:370-384.DOI:10.1016/j.ejphar.2016.06.022.

