氨基改性Fe3O4纳米材料修饰电极同时测定Cd2+和Pb2+
黄宝美*, 钟 雪, 吴田甜, 罗 熙
(绵阳师范学院化学与化学工程学院,四川绵阳 621000)
水是生命之源,是人们所依赖的物质之一,人类的健康与水质也息息相关,水体中重金属含量超标会直接危害人体的健康。重金属Cd2+进入人身体后主要分布在人体骨骼、肝、胰腺,能引发多种慢性疾病的发生,重金属Pb2+对于发育中的儿童极易造成儿童发育迟缓,对智力也有影响,且Pb2+长期存在人体内会对其消化系统、免疫系统均有损害[1]。目前较为常用的检测重金属离子的检测方法有原子荧光光谱法[2]、原子吸收光谱法[3]、电感耦合等离子体质谱法[4]、荧光探针法[5]和电化学法[6]。电化学分析法近年来在分析研究领域中扮演着重要的角色,它作为现代仪器分析方法的重要分支之一,具有灵敏度高、选择性好、检测时间短和操作方法简便等优点[7]。磁性纳米粒子同时具备纳米材料的优点和磁性材料的优点。磁性Fe3O4纳米材料具有良好的磁性能,制备出的磁性Fe3O4可以在外加磁场的作用下与底液快速分离,且磁性Fe3O4回收简单,成本低。但磁性Fe3O4仍存在一些缺陷,它在酸性或碱性条件下易被腐蚀,导致磁性Fe3O4纳米材料的特性被破坏,当将氨基等基团修饰到在Fe3O4磁性纳米材料表面后,可以使其功能作用加强,功能化后的磁性纳米材料应用非常广泛[8,9]。
本文改变合成NH2-Fe3O4磁性纳米材料的反应条件,将所制备出的NH2-Fe3O4用于修饰GCE,选用DPV法同时测定Cd2+和Pb2+的含量。目前国内外还未见文献报道此类研究。
1 实验部分
1.1 仪器与试剂
FTIR-8400傅里叶红外变换(FT-IR)光谱仪(日本,岛津);SSA-4300孔径及比表面积分析仪(北京彼奥德电子技术有限公司);蔡司EVO-18扫描电镜(上海欧波同仪器有限公司);KH-100mL水热合成反应釜(上海耀特仪器设备有限公司);X Pert PRO X射线衍射仪(荷兰帕,纳科公司);CHI660E电化学工作站(上海辰华仪器有限公司)。
FeCl3·6H2O、Pb(NO3)2和(CH2OH)2(成都市科隆化学品有限公司),Cd(NO3)2(天津市科密欧化化学试剂有限公司),实验所用试剂均为分析纯,水为蒸馏水。
1.2 NH2-Fe3O4纳米颗粒的合成
准确称取4.50 g FeCl3·6H2O溶解在60.00 mL(CH2OH)2溶液中,室温下搅拌溶解,再加入3.00 g CH3COONa继续搅拌至黑色液体后加入1.80 g EDTA搅拌至黄褐色液体,反应物在超声清洗机中超声分散30 min后,转入水热合成反应釜中,在恒温干燥箱中(190 ℃)恒温反应9 h,待冷却后取出产品并用无水乙醇和蒸馏水洗涤,最后在真空烘干箱中(65 ℃)恒温3 h得到产品。
1.3 修饰电极的制备
准确称取0.010 g的NH2-Fe3O4磁性纳米颗粒溶于10.00 mL含有1%Nafion的无水乙醇中,超声分散3 h,得到10.0 mg·mL-1的NH2-Fe3O4纳米材料的修饰液。将配制的NH2-Fe3O4纳米材料修饰液超声分散3 h,用移液枪准确吸取6.00 μL分散液滴涂在打磨好的GCE上,在红外灯下干燥20 min,即得到NH2-Fe3O4修饰电极。
1.4 Cd2+和Pb2+的测定
采用差分脉冲伏安法(DPV)同时测定废水中Cd2+和Pb2+。选择0.2 mol·L-1HAc-NaAc缓冲溶液(pH=4)为测定Cd2+和Pb2+的支持电解质,富集电位为-1.2 V,富集时间为160 s,电势扫描范围为-1.2~0.0 V。
2 结果与讨论
2.1 纳米材料的表征
2.1.1 扫描电镜分析图1是NH2-Fe3O4磁性纳米材料的扫描电镜(SEM)图。从图1中可以看出,NH2-Fe3O4磁性纳米颗粒呈现球体形状,球体大小较均匀,且个体较为圆滑,粒径为200 nm。

图1 NH2-Fe3O4的扫描电镜(SEM)图Fig.1 SEM images of NH2-Fe3O4 (A) 10 000 times;(B) 20 000 times.
2.1.2 X射线衍射分析NH2-Fe3O4的X射线衍射(XRD)图谱如图2所示。由图2中20°~70°范围内出现了不同强度的晶体衍射峰,可知NH2-Fe3O4具有较好的结晶性。谱图中的特征峰与JCPDS标准谱图的衍射峰完全一致,说明氨基修饰后并没有改变Fe3O4的晶形,结论与文献[10,11]一致。
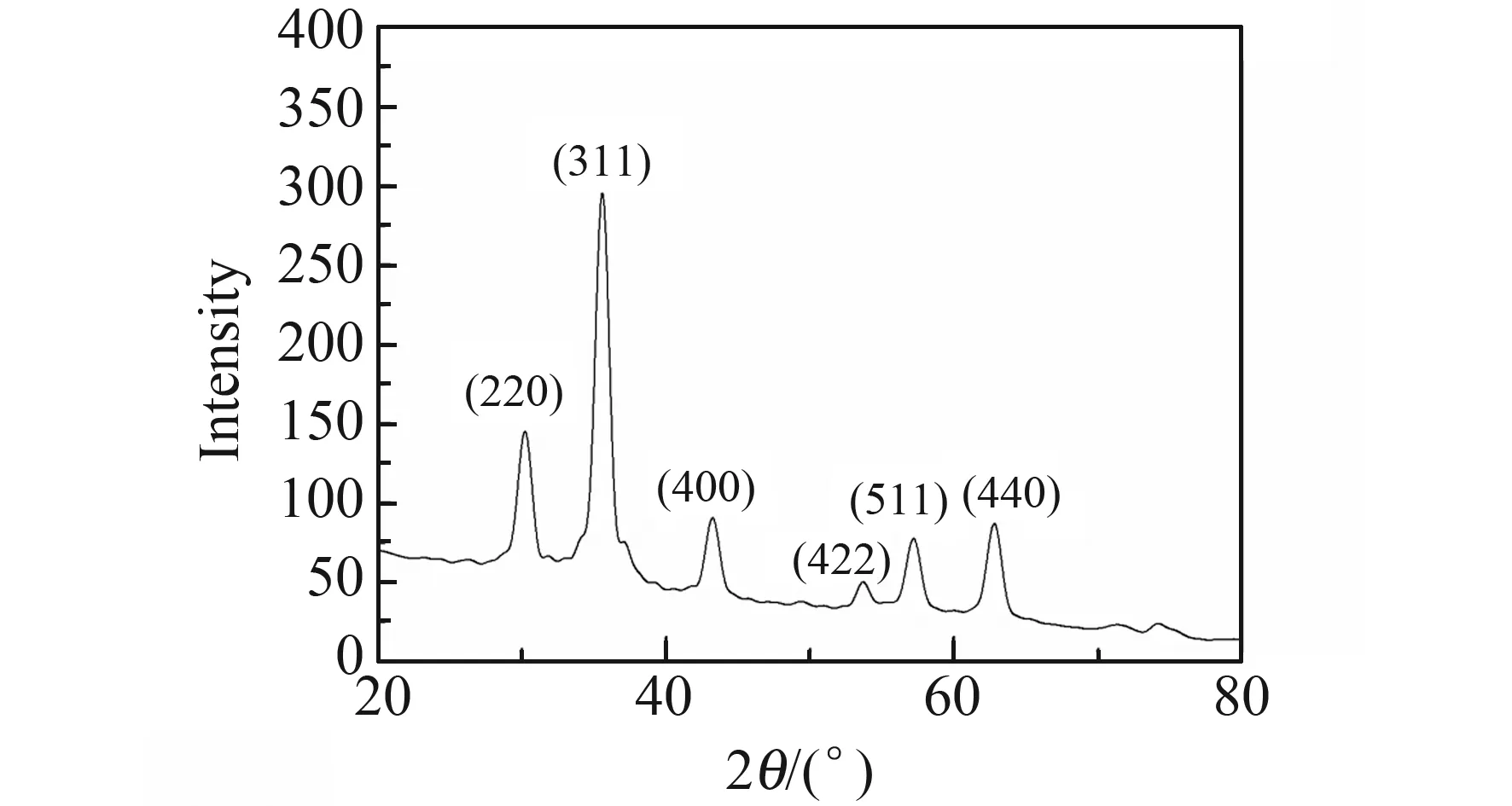
图2 NH2-Fe3O4的X射线衍射(XRD)谱图Fig.2 XRD pattern of NH2-Fe3O4
2.1.3 FT-IR分析图3为Fe3O4和NH2-Fe3O4纳米材料的红外谱图。可以看出,NH2-Fe3O4在1 642.51
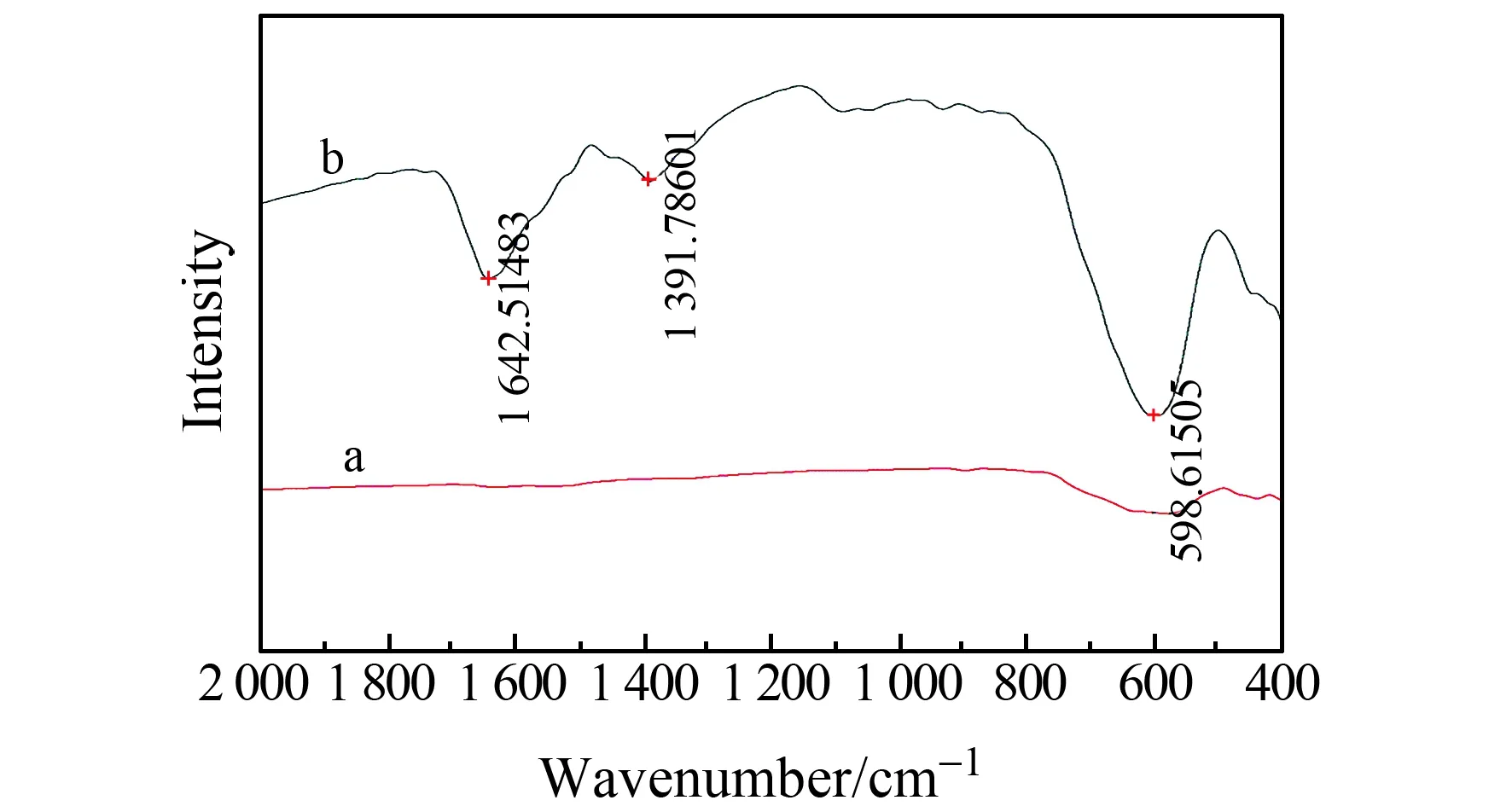
图3 Fe3O4(a)和NH2-Fe3O4(b)纳米粒子的傅立叶红外(FT-IR)光谱图Fig.3 FT-IR spectra of Fe3O4(a) and NH2-Fe3O4(b) nanoparticles
cm-1和1 391.78 cm-1处有明显的N-H键的伸缩振动吸收峰,Fe-O键的特征伸缩振动吸收峰在598.61 cm-1处。NH2-Fe3O4磁性纳米粒子与Fe3O4磁性纳米粒子相比,Fe-O吸收峰波数发生了微小偏移,由于氨基源1,6-己二胺与Fe3O4磁性纳米粒子表面发生反应形成Fe-O-N键,导致样品的Fe-O吸收峰发生蓝移。此结果与郭伟华[9,10]的结果一致,说明氨基已经修饰在Fe3O4磁性纳米颗粒的表面。
2.2 NH2-Fe3O4磁性纳米粒子修饰电极电化学行为
为进一步测试GCE活化前后导电性,测定不同电极在K3[Fe(CN)6]溶液中的阻抗图(图4)。由图可知,NH2-Fe3O4/GCE与GCE相比,NH2-Fe3O4/GCE的阻力增大,电子转移作用减弱。说明NH2-Fe3O4已经成功的修饰在GCE上。
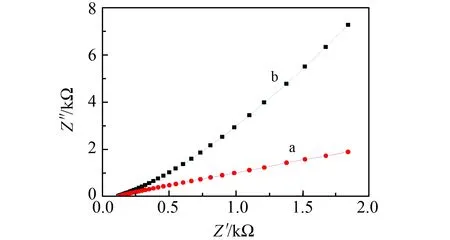
图4 不同电极在铁氰化钾溶液中的阻抗图Fig.4 Impedance diagram of different electrodes in potassium ferricyanide solution(a)GCE;(b)NH2-Fe3O4/GCE.
2.3 工作电极的选择
Cd2+和Pb2+在不同电极上的差分脉冲溶出曲线图见图5。曲线a是Cd2+和Pb2+在GCE上的电化学行为,曲线b是Cd2+和Pb2+在NH2-Fe3O4/GCE上的电化学行为,NH2-Fe3O4/GCE测得Cd2+和Pb2+的溶出峰电流明显比GCE所测得的Cd2+和Pb2+的溶出峰电流大,NH2-Fe3O4磁性纳米材料的修饰可增强检测的灵敏度,可能是因为氨基能够和Cd2+、Pb2+产生较强的络合作用,促进电极表面电子的传递。
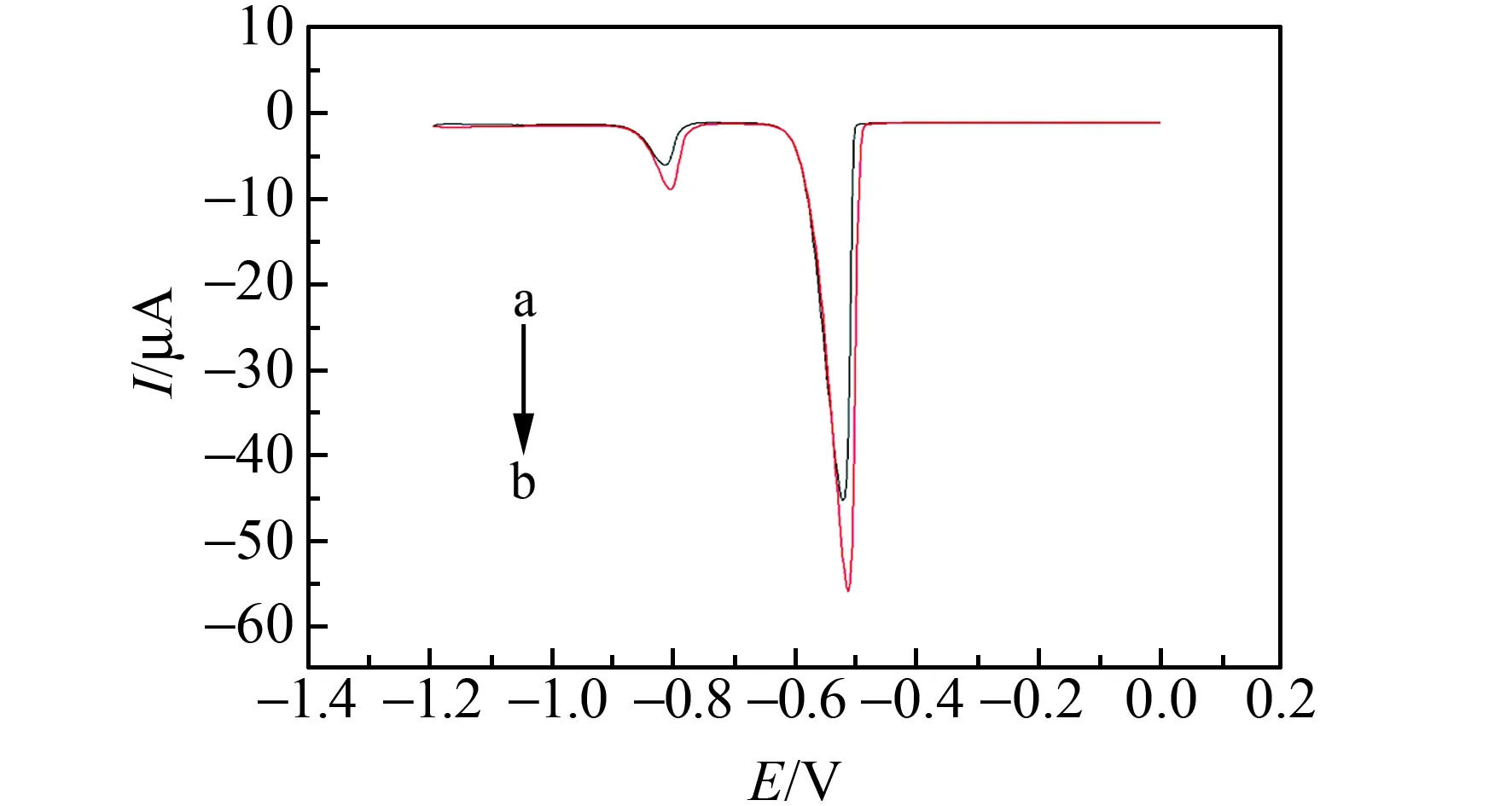
图5 不同电极的差分脉冲溶出伏安曲线图Fig.5 Differential pulse voltogrammograms of different electrode(a)GCE;(b)NH2-Fe3O4/GCE.
2.4 实验条件的优化
2.4.1 支持电解质的选择与pH优化为了选择最佳测定介质,分别考察了pH=4.0,浓度为7.2×10-6mol·L-1的HAc-NaAc和H3PO4-Na2HPO4缓冲溶液。结果表明,在HAc-NaAc缓冲溶液中Cd2+和Pb2+溶出峰的分离度较好,两峰之间相互干扰小,测量的灵敏度高。
研究了电解质pH与目标离子溶出峰电流的关系。当pH由3.8增加到4.0时,测得Cd2+和Pb2+的峰电流随着pH增加而增大;当pH大于4.0时,Pb2+峰电流随pH增大迅速下降,Cd2+的峰电流随pH增大而减小;当pH为4.0时,Cd2+和Pb2+溶出的峰电流最大。因此选择pH=4.0的HAc-NaAc缓冲溶液。
2.4.2 扫速的优化图6是设置不同扫速的循环伏安图,图6(A)是Pb2+扫速平方根(v0.5)的峰电流线性拟合图;图6(B)为Cd2+扫速平方根(v0.5)的峰电流线性拟合图。测量杯中Cd2+和Pb2+浓度均为7.2×10-6mol·L-1,溶液体积为10.00 mL,设置扫速为0.1~0.9(V·s-1),依次递增0.1(V·s-1),测试电位设置为-1.2 V~0.0 V。分析图6可知,随着扫速的增加达到相同电位所需时间越来越短,电极表面的扩散层稀薄,扩散流量增加,循环伏安曲线图中的氧化还原峰电流值逐渐增大,并且氧化电位逐渐正移,还原电位逐渐负移,电极表面扩散层随着扫速改变而改变。从图6可知,在扫描速度为0.1~0.9(V·s-1)时,Cd2+和Pb2+的扫速平方根(v0.5)与峰电流呈现良好的线性关系,线性方程分别为:ip=8.86+6.70v0.5(R=0.9760);ip=-3.61+46.60v0.5(R=0.9903)。以上结果不仅证明此过程受扩散控制,同时也证明NH2-Fe3O4纳米材料修饰的电极可以用于同时测定Cd2+和Pb2+。
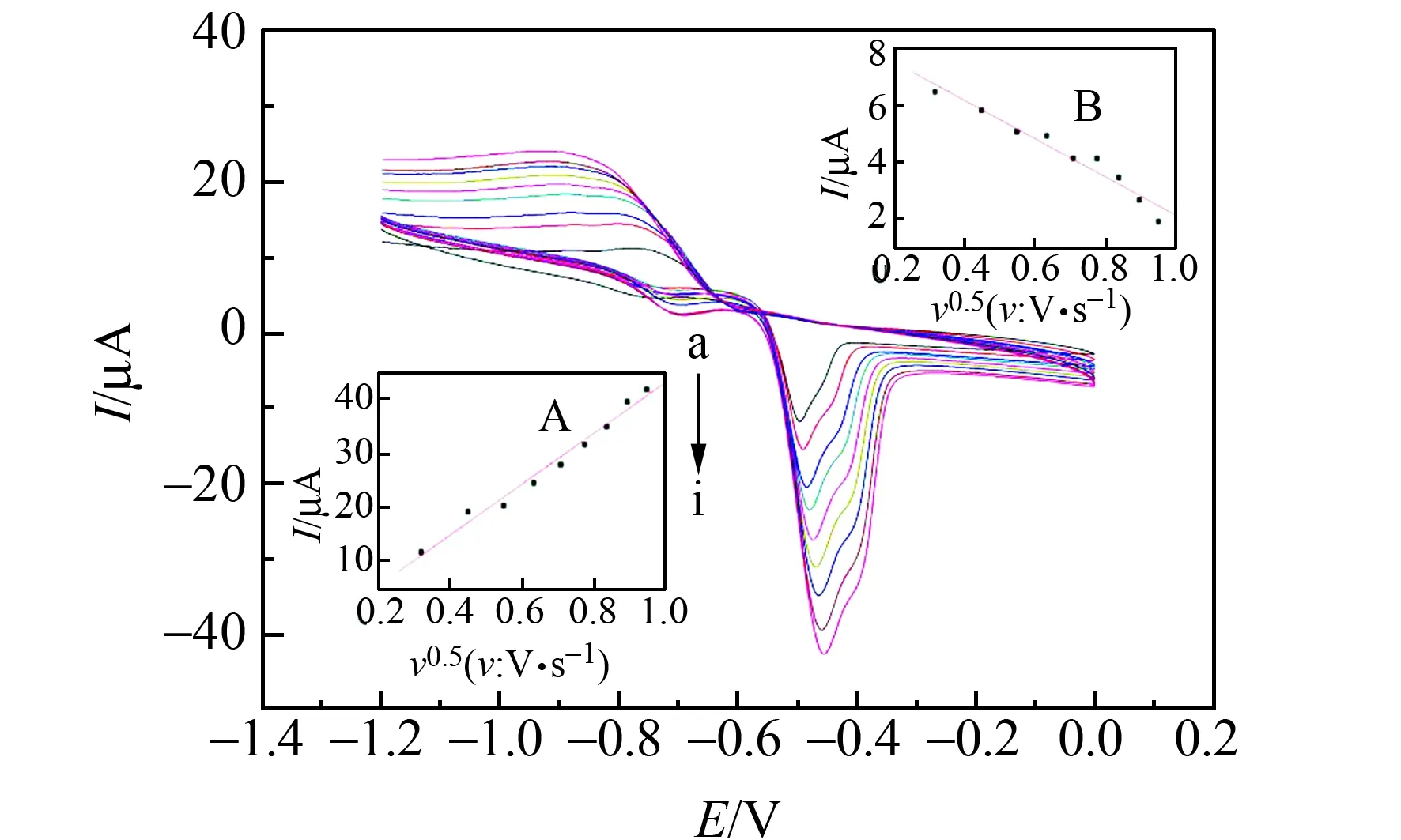
图6 不同扫速的循环伏安图与Pb2+(A)、Cd2+(B)不同扫速平方根与峰电流线性拟合图Fig.6 Cyclic voltammograms of different scan rates and Pb2+(A),Cd2+(B)linear fitting diagram of square root of different scan rates and peak currenta - i:0.1 - 0.9 V·s-1.
2.5 工作曲线的绘制
在最佳实验条件下,使用NH2-Fe3O4/GCE电化学传感器,利用差分脉冲溶出伏安法测定Cd2+和Pb2+。如图7所示,Cd2+和Pb2+溶出峰电流分别在0.81 V和0.52 V左右,Cd2+和Pb2+的溶出峰之间相互无干扰,偏移方向相同,峰形良好。测量结果也表明合成的NH2-Fe3O4磁性纳米材料修饰的电极同时测定Cd2+和Pb2+是可行的。图7(A)显示:Cd2+的溶出峰电流在浓度1.2×10-8mol·L-1~9.6×10-5mol·L-1呈良好的线性关系,线性方程:ip=0.0074+0.87c,R=0.9949,检测限为1.4×10-9mol·L-1。图7(B)显示:Pb2+的溶出峰电流在浓度4.8×10-8mol·L-1~9.6×10-5mol·L-1呈良好的线性关系,线性方程:ip=2.88+6.25c,R=0.9843,检测限为2.7×10-9mol·L-1。在硝酸盐的电化学检测中,运用不同物质修饰电极制作的电化学传感器很多,本实验使用的基于NH2-Fe3O4/GCE的硝酸盐电化学传感器与其他工作电极相比[12 - 15],线性范围增加,检出限降低。
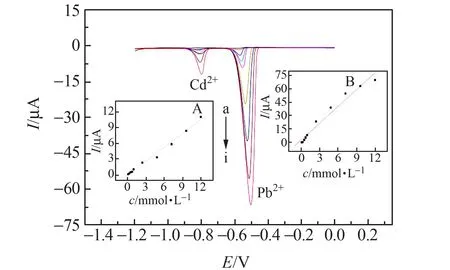
图7 Cd2+、Pb2+的差分脉冲溶出伏安曲线图与Cd2+(A)、Pb2+(B)的标准曲线图Fig.7 Differential pulse voltammagrams of Cd2+,Pb2+ and standard curve of Cd2+(A),Pb2+(B)a - i:7.2×10-8 - 1.2×10-5 mol·L-1.
2.6 修饰电极的抗干扰性能研究
2.7 修饰电极的重现性和稳定性
在上述最优条件下,对NH2-Fe3O4/GCE的重复性进行了评价。使用制备的NH2-Fe3O4/GCE,结合DPV法,对浓度为1.4×10-9mol·L-1Cd2+和2.7×10-9mol·L-1Pb2+的标准溶液连续进行测定。实验结果显示,5次Cd2+和Pb2+的相对标准偏差为分别为3.3%和4.5%,表明该传感器有较好的重现性。
用NH2-Fe3O4/GCE,对浓度为1.4×10-9mol·L-1Cd2+和2.7×10-9mol·L-1Pb2+的标准溶液进行测定,然后将其置于倒置烧杯中,放置2 d后,在相同条件下再次对Cd2+和Pb2+进行测定。结果显示,其灵敏度可达到初始条件的90.36%,表明NH2-Fe3O4/GCE具有较好的稳定性。
2.8 样品分析
为了测试NH2-Fe3O4/GCE的实用性,应用该电极检测3个水样中Cd2+和Pb2+的含量。水样分别取自绵阳师范学院游仙校区清水园、绵阳市涪江饮用水和绵阳师范学院游仙校区实验楼废水。加标回收实验结果如表1所示,实验结果表明NH2-Fe3O4/GCE检测实际检测水样的准确度较高。
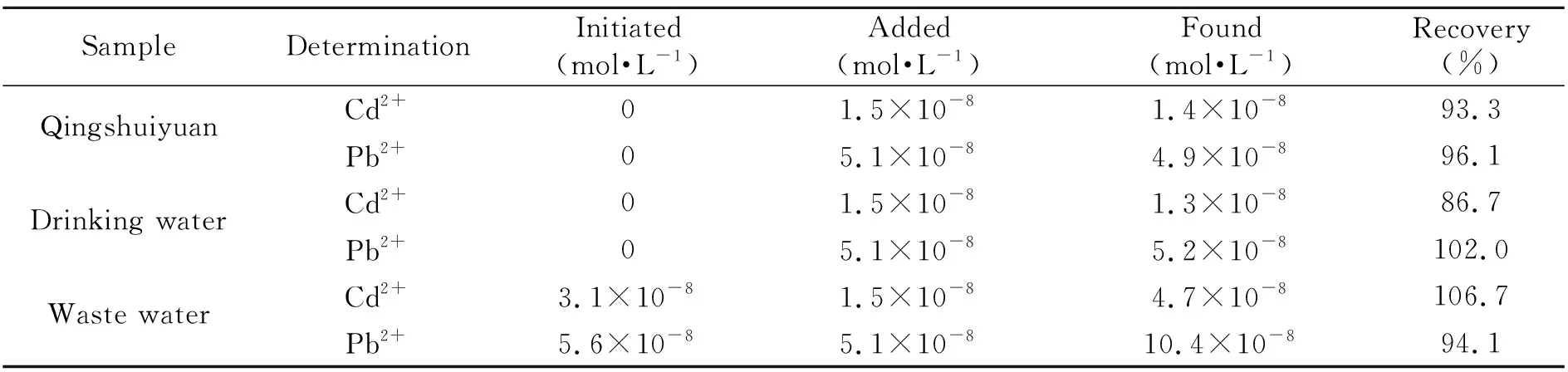
表1 实际检测水样中的Cd2+和Pb2+的结果
3 结论
NH2-Fe3O4磁性纳米材料制备简单,容易分离,成本低,利用氨基与Cd2+和Pb2+的强络合作用,用NH2-Fe3O4磁性纳米材料修饰电极同时测Cd2+和Pb2+,发现NH2-Fe3O4功能性更强,且将Cd2+和Pb2+沉积在修饰电极上,用差分脉冲法将其氧化下来,测出峰电流,检测方法简单,快捷,实用性高。

