脑内三磷酸腺苷的光电化学活体分析
刘爱平, 叶晓雪*, 刘志洪
(1.湖北大学化学化工学院/有机功能分子合成与应用教育部重点实验室,湖北武汉 430062;2.武汉大学化学与分子科学学院,湖北武汉 430072)
三磷酸腺苷(ATP)作为机体最直接的能量来源[1,2],参与细胞代谢和各种生化反应,在维持大脑功能过程中扮演重要角色。在正常生理状态下,脑内ATP的浓度受到严格的调节,而当ATP浓度偏离平衡时则会引发阿尔兹海默病、帕金森病等多种脑疾病。因此,发展脑内ATP的活体原位检测方法对于研究相关的生理和病理过程具有重要意义。基于微电极的电化学活体分析法在脑科学研究中已做出了重要贡献[3 - 5]。光电化学(PEC)传感技术被认为是电化学分析的一个新分支,其检测原理涉及光诱导电子转移过程。具体来说,当激发光照射电极表面的光电活性材料时,产生电子-空穴对,随后光生电子转移到电极或溶液中,从而产生阳极或阴极光电流信号[6,7]。由于这种激发信号(光信号)和检测信号(电信号)分离的特点,使光电化学传感具有背景信号低、灵敏度高等优点[8,9]。除此之外,光电化学传感可在0偏压下进行检测,减少了外加电压对神经元的刺激,具有更好的生物相容性。因此,光电化学传感是活体分析的潜在有力工具。然而,大多数光电活性材料需要高能量的光(紫外/可见光)激发,其组织穿透深度不足,限制了PEC传感技术在活体分析中的应用。因此,近期有研究者开发了一种可近红外激发的光电活性材料,用于PEC活体分析[10,11]。尽管如此,这些近红外激发的光电活性材料仍存在制备复杂、种类少以及光电转换效率不高等问题,这些因素都不利于PEC传感技术在活体分析中的进一步应用。
镧系掺杂的上转换纳米粒子(UCNPs)可通过反斯托克斯过程(anti-Stokes process)将低能量的入射光转化为高能量的发射光,即将近红外光转化为紫外光和可见光[12,13]。在荧光分析中,以UCNPs作为能量供体构建的荧光共振能量转移(FRET)体系,被广泛用于活体成像[14,15]。受此启发,我们课题组近期发展了一种基于FRET调控的光电化学传感策略,通过目标物与受体探针的化学识别反应来调节UCNPs的发光,实现了对非电活性小分子(SO2)的高选择性识别,并成功应用于脑内SO2的活体原位分析[16]。ATP是一种非氧化还原活性的生物小分子,难以通过在电极表面直接氧化还原产生光电流信号,因此需要在修饰电极表面引入一种ATP识别单元,将识别过程转化为可检测的PEC信号。核酸适配体具有稳定性好、选择性高、易于化学修饰等特点,将核酸适配体用于识别和检测ATP的研究已有报道[17-19],这些报道证明ATP适配体与ATP之间具有很高的亲和力,有利于复杂活体环境中对ATP的高选择性检测。但到目前为止,尚未见将ATP适配体与UCNPs结合用于脑内ATP光电化学活体分析的报道。
在本文中,我们将UCNPs与四甲基罗丹明(TAMRA)[20]标记的ATP适配体(cATP),组成荧光共振能量转移(FRET)体系,以碲化镉量子点(CdTe QDs)作为光电活性材料,共同修饰于微电极表面,构建可近红外激发的ATP光电化学微传感器。该PEC微传感器已成功应用于药物诱导的炎症小鼠模型中脑内ATP的活体原位检测。
1 实验部分
1.1 仪器及试剂
UV-2550型紫外/可见分光光度计(日本,岛津);RF-5301荧光分光光度计(日本,岛津);CHI660E电化学工作站(上海辰华仪器);ME104E/02型电子分析天平(梅特勒-托利多);MDL-Ⅲ-980型激光器(长春新产业光电技术)。利用三电极体系进行光电化学和电化学测量(工作电极:不锈钢微电极;参比电极:Ag/AgCl电极;对电极:铂丝电极),测量光源:980 nm激光器,信号输出装置:CHI 660E电化学工作站。电解质溶液:含200 μmol/L抗坏血酸(AA)的人工脑脊液(aCSF:126 mmol/L NaCl、2.4 mmol/L KCl、0.5 mmol/L KH2PO4、0.85 mmol/L MgCl2、27.5 mmol/L NaHCO3、0.5 mmol/L Na2SO4、1.1 mmol/L CaCl2)。
核苷酸购于生工生物工程(上海)股份有限公司,详细序列如下:cDNA:5′-NH2-(CH2)6-ACCTTCCTCCGCAATACTCCCCCAGGT-3′;cATP:5′-ACCTGGGGGAGTATTGCGGAGGAAGGT-TAMRA-3′。其他化学试剂(均为分析纯)购自阿拉丁试剂公司;实验用水为超纯水。
1.2 实验方法
1.2.1 CdTe QDs及NaYF4∶Yb,Er纳米颗粒的制备CdTe QDs的制备:在三口烧瓶中分别加入柠檬酸三钠(100 mg)、Cd(NO3)2(59 mg)和β-巯基丙酸(25 μL),溶解在25 mL超纯水中,用NaOH调节至pH为10.5,然后加入亚碲酸钠(11.1 mg)和硼氢化钠(18.9 mg),升温至100 ℃反应2 h,冷却至室温,离心,超声,取沉淀并洗涤。干燥后于4 ℃保存。
NaYF4∶Yb,Er上转换纳米颗粒的制备:称取Yb(NO3)3(0.6 mmol)、Y(NO3)3(2.34 mmol)和Er(NO3)3(0.09 mmol)加入乙醇和超纯水混合溶剂。将所得混合物在水浴锅上加热至50 ℃,然后逐滴加入NaF溶液,搅拌并继续加热20 min,将悬浮液转至高压反应釜中,在200 ℃下煅烧10 h。待冷却至室温后,底部白色沉淀即为UCNPs,超声洗涤沉淀,去除杂质,分散到超纯水中,备用。
羧基功能化NaYF4∶Yb,Er纳米颗粒的制备:在圆底烧瓶中加入聚丙烯酸(PAA:300 mg)和二甘醇(16 mL),通入N2保护以排除空气,加热至110 ℃。将上一步制备的UCNPs均匀分散在甲苯溶液中,然后加入圆底烧瓶的混合液中,升温直至150 ℃反应1.5 h,停止加热,冷却后加入0.1 mol/L HCl,离心洗涤,得到PAA-UCNPs。
1.2.2 基于UCNPs的荧光探针制备取2.5 mg PAA-UCNPs分散于超纯水中,再加入10 mg/mL 1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(EDC)和10 mg/mL N-羟基丁二酰亚胺(NHS),于37 ℃活化羧基,离心(8 000 r/min,5 min),洗涤。重新分散于HEPES缓冲溶液(4-羟乙基哌嗪乙磺酸,10 mmol/L,pH=7.4)中,加入cDNA溶液,4 ℃孵育过夜,然后在溶液中加入1%BSA,37 ℃孵育30 min,封闭未反应位点。加入含有cATP的杂交缓冲液(pH=7.4),利用碱基互补配对组装cATP,离心分离得到基于UCNPs的荧光探针。
1.2.3 纳米复合材料的制备取多壁碳纳米管(MWCNTs)分散于超纯水中,冰浴超声30 min,离心(8 000 r/min,5 min)以去除部分尺寸较大的碳纳米管,取上清液离心(12 000 r/min,10 min),将沉淀置于真空干燥箱中干燥得到尺寸较小的MWCNTs。称取CdTe QDs(2.5 mg)、MWCNTs(0.8 mg)分散在超纯水中,室温下于摇床混合一天,完成自组装,得到CdTe QDs-MWCNTs光电复合材料。
1.2.4 微传感器的构建将微电极置于40%HF中刻蚀,洗涤干净。真空干燥箱干燥,分步置于2.5 μL的含有CdTe QDs-MWCNTs光电复合材料和荧光探针的溶液中,室温干燥,再浸涂0.5%壳聚糖,用缓冲液洗涤电极后,干燥备用。
1.2.5 光电化学微传感器用于活体炎症模型中脑部ATP原位检测昆明小鼠(雌性,25 g左右)40只,分为两组:剂量组和时间组。剂量组研究脂多糖(LPS)诱导的炎症模型中,LPS浓度对小鼠脑内ATP释放的影响:小鼠腹腔分别注射不同浓度的LPS(0、3、5、7 mg/kg,200 μL),给药30 min后进行脑内ATP的活体原位检测,其中0 mg/kg指腹腔注射200 μL生理盐水。时间组研究炎症模型中小鼠脑内ATP水平随时间的变化情况:小鼠腹腔注射LPS(5 mg/kg,200 μL),并在不同时间点(2、4、6、8、12、24 h)用制备的微传感器原位检测小鼠脑内ATP的水平变化。
活体分析步骤:通过腹腔注射水合氯醛麻醉剂麻醉小鼠,将小鼠固定在脑立体定位仪上,剔除小鼠头部毛发,酒精消毒后,使用手术刀剪开小鼠头皮,暴露颅骨,确定小鼠大脑皮层的位置,使用微型手持式颅钻定位转孔,随后将工作电极缓缓插入指定脑区(AP=2.3 mm,ML=2.4 mm,DV=1.5 mm),对电极和参比电极嵌入大脑皮下组织的相对固定位置。连接电化学工作站后,采用980 nm激光器作为激发光源(间隔10 s,激发10 s),在0 V的偏置电压下记录光电流信号。
所有动物实验均按照中国动物福利委员会实验动物护理和使用指南进行,并经湖北大学动物伦理与福利委员会批准。
2 结果与讨论
2.1 实验原理
如图1所示,在980 nm激发光的照射下,UCNPs将近红外光转换为545 nm的可见光,从而激发电极表面的光电活性材料(CdTe QDs)产生光电流信号。当cATP通过碱基互补配对偶联到UCNPs表面后,由于UCNPs与TAMRA之间发生FRET,UCNPs的发光被TAMRA猝灭,导致CdTe QDs难以被激发,光电流信号猝灭。当目标物ATP存在时,由于ATP与适配体之间的高亲和力作用,cATP与ATP结合从而脱离UCNPs表面,TAMRA与UCNPs之间距离增大,FRET过程被抑制,UCNPs的上转换发光恢复,进而激发电极表面CdTe QDs产生较大的光电流信号,且ATP浓度与光电流信号呈正相关。
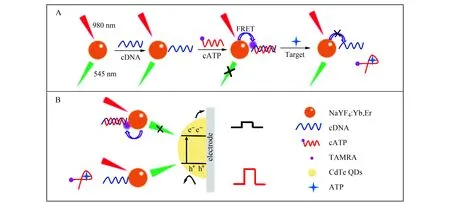
图1 基于FRET原理的PEC传感平台检测ATP原理图Fig.1 The principle of the FRET modulated PEC sensor for the detection of ATP
2.2 材料表征
对制备UCNPs进行形貌表征。如图2A,根据透射电镜(TEM)结果,可以看出UCNPs的粒径均匀(30 nm左右)。利用X-射线粉末衍射(XRD)测试UCNPs结构,如图2B,其衍射峰位置与β-NaYF4(JCPDS No.16-0334)一致,表明所制备的UCNPs为六方相结构。用PAA对UCNPs进行羧基功能化,不仅可以增加了UCNPs水溶性,也有利于UCNPs后续的生物修饰。如图2C,由傅里叶变换红外光谱(FTIR)结果可以看出,1 712 cm-1处出现了C=O基团的特征振动峰,表明PAA的成功修饰。此外,还对PAA-UCNPs进行了Zeta电势分析,从图2D中可以看出,UCNPs的Zeta电位为+37 mV,PAA修饰后的UCNPs变为-19 mV,Zeta电势分析进一步证明了PAA的成功修饰。
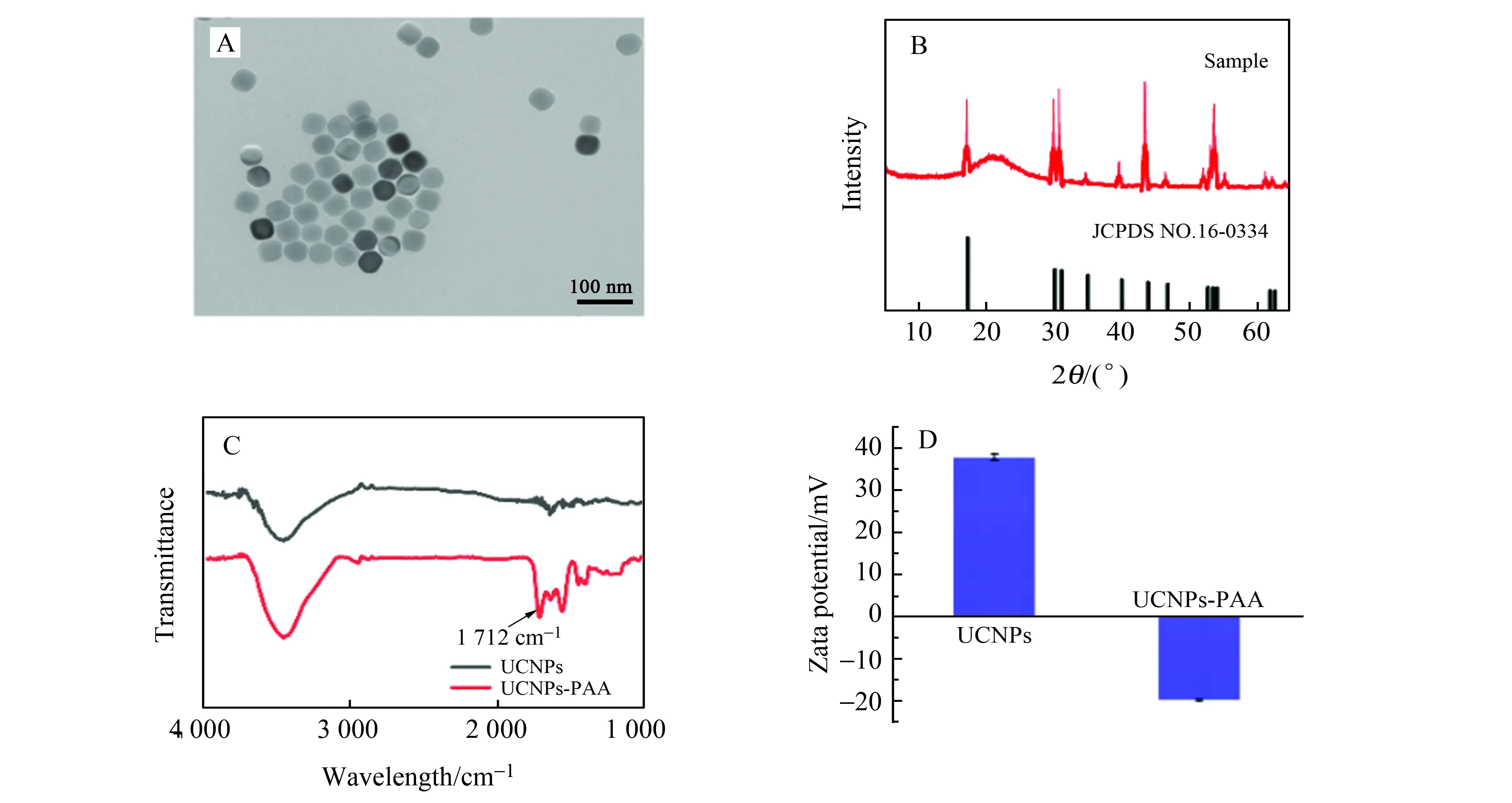
图2 (A)UCNPs的TEM图;(B)UCNPs的XRD分析;(C)UCNPs(黑色)与PAA-UCNPs(红色)的FT-IR分析;(D)UCNPs(左)与PAA-UCNPs(右)的Zeta电势分析Fig.2 (A) TEM image of UCNPs;(B) XRD patterns of UCNPs;(C) FT-IR spectra of UCNPs(black) and PAA-UCNPs(red);(D) Zeta potential of UCNPs(left) and PAA-UCNPs(right)
2.3 光谱分析
为了验证UCNPs的上转换发光能否有效激发CdTe QDs,测试了UCNPs发射光谱和CdTe QDs的紫外/可见吸收光谱。如图3A所示,在980 nm近红外光的激发下,UCNPs在545 nm有一个较大的发射峰(蓝色曲线),而CdTe QDs在545 nm处有较大吸收(红色虚线),光谱分析结果表明UCNPs的上转换发光波长在CdTe QDs的吸收波长范围内,满足激发CdTe QDs的条件。测试了染料TAMRA的吸收光谱,TAMRA最大吸收波长在550 nm左右(绿色虚线),与上转换纳米颗粒的发射光谱(545 nm)匹配,说明当两者距离足够近时,能够发生FRET。将cDNA和TAMRA-cATP修饰到UCNPs表面后,UCNPs在545 nm处的发光被猝灭,并且TAMRA-cATP浓度的升高而逐渐减弱(图3B)。进一步地,当UCNPs/cDNA/TAMRA-cATP与ATP反应后,随着TAMRA-cATP与ATP结合并脱离UCNPs表面,UCNPs的荧光恢复,并且随着ATP浓度的升高,UCNPs的发射强度逐渐增加。以上实验结果表明,TAMRA与UCNPs之间能够发生FRET,同时ATP能够通过与cATP之间的高亲和性结合调控FRET效率,进而影响UCNPs的上转换发光强度。

图3 (A)UCNPs的归一化荧光光谱、TAMRA和CdTe QDs的吸收光谱;(B)UCNPs/cDNA与不同浓度cATP组装后的荧光光谱;(C)UCNPs/cDNA/TAMRA-cATP与不同浓度ATP反应后的荧光光谱Fig.3 (A) Normalized fluorescence spectrum of UCNPs excited at 980 nm,the UV/Vis absorption spectra of TAMRA and CdTe QDs;(B) Fluorescence spectra of UCNPs/cDNA assembling with different concentrations of cATP;(C) Fluorescence spectra of UCNPs/cDNA/TAMRA-cATP reacting with different concentrations of ATP
2.4 FRET调控光电流信号的可行性
将光电材料和UCNPs组成的荧光探针依次修饰到微电极上,并测试了不同修饰电极的光电流响应。由于CdTe QDs-MWCNTs在980 nm波长处的吸收很弱,因此在980 nm的近红外光的激发下,只有CdTe QDs-MWCNTs修饰微电极表现出微小的光电流信号(图4曲线a)。当CdTe QDs-MWCNTs和UCNPs共同修饰到微电极表面后,UCNPs/CdTe QDs-MWCNTs/微电极在含有200 μmol/L AA的aCSF中表现出最强的光电流信号,为315.2 nA(图4曲线b),说明UCNPs的发光能够有效激发CdTe QDs并产生光电流信号。修饰cDNA后,cDNA/UCNPs/CdTe QDs-MWCNTs/微电极的光电流略微减小,为285.3 nA(图4曲线c),表明cDNA在电极表面的成功修饰。将TAMRA-cATP修饰到UCNPs后,由于TAMRA对UCNPs发光的猝灭作用,TAMRA-cATP/cDNA/UCNPs/CdTe QDs-MWCNTs/微电极的光电流显著降低,为91.3 nA(图4曲线d)。TAMRA-cATP/cDNA/UCNPs/CdTe QDs-MWCNTs/微电极与ATP(80 nmol/L)反应后,光电流明显增强,为185.5 nA(图4曲线e)。以上实验结果表明,ATP与适配体之间的特异性结合能够引起光电流信号的改变。
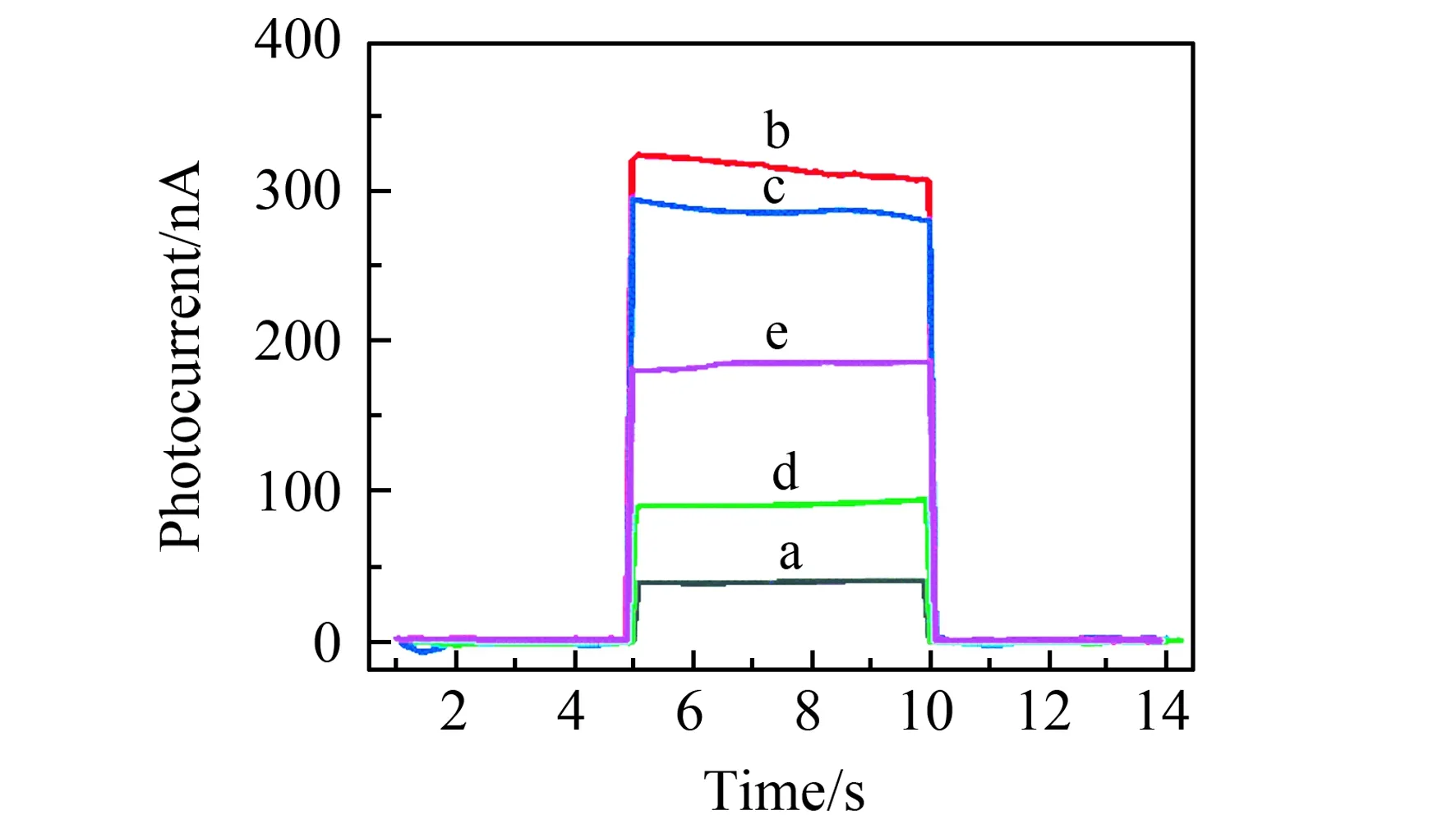
图4 不同修饰电极的光电流大小:(a)CdTe QDs-MWCNTs/微电极;(b)UCNPs/CdTe QDs-MWCNTs/微电极;(c)cDNA/UCNPs/CdTe QDs-MWCNTs/微电极;(d)TAMRA-cATP/cDNA/UCNPs/CdTe QDs-MWCNTs/微电极;(e)TAMRA-cATP/cDNA/UCNPs/CdTe QDs-MWCNTs/微电极与ATP反应后Fig.4 Photocurrent of different modified electrodes:(a) CdTe QDs-MWCNTs/Microelectrode;(b) UCNPs/CdTe QDs-MWCNTs/Microelectrode;(c) cDNA/UCNPs/CdTe QDs-MWCNTs/Microelectrode;(d) TAMRA-cATP/cDNA/UCNPs/CdTe QDs-MWCNTs/Microelectrode;(e) TAMRA-cATP/cDNA/UCNPs/CdTe QDs- MWCNTs/Microelectrode after reacting with ATP
2.5 传感器对ATP的响应研究

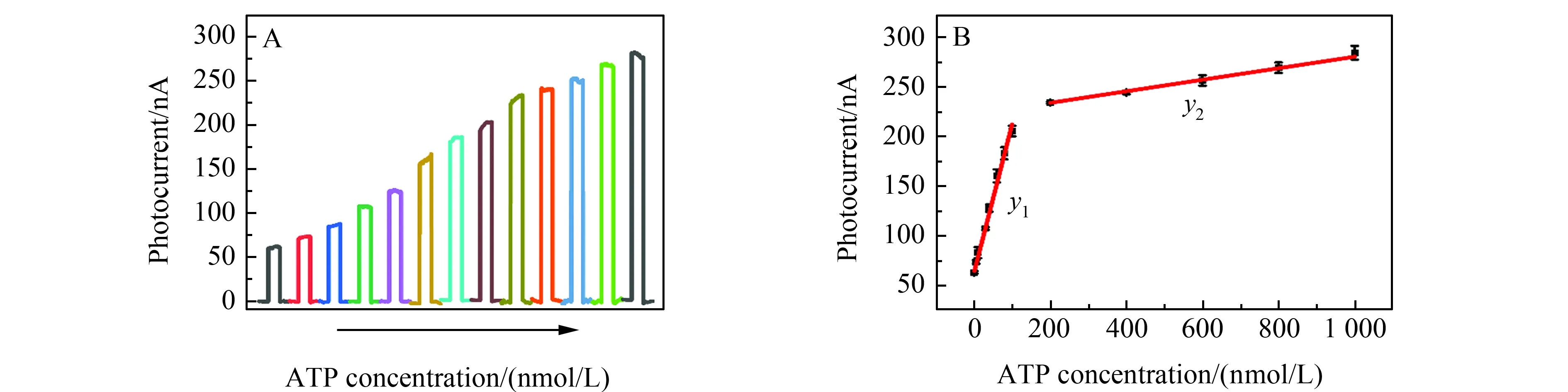
图5 (A)微传感器与不同标准浓度ATP反应后的光电流响应;(B)光电流大小与ATP浓度之间的线性关系Fig.5 (A) Photocurrent responses of the constructed microsensors with different concentrations of ATP;(B) Linear relationship between photocurrent and ATP concentration concentrations of ATP:1,5,10,30,40,60,80,100,200,400,600,800,1 000 nmol/L.
2.6 传感器的选择性研究
由于活体环境复杂,传感器的选择性对活体分析十分重要。因此,我们考察了活体生物环境中共存的一些结构类似物、阴阳离子和氨基酸等物质对微传感器的影响。如图6所示,共存物质对微传感器的光电流信号基本没有影响或者影响较小,当加入ATP时,光电流显著增加,说明该微传感器对ATP具有很高的特异性。
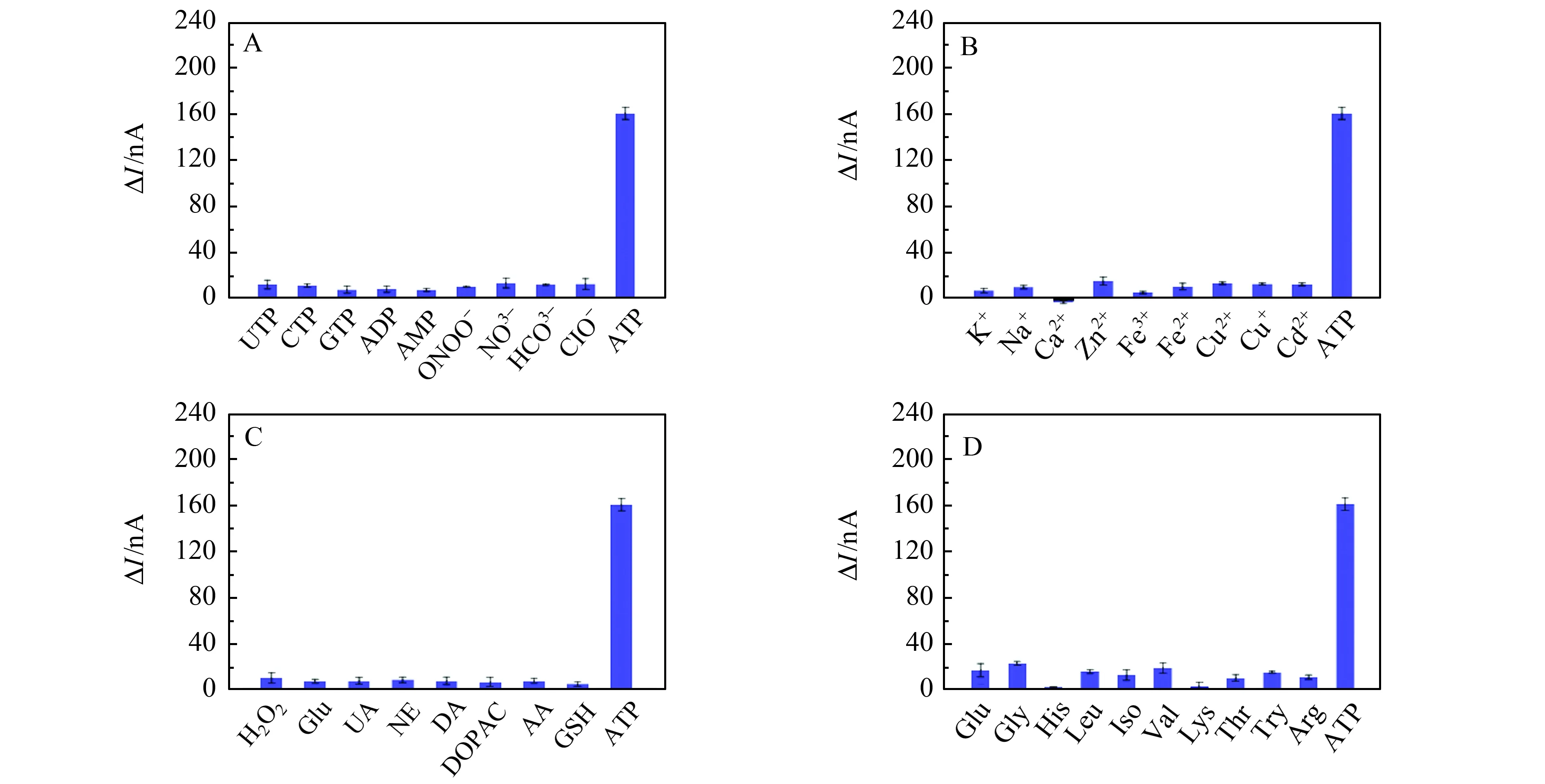
图6 选择性测试Fig.6 Selectivity test
2.7 LPS的注射量对ATP含量的影响
LPS是一种常见的内毒素,可以诱导小鼠全身性炎症,我们通过腹腔注射LPS建立小鼠全身性炎症模型,并用制备的微电极活体原位检测小鼠脑内细胞间质中ATP的水平变化。我们首先研究了不同LPS注射量对小鼠皮质内ATP水平的影响。如图7所示,腹腔分别注射3 mg/kg、5 mg/kg、7 mg/kg时,光电流分别为35.1 nA、47.0 nA、59.1 nA。相比于对照组(0 mg/kg)光电流信号分别增加了95.0%、161.1%、228.3%。实验结果表明LPS诱导的炎症会引起脑内ATP水平的显著升高,并且ATP水平会随着LPS浓度的增加而进一步升高,说明大脑向胞外释放ATP是应对炎症的方式之一。

图7 (A)TAMRA-cATP/cDNA/UCNPs/CdTe QDs-MWCNTs/微电极在不同浓度LPS诱导下的活体小鼠脑内的光电流响应;(B)不同浓度LPS诱导下ATP水平的变化Fig.7 (A) Photocurrent response obtained at TAMRA-cATP/cDNA/UCNPs/CdTe QDs-MWCNTs/Microelectrode in cerebral cortex of living mice brains induced by different concentration of LPS;(B) The levels of ATP in mice brains induced by different concentration of LPS
2.8 炎症时间对ATP浓度的影响研究
我们将制备的微电极用于LPS诱导的全身炎症小鼠模型中,活体原位检测不同时间点脑内ATP的含量变化,研究了药物诱导时间与脑内细胞间质中ATP水平变化的关系。如图8所示,在2~6 h内,光电流信号随着LPS注射时间的增加而增大,在LPS注射6 h时,光电流信号达到峰值(47.2 nA),之后(6~24 h内)基本保持不变。实验结果表明:LPS诱导的炎症会引起脑内ATP含量的增加,并且随着药物诱导时间的推移,ATP的释放进一步增加,在6 h后达到峰值,并且在24 h内一直维持在高位,说明炎症持续时间较长。
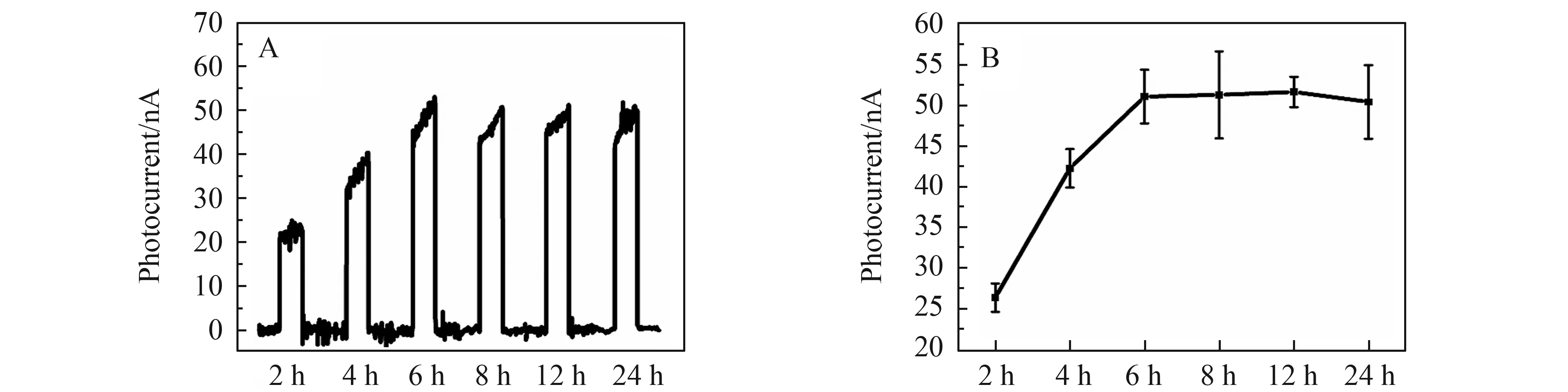
图8 (A)TAMRA-cATP/cDNA/UCNPs/CdTe QDs-MWCNTs/微电极在LPS注射后的不同时间点所获得的活体小鼠脑内的光电流响应;(B)LPS诱导后脑内ATP水平随时间的变化Fig.8 (A) Photocurrent response obtained at TAMRA-cATP/cDNA/UCNPs/CdTe QDs-MWCNTs/Microelectrode in cerebral cortex of living mice brains at different time point after LPS injection;(B) The levels of ATP in mice brains over time after LPS injection
3 结论
本工作针对光电化学传感技术在活体分析应用中的难点,即紫外/可见光的组织穿透深度不足,而大多数光电活性材料难以被近红外光激发的问题,引入了上转换纳米颗粒作为近红外光的接收器和转换器,构建了基于光学调控原理的光电化学微传感器。所制备的微传感器对ATP具有灵敏、特异性响应,光电流信号与ATP浓度在生理浓度范围内呈现良好的线性关系。最终,构建的微传感器成功应用于药物诱导炎症模型小鼠脑内ATP的活体原位检测,并初步探索了炎症水平与ATP释放之间的关系。本工作不仅提高了激发光的组织穿透深度,有利于光电化学活体分析应用,也拓展了活体分析中光电活性材料的选择范围。将为探讨ATP在脑疾病中的作用提供很好的活体分析工具。

