基于代谢组学技术分析睡莲花朵不同组织的代谢产物差异
唐毓玮,李佳慧,毛立彦 ,龙凌云,黄秋伟,於艳萍,苏 群,王妍虹
(1.广西壮族自治区亚热带作物研究所,南宁 530001;2.广西农业科学院花卉研究所,南宁 530007)
【研究意义】睡莲属(Nymphaea) 隶属于睡莲科(Nymphaeaceae),是世界温带至热带地区重要的水生花卉,该属有50多个原种(含变种),我国分布的睡莲属原种(含变种)有5个[1-2]。睡莲花朵中含有黄酮类、酚酸类、生物碱及多糖等多种活性成分,在功能性食品、化妆品和传统医药等领域应用潜力巨大[3]。植物花朵中不同组织的活性成分存在差异,针对睡莲花朵不同组织的代谢特点进行活性成分提取,可以降低其开发利用成本,但目前对睡莲花朵不同组织(花瓣、雌蕊和雄蕊)的优势活性成分尚不了解。非靶向代谢组学技术能同时检测样本的数百乃至数千种代谢物(包括已知和未知代谢物),具有耗时短及高通量特点,已在多种植物上应用[4]。因此,利用非靶向代谢组学技术对睡莲花朵进行代谢产物的鉴定与分析,有助于全面了解睡莲花朵不同组织的营养和药用成分,对睡莲的开发利用具有重要意义。【前人研究进展】睡莲花朵不仅具有较高的观赏价值,还可用于花茶和精油加工[5-6],其茶汤和提取物具有丰富的类黄酮和较高的抗氧化活性[7-8]。睡莲花朵在维吾尔族医药中应用历史悠久,常用于感冒发热、头痛咳嗽和咽痛等疾病的治疗[9]。新疆维吾尔自治区药物研究所致力于睡莲花朵有效成分抗肝纤维化研究,发现睡莲花朵中总黄酮对四氯化碳(CCl4)诱导的小鼠肝纤维化具有保护作用[10],从体外细胞试验层面证实睡莲中的酚类物质能减缓氧化应激造成的肝细胞损伤[11],花朵中分离出的代谢物异窄单宁(Isostrictiniin)对Con A诱导的小鼠肝损具有保护作用[12]。睡莲的药用价值也引起了国外学者的关注,Laila等[13]研究发现,代谢物Nymphayol(1种睡眠药)对乳腺癌MCF-7细胞具有明显的抗增殖作用。Rajagopal等[14]采用不同剂量睡莲花朵提取物开展糖尿病大鼠饲喂试验,发现睡莲花朵提取物对四氧嘧啶诱导的糖尿病大鼠具有降低血糖和血脂作用。Alam等[15]通过体外细胞试验证实睡莲花朵提取物具有一定的抗氧化能力。代谢组学是研究生物体内源代谢物种类、数量及其在不同因素作用下变化规律的一门学科,是系统生物学的重要组成部分[4]。植物在长期进化过程中产生了大量结构不同的小分子代谢物,这些代谢物不仅促进植物生长发育,而且是人类食物和药物的重要来源[16]。Chen等[17]运用代谢组学技术从铁观音植株中鉴定到其花朵特有的代谢物三香豆酰亚精胺和双香豆酰腐胺。Zou等[18]运用代谢组学技术鉴定了黄色和白色肉质枇杷味道差异的关键成分。岳文杰等[19]利用非靶向代谢组学技术揭示了白茶自然萎凋过程中类黄酮、原花青素和糖苷衍生物的变化规律。【本研究切入点】目前,已有研究对睡莲花朵进行化学成分分析,但针对睡莲不同花器官代谢特异性的研究鲜见报道。【拟解决的关键问题】以热带睡莲品种‘巴拿马’(Nymphaea‘Panama pacific’)为试验材料,利用非靶向代谢组学技术研究睡莲花朵不同组织的代谢特异性,为促进睡莲花朵活性成分在提取、加工和功能食品领域中的精准应用提供参考依据。
1 材料与方法
1.1 试验材料
试验于2020年7月在广西壮族自治区亚热带作物研究所实验室进行,睡莲品种‘巴拿马’种植于广西壮族自治区亚热带作物研究所睡莲种质资源圃,该品种属于广热带亚属睡莲,非常适宜在热带和亚热带地区繁殖生长,其花瓣呈蓝紫色,花香浓郁,是用于睡莲花茶加工的主要品种之一。
1.2 试验方法
1.2.1 试验设计 睡莲品种‘巴拿马’均采用相同农艺措施种植,每天早上10:00—11:00随机采集不同单株初开的花朵,连续采摘5 d(即5个生物学重复)。采摘后立即带回实验室,用自来水清洗,然后用灭菌剪刀将花朵的花瓣、雌蕊和雄蕊分离,再用PBS缓冲液冲洗,分别将不同单株上花朵的花瓣混合为一个样品H,雌蕊混合为一个样品C,雄蕊混合为一个样品X,立即放入液氮中,然后转入超低温冰箱-80 ℃保存备用设。设5个生物学重复,共15份试验样品。
1.2.2 代谢物提取与检测 分别对-80 ℃保存的3组样品进行液氮研磨,各称取约0.3 g,分别置于15 mL EP管1中,加入2 mL甲醇冰浴超声30 min,12 000 r/min离心10 min,从EP管1中取出1 mL上清液于2 mL EP管2中,在37 ℃下真空离心浓缩至干。再向EP管1中加入2 mL甲醇冰浴超声30 min,12 000 r/min离心10 min,从EP管1中取出1 mL上清液于EP管2中,再次真空离心浓缩至干。残渣用200 μL甲醇溶解,于12 000 r/min,4 ℃下离心10 min,取上清液进样1 μL,使用UPLC-M检测上清液中的代谢物。
1.2.3 液相色谱—质谱分析 利用超高液相色谱进行物质分离(Nexera UHPLC LC-30A,SHIMADZU)和串联质谱(MASS TripleTOF5600+,AB SCIEXTM)对样本进行分析。①色谱条件:色谱柱为Waters HILIC BEH Column(100 mm×3 mm,1.7 μm),柱温35 ℃,流速0.300 mL/min。流动相:水相为0.1%乙酸—水(A溶剂),有机相为乙腈(B溶剂)。洗脱梯度:0 min比例为5%A∶95%B,10 min比例为50%A∶50%B,13 min比例为95%A∶5%B,14 mim比例为5%A∶95%B,15 min比例为5%A∶95%B。②质谱条件:分别采用电喷雾电离(ESI)正离子和负离子模式进行检测。ESI源条件:Ion Source Gas1为50 psi,Ion Source Gas2为50 psi,Curtain Gas为25 psi,Source Tempreture为500 ℃(正离子)和450 ℃(负离子),Ion Sapary Voltage Floating为5500 V(正离子)和4400 V(负离子),TOF MS scan range为100~1200 Da,Product ion scan range为50~1000 Da,TOF MS scan accumulation time为0.20 s,Product ion scan accumulation time为0.01 s,二级质谱采用Information dependent acquisition(IDA)获得,并采用High sensitivity模式,Declustering potential为±60 V,Collision Energy为(35±15)eV。
1.3 统计分析
1.3.1 数据预处理和多元统计分析 通过Analysis base file converter将液相色谱—质谱联用仪(LC-MS)获得的原始数据转换成ABF格式,将ABF格式文件导入MS-DIAL 4.10[20]进行预处理,包括峰提取、去噪音、反卷积和峰对齐,导出CSV格式的三维数据矩阵[包括样品信息、保留时间、质核比和质谱响应强度(峰面积)]。将提取的信息与数据库进行比对,对MassBank、Respect和GNPS 3个库进行全库检索,将得到的代谢组数据进行多元统计分析,对3组样本进行主成分分析(PCA),在最大程度保留原始数据的基础上将多维复杂的数据进行降维处理,建立可靠模型对样本的代谢特征进行归纳和总结。
1.3.2 差异代谢物筛选和富集分析 将0.5<相对含量差异倍数(Fold change,FC值)<2.0及T检验P<0.05的代谢物定义为差异代谢物。利用单变量分析的P和FC值筛选差异代谢物,并以TBtools[21]绘制火山图、聚类热图和韦恩图等,同时将得到的相应差异代谢物使用MBRole 2.0[22]进行京都基因和基因组百科全书(KEGG)pathway富集分析,基于KEGG的注释进一步了解代谢物的生物学功能。以R语言Ggplot绘制富集气泡图。
2 结果与分析
2.1 多元统计分析
为了解睡莲花朵不同组织的代谢成分差异,使用LC-MS对睡莲的雌蕊、雄蕊和花瓣进行非靶向代谢组学分析,共检测到1084个代谢物,其中有956个代谢物注释到相应的分类(Ontology)。为了解不同花器官之间的代谢物积累情况,对花瓣(H)、雌蕊(C)、雄蕊(X)3个样品进行主成分分析,从主成分分析得分图(图1)可看出,第一主成分(PC1)的有效解释率R2X[1]为29.1%,第二主成分(PC2)的有效解释率R2X[2]为26.8%,雌蕊的主成分分析位点均分布于第二象限,雄蕊的主成分分析位点均分布在第四象限,而花瓣的主成分分析位点均分布在第三象限,主成分分析位点均分布在Hotelling’s T2(95%)置信椭圆中,表明所有样本均具有统计学意义,3组样品明显分离于不同象限,表明睡莲花朵雌蕊、雄蕊和花瓣中代谢物的含量差异明显。
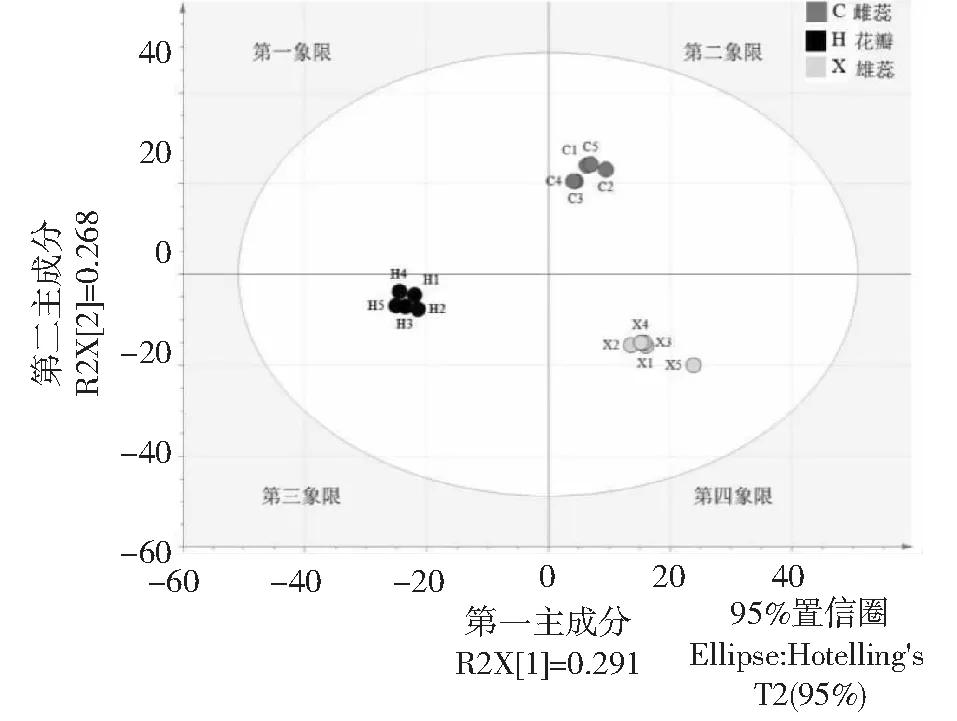
图1 睡莲花朵不同组织的主成分分析得分Fig.1 Principal component analysis scores in different tissues of water lily flowers
由载荷图(图2)可看出,代谢物的分布明显集中在3个区域。其中,第一簇代谢物主要集中分布在第二象限,结合主成分分析得分图(图1)可知,第二象限也是雌蕊主成分分析位点集中的位置,由此判断,汇集于第二象限代谢物的相对含量在雌蕊中较高,是雌蕊的优势代谢物;第二簇代谢物主要集中分布在第三象限,第三象限代谢物的相对含量在花瓣中较高,属于花瓣的优势代谢物;第三簇代谢物集中分布在第四象限,是睡莲雄蕊的优势代谢物,与第二和第三象限的两簇代谢物略有不同,位于第四象限的代谢物分布更集中紧密。因此,相较睡莲的花瓣和雌蕊,雄蕊可能具有更高的代谢特异性。

图2 睡莲花朵不同组织的代谢产物Fig.2 Metabolites in different tissues of water lily flowers
2.2 差异代谢物的筛选
依次将花瓣(H)、雄蕊(X)、雌蕊(C)的代谢物进行两两比较,在雌蕊(C)与花瓣(H)的比较组中(图3),差异代谢物共有553个,上调的代谢物有345个,下调的代谢物有208个(C vs H下调的代谢物即为H vs C上调的代谢物,另两个比较组同理);在雌蕊(C)与雄蕊(X)的比较组中(图4),差异代谢物共有569个,上调的代谢物有240个,下调的代谢物有329个;在花瓣(H)与雄蕊(X)的比较组中(图5),差异代谢物共有613个,上调代谢物199个,下调代谢物414个。将各比较组的上调代谢物进行交集,可得到该样本相对于花朵其他组织共同上调的代谢物。花瓣(H)相对于雌蕊(C)和雄蕊(X),共有138个代谢物上调,将这138个代谢物命名为H_up代谢集,并视为花瓣(H)的优势代谢物(图6)。同理,雌蕊(C)相对于花瓣(H)和雄蕊(X),有165个代谢物上调,命名为C_up代谢集,视为雌蕊(C)的优势代谢物(图7),雄蕊(X)的X_up代谢集包含206个代谢物,视为雄蕊(X)的优势代谢物(图8)。可见,睡莲花瓣(H)中的优势代谢物数量较少,仅138个,而雄蕊(X)中优势代谢物数量较多,有206个。

图3 睡莲雌蕊(C)与花瓣(H)差异代谢物Fig.3 Differential metabolites between pistil(C)and petal(H)of water lily
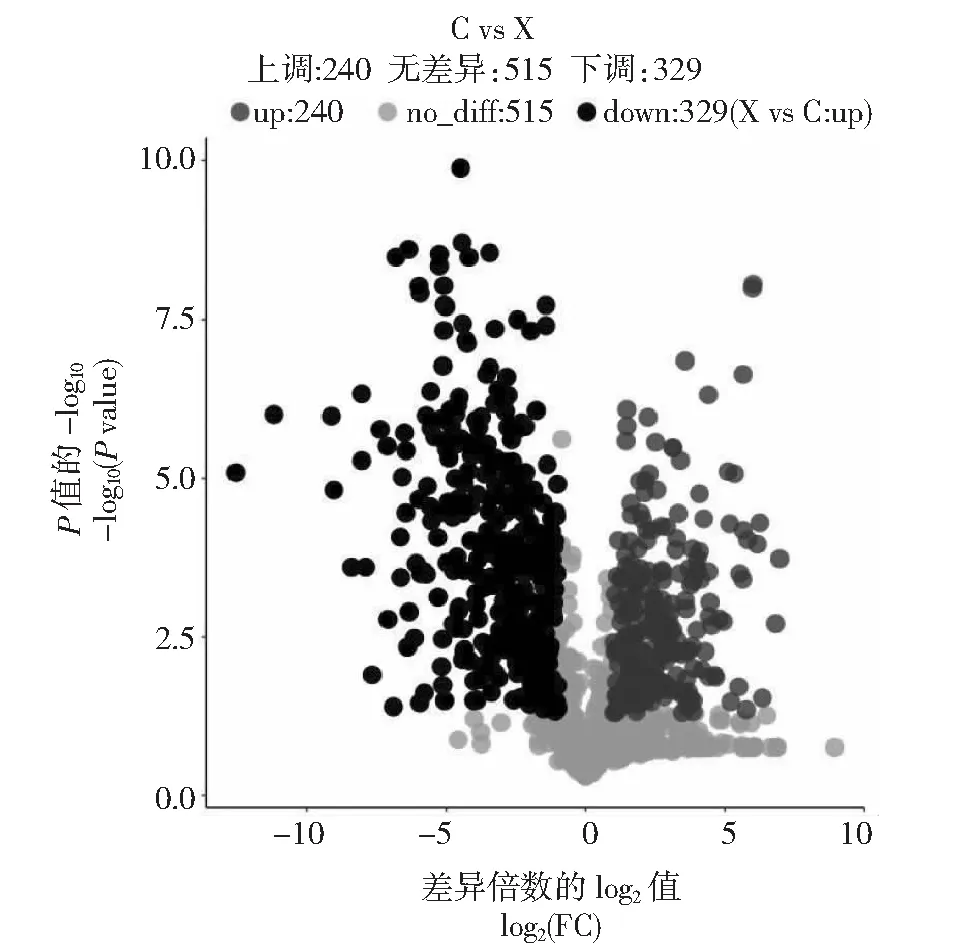
图4 睡莲雌蕊(C)与雄蕊(X)差异代谢物Fig.4 Differential metabolites between pistil(C) and stamen(X) of water lily

图5 睡莲花瓣(H)与雄蕊(X)的差异代谢物Fig.5 Differential metabolites between petals(H)and stamens(X)of water lily

图6 睡莲花瓣(H)优势代谢物Fig.6 Water lily petals specific metabolites
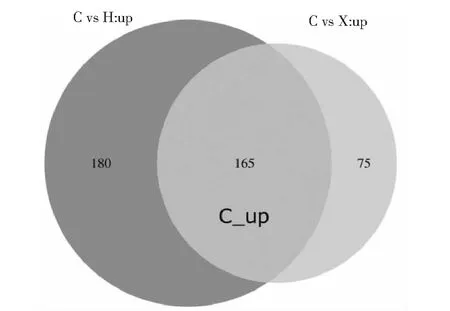
图7 睡莲雌蕊(C)的优势代谢物Fig.7 Water lily pistil(C) specific metabolites

图8 睡莲雄蕊(X)优势代谢物Fig.8 Water lily stamen(X) specific metabolites
2.3 优势代谢物的代谢通路分析
分别将H_up、C_up和X_up 3个代谢集上传至MBRole 2.0进行KEGG id转化。其中,C_up的165个代谢物中有72个获得相应的KEGG id,H_up的138个代谢物中有56个获得相应的KEGG id,X_up的206个代谢物中有86个代谢物获得相应的KEGG id。结果(图9)显示,在C_up的代谢集中,代谢物显著富集在烟酸和烟酰胺代谢(富集因子=0.068)(P<0.05,下同)、苯丙烷类化合物生物合成(富集因子=0.062)、氰基氨基酸代谢(富集因子=0.073)和类黄酮生物合成(富集因子=0.058)通路,H_up显著富集在苯丙烷类化合物生物合成(富集因子=0.082)、TCA循环(富集因子=0.100)和类黄酮生物合成(富集因子=0.073)通路,X_up代谢集显著富集在吲哚生物碱生物合成(富集因子=0.063)、黄酮和黄酮醇生物合成(富集因子=0.090)及植物激素生物合成(富集因子=0.059)通路。

富集因子为差异代谢物位于该Pathway的数量与全部有注释代谢物位于该Pathway的代谢物总数的比值Rich factor is the ratio of the number of differential metabolites located in the pathway to the total number of metabolites with all annotated metabolites located in the pathway图9 睡莲花朵不同组织优势代谢物的KEGG富集Fig.9 KEGG enrichment of dominant metabolites in different tissues of water lily flowers
由表1可知,睡莲雌蕊和花瓣的较多优势代谢物共同参与苯丙烷类化合物的生物合成,其中包括富马酸、阿魏酸、松柏醛、金雀异黄素、表儿茶素、罗汉松树脂酚、苹果酸、异柠檬酸、山奈酚和矢车菊素等14种活性物质。此外,雌蕊中天冬氨酸的相对含量分别约为雄蕊的2.25倍和花瓣的9.01倍,酪氨酸的相对含量分别约为雄蕊的5.20倍和花瓣的2.78倍,谷氨酸的相对含量分别约为雄蕊的2.79倍和花瓣的6.14倍;雄蕊中四氢鸭脚木碱和长春新碱等生物碱成分的相对含量较高,其中,四氢鸭脚木碱的相对含量分别约为雌蕊的2.06倍和花瓣的5.09倍,而长春新碱的相对含量远高于雌蕊和花瓣,分别约为雌蕊的1192.00倍和花瓣的553.00倍。可见,雌蕊中含有较高的氨基酸类物质,雄蕊中含有较高的生物碱物质。

表1 睡莲花朵不同组织特异性代谢物显著富集的代谢通路
3 讨 论
睡莲花色丰富,形态多样,在水生园林景观中应用广泛[23],除观赏价值外,睡莲的食用和药用价值也已逐渐得到挖掘[3]。睡莲花型较大,单花直径可达15~20 cm,对其活性成分的高效提取存在一定困难,因此,需充分了解不同花器官的优势活性成分。Zhu等[24]对35个不同色系热带睡莲的花瓣进行检测,鉴定出飞燕草素、矢车菊素等花青素及其衍生物。本研究中,通过非靶向代谢组学技术从蓝色系睡莲‘巴拿马’的花瓣、雌蕊和雄蕊中检测到相应的代谢物,其中,矢车菊素在花瓣中的相对含量更高,而飞燕草素在雌蕊中含量可能更高;雌蕊和花瓣的优势代谢物虽然不同,但是均显著富集到苯丙烷类化合物生物合成和类黄酮生物合成2条代谢通路,说明雌蕊和花瓣2个花器官可能具备相同的生物学功能。苯丙烷代谢途径是生物体内次生代谢的重要途径,一切含苯丙烷骨架的苯丙烷类化合物都是该途径的直接或间接产物,该途径中的化合物在生物体内具有多种多样的生理功能[25]。黄酮类化合物主要由本丙烷类化合物衍生,经不同合成途径形成,如本研究中睡莲雌蕊的优势代谢物表儿茶素由苯丙烷化合物的生物合成途径形成,花瓣的优势代谢物柚皮素、山奈酚和矢车菊素由类黄酮生物合成途径合成,雄蕊的优势代谢物芦丁由黄酮和黄酮醇的生物合成途径合成。
雌蕊是产生雌配子、接受花粉和孕育子代的重要组织。郭玉华等[26]研究发现,睡莲子房提取物中含有17种氨基酸,且绝大多数氨基酸含量显著高于睡莲其他组织。本研究也得到相似的结果,天冬氨酸、酪氨酸和谷氨酸是睡莲雌蕊的优势代谢物,其含量高于睡莲花朵的其他组织。这些氨基酸不仅在植物、人体生长发育中发挥重要生理作用,还可用于食品增味剂等轻工业领域[27]。
热带睡莲花朵中约有70%的挥发性物质来源于雄蕊[28],因此雄蕊主要应用于精油研究和开发。黄秋伟等[6]通过超临界CO2工艺萃取睡莲精油,并从精油中分离出42种挥发性物质。郭玉华等[29]报道,海南野生延药睡莲(NymphaeastellataWilld.)花的主要挥发成分是二十一烷(Heneicosane)、香叶基香叶醇(Geranylgeraniol)、二十四烷(Tetracosane)和二十八烷(Octacosane)。关于睡莲挥发性物质的研究已有较多报道,但关于睡莲雄蕊非挥发性成分的研究鲜见报道。本研究发现,睡莲雄蕊中的长春新碱和四氢鸭脚木碱含量相对较高。吲哚类生物碱是迄今发现最多的一种生物碱类型,主要通过莽草酸途径生成色氨酸后经过次生代谢而合成[30],其中长春新碱为目前应用最广的天然抗癌药物,主要用于治疗急性淋巴白血病、何杰金氏病、乳腺癌和恶性淋巴瘤等疾病[31]。因此,睡莲的雄蕊作为天然原料在医药领域具有一定的开发潜力。
非靶向代谢组学技术属于高通量检测方法,可用于代谢物的初步挖掘,但准确性相对较低,因此,还需进一步运用靶向代谢组学技术对本研究挖掘到的长春新碱、表儿茶素、矢车菊素、芦丁、柚皮素和山奈酚等多种具有抗氧化、抗炎和抗癌作用的活性成分[32-34]进行绝对定量研究,为睡莲花朵活性成分的提取、加工及在功能食品领域中的精准应用提供科学依据。
4 结 论
睡莲花朵不同组织间的代谢物含量差异明显,优势代谢物显著富集到苯丙烷类化合物生物合成、类黄酮生物合成、黄酮和黄酮醇生物合成及吲哚生物碱生物合成等8个代谢通路。利用非靶向代谢组学技术能初步筛选睡莲花朵不同组织的优势代谢产物。

